МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ II - А. В. ПИНЕВИЧ - 2007
ГЛАВА 9. ОСНОВЫ ПИТАНИЯ ПРОКАРИОТОВ
Je regarde l’organisation comme une qualité essentielle à la matière, qualité aussi essentielle que l’étendue; & j’en fais la base des facultés communes à tous les Etres, qui sont celles de se nourrir, de croître d’engendrer.
(Я считаю организацию существенным качеством материи, столь же существенным, что и протяженность; и я вижу в ней основу таких общих всем существам способностей, как способности питаться, расти и размножаться)
Robinet. De la Nature (1766)
Живые организмы, в том числе прокариоты, представляют собой открытые термодинамические системы, которые обмениваются с внешней средой энергией, химическими субстратами и информацией.
Для возобновления внутриклеточных ресурсов энергии и химических субстратов прокариоты используют внешние ресурсы, что в отсутствии лимитирующих факторов позволяет им размножаться в геометрической прогрессии.
Доступ прокариотов к внешним ресурсам энергии и химических субстратов осуществляется путем питания, или трофии (греч. trophe —пища).
Питанием называется совокупность процессов, с помощью которых организмы используют в своей жизнедеятельности экзогенные энергоносители и строительные материалы.
При питании организмы расходуют энергию на поглощение питательных субстратов и выведение отработанных продуктов жизнедеятельности.
Питание высших животных представляет собой многоуровневый процесс, основанный на: а) захвате и измельчении пищи, б) полостном пищеварении, в) эндоцитозе жидкого или твердого материала, г) трансмембранном переносе индивидуальных молекул. Хотя высшие растения и грибы также имеют специализированные органы субстратного питания, они работают только как поглотительные системы, т. е. по осмотрофному принципу.
Что касается протистов и прокариотов, то у них питание происходит исключительно на клеточном уровне и подразделяется на субстратное и энергетическое.
Субстратное питание. Этот тип питания включает в себя два разных по своей природе процесса:
— трофический клеточный транспорт (он состоит из доставки в цитоплазматический компартмент питательных субстратов, или импорта, и выведения из клетки продуктов жизнедеятельности, или экспорта);
— метаболизм, который обеспечивает химическое превращение импортированного материала.
Энергетическое питание. Если в роли энергоносителя выступает органическое вещество, энергетическое питание состоит из импорта и метаболизма. Если же энергоносителем служит электромагнитное излучение или окисляемый вне цитоплазмы неорганический субстрат, то импорт не требуется, и энергетическое питание сводится к метаболизму.
Ассимиляция и диссимиляция. При энергетическом и субстратном питании «ничей» энергоноситель и строительный материал «получают собственника» и интегрируются в клетку, что обязательно связано с их преобразованием. Данный процесс происходит благодаря действию метаболических систем и называется ассимиляцией (от лат. as-similis — самоуподобленный, усвоенный).
Противоположно направленный процесс, когда энергоноситель и строительный материал теряют свою биологическую индивидуальность, переходя в абиотическое состояние, называется диссимиляцией (от лат. dissimilis — непохожий, отчуждаемый).
9.1. Клеточный транспорт
Процессы, связанные с клеточным транспортом, обеспечивают совместное функционирование отдельных частей клетки, а также ее взаимодействие с внешней средой. От эффективности клеточного транспорта зависят онтогенез и репродукция, и поэтому он служит одним из важнейших условий сохранения жизнеспособности.
Прокариоты обладают активным ферментативным аппаратом, и им свойственна осмотрофия (т. е. они впитывают питательные субстраты всей своей клеточной поверхностью). Неудивительно, что до 10% их генов кодируют белки, участвующие в клеточном транспорте. Например, у Lactobacillus lactis имеется около 250, а у Е. coli — около 270 разных транспортеров.
Транспортные системы у прокариотов исключительно разнообразны. Применительно к ним используется ключевая терминология, предложенная Питером Митчелом (Р. Mitchell, Нобелевская премия по физиологии и медицине, 1970 г.) в конце 1950-х годов. В уточненном и дополненном виде она отражает новые, ранее неизвестные явления.
Остановимся на терминах, которые понадобятся при дальнейшем изложении.
Пограничный транспорт и внутренний транспорт. Мы уже не раз подчеркивали (см. I том учебника), что прокариоты, в отличие от эукариотов, лишены способности к цитозу. Вследствие этого основные транспортные процессы у бактерий и архей связаны с «поштучным» трансмембранным переносом молекул.
Клеточный транспорт (от лат. trans-porto — переносить) у прокариотов подразделяется на пограничный транспорт и внутренний транспорт.
Пограничным транспортом, или просто транспортом называется перемещение молекул через биологические мембраны.
Внутренний транспорт осуществляется в пределах одного из компартментов — цитоплазматического или периплазматического. В данном случае транспортируемое соединение, находящееся в свободном виде или связанное с белком-переносчиком, диффундирует соответственно в цитоплазме или периплазме. Вариантом внутреннего транспорта является таргетинг (англ. target — мишень), или такое явление, когда молекулярный компонент мембраны или другой внутриклеточной структуры целенаправленно доставляется на место своего функционирования.
Импорт и экспорт. Под импортом в широком смысле слова подразумевается поступление веществ из окружающей среды в клетку, а под экспортом — выделение веществ из клетки в окружающую среду.
Экскреция и секреция. Экскреция — это выведение за пределы цитоплазматического компартмента низкомолекулярных соединений, которые больше не нужны клетке или оказывают на нее вредное воздействие. Примером экскретируемых веществ являются побочные продукты метаболизма или проникшие в клетку экзогенные токсиканты.
Секрецией называется выведение за пределы цитоплазматического компартмента функционально полезных низкомолекулярных или высокомолекулярных соединений. Они входят в состав экстрацитоплазматических структур (например, в ригидный слой клеточной стенки) или функционируют за пределами цитоплазматического компартмента (примером служат сигнальные молекулы, экзоферменты и экзополисахариды).
«Downhill»-транспорт и «uphill»-транспорт. Транспорт всегда связан с перераспределением вещества в пространстве, что приводит к созданию концентрационных градиентов или их выравниванию.
При downhill-транспорте (англ. под гору) экзогенные субстраты переносятся через мембранный барьер вниз по градиенту концентрации.
В свою очередь, при uphill-транспорте (англ. в гору) экзогенные субстраты переносятся вверх по градиенту концентрации.
Первичный транспорт и вторичный транспорт. Согласно Питеру Митчелу, первичным транспортом называются такие механизмы, при помощи которых создается трансмембранный электрохимический потенциал катионов Н+ (см. раздел 10.4.1). В свою очередь, вторичным транспортом называется транспорт субстратов за счет этого потенциала.
При использовании термина «первичный транспорт» не всегда ясно, что именно и как именно транспортируется через мембрану. Классические представления митчеловой эпохи исходили из существования протонных помп, переносящих катионы Н+ через мембрану за счет:
— свободной энергии химического субстрата, окисляемого через дыхательную электрон-транспортную цепь;
— свободной энергии видимого света, преобразуемой в химическую с помощью фотосинтетических реакционных центров;
— свободной энергии гидролиза АТФ.
Сейчас известно, что трансмембранный электрохимический потенциал катионов Н+ может быть создан и в отсутствие их прямого переноса через мембрану. Случается, даже, что трансмембранный электрохимический потенциал катионов Н+ создается благодаря системам вторичного транспорта (см. раздел 10.4.1).
Кроме того, оказалось, что помимо протонных помп существуют и натриевые
помпы, которые позволяют запасать энергию в форме трансмембранного электрохимического потенциала катионов Na+.
Наконец, помимо первичного и вторичного транспорта существует третичный транспорт, использующий энергию, запасенную в результате вторичного транспорта (см. ниже).
Все это необходимо иметь в виду при употреблении терминов «первичный транспорт» и «вторичный транспорт» в их первоначальном или обновленном смысле.
Диффузионный перенос и активный транспорт. В случае диффузионного переноса происходит спонтанное выравнивание концентраций химического вещества между клеткой и окружающей средой. Этот процесс осуществляется по принципу downhill и протекает без затраты клеточной энергии.
При активном транспорте клетка концентрирует субстрат, создавая его градиент между цитоплазмой и окружающей средой. Этот процесс требует затраты энергии и осуществляется по принципу uphill.
Трофический транспорт. Данный тип транспорта связан с проникновением питательных субстратов (например, сахаров) в периплазматический и цитоплазматический компартменты, а также с выходом отходов питания (например, лактата) из этих компартментов. Поскольку некоторые транспортные системы обладают обратимым действием, с их помощью одно и то же вещество (опять же лактат) может поглощаться в качестве питательного субстрата и выделяться в качестве отхода питания.
Экскреция токсикантов и секреция вторичных метаболитов. Данные процессы нужно рассматривать отдельно от трофического транспорта. Благодаря им клетка выделяет проникшие в нее чужеродные токсичные агенты или экспортирует адаптивно синтезированные вторичные метаболиты (см. главу 9.2), которые играют роль сигнальных молекул, воздействующих на клетку извне.
Характерным примером таких транспортных систем являются белки из суперсемейства RND (от англ. resistance-nodulation-division), которые обеспечивают отторжение антибиотиков, химиотерапевтических препаратов и катионов тяжелых металлов, а у клубеньковых бактерий — экспортируют липоолигосахаридные Nod-факторы, регулирующие начальную стадию симбиоза с бобовыми растениями.
Другим примером таких систем служит АсrАВ-ТоIС — транспортная система, обеспечивающая множественную лекарственную устойчивость и выброс токсических соединений. Она имеется у ряда грамотрицательных бактерий (см. I том учебника).
Транспорт макромолекул. Этот вид транспорта также следует рассматривать отдельно от трофического транспорта. В данном случае через мембранные барьеры или в пределах клеточных компартментов переносятся не низкомолекулярные субстраты и метаболиты, а макромолекулы, которые выполняют генетическую, структурную или ферментативную функцию.
Характерными примерами пограничного транспорта макромолекул служат выделение ДНК донором и поглощение ДНК реципиентом при генетической трансформации (см. III том учебника), а также секреция белка (см. I том учебника).
Секретируемый белок, например, гидролитический фермент, иногда может сам участвовать в трофическом транспорте, что обеспечивает последний низкомолекулярными субстратами для импорта. В других случаях секретируются белковые субъединицы ригидных слоев или придаточных структур, токсины и т. д.
В дальнейшем нас в основном будет интересовать трофический импорт.
9.1.1. Транспорт через цитоплазматическую мембрану
Поскольку субстратное питание основано на импорте, остановимся на нем более подробно (рис. 64).
Рис. 64. Механизмы импорта на уровне цитоплазматической мембраны. Темным кружком обозначен транспортируемый субстрат. А — диффузионный транспорт; Б —Рm/(Smf)-зависимый симпортер; В — Рmf-зависимый симпортер, который использует связывающий белок; Г — АВС-пермеаза; Д — перенос группы. ВР — связывающий белок; ЕI и НРг — цитоплазматические ферменты (компоненты генеральной фосфотрансферазной системы); ЕII — мембраносвязанный фермент (специфический транспортер).
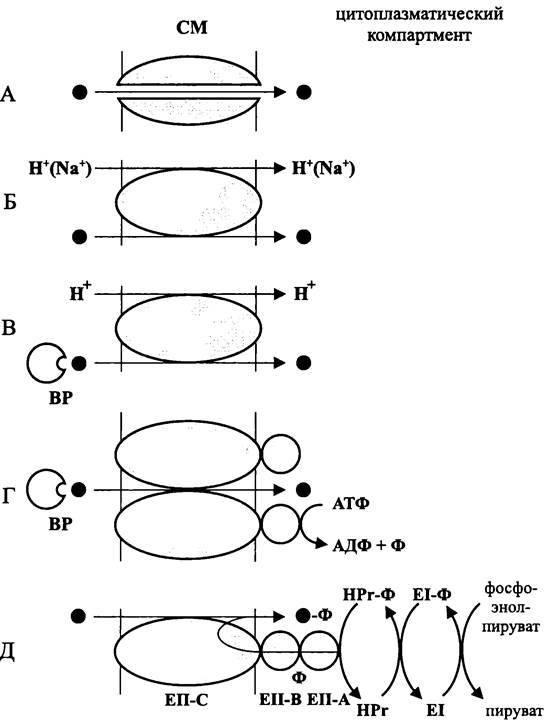
На уровне СМ действуют два механизма импорта — диффузия и активный транспорт.
Диффузия. Диффузионный транспорт приводит к выравниванию концентраций питательного субстрата по обе стороны СМ без затраты энергии, т. е. это downhill-транспорт. Иногда можно встретить утверждение, что диффундирующее вещество переходит из области большей концентрации в область меньшей концентрации под влиянием некой движущей силы. Это неверно, поскольку при диффузии происходит только статистическое перераспределение молекул, находящихся в хаотическом движении.
При пассивной диффузии в первую очередь важна степень липофильности субстрата, а уже затем — диаметр его молекулы. Липофильные молекулы (например, ароматические углеводороды) или амфифильные молекулы (например, этанол) неспецифически проходят через СМ, растворяясь в ее билипидном матриксе. Размер молекулы в данном случае несуществен. В отличие от липофильных молекул гидрофильные молекулы не обладают сродством к билипидному слою и поэтому могут преодолевать барьер СМ только через белковые каналы, или водные поры.
При облегченной диффузии (рис. 64, А) белковый канал в результате связывания с субстратом меняет конформацию, что облегчает перенос питательного субстрата через СМ. Однако клетка не расходует на это свою собственную энергию.
Активный транспорт. Для активного транспорта необходимы уже не диффузионные поры, а пермеазы (синонимы: переносчики, портеры, транслоказы, фасилитаторы). Как следует из окончания -аза, пермеазы обладают рядом свойств, сближающих эти белки с ферментами, хотя они обычно не катализируют химическую реакцию, т. е. не изменяют структуру своего субстрата.
Прежде всего, пермеазы в той или иной степени специфичны в отношении субстрата, и их биосинтез часто осуществляется индуцибельным путем. Кроме того, некоторые пермеазы способны осуществлять и прямой, и обратный процесс, т. е. импорт и экспорт субстратов. Наконец, у пермеаз наблюдаются такие «ферментные» свойства, как субстратное насыщение, конкурентное ингибирование и аллостерическая регуляция.
Пермеазы могут переносить субстраты по градиенту концентрации или против него, однако в обоих случаях на это тратятся собственные энергетические ресурсы, т. е. потенциальная энергия клетки преобразуется в кинетическую энергию субстрата.
При освобождении энергии изменяется конформация пермеазы, и субстрат проходит через раскрывающийся канал или по цепочке субстратсвязывающих сайтов. Пермеазы могут энергизироваться за счет двух разных источников энергии:
— трансмембранного электрохимического потенциала гидрофильных ионов (см. разделы 10.3 и 10.4);
— химического потенциала фосфагена, т. е. растворенного вещества, которое выполняет функцию посредника между процессами, идущими с поглощением энергии, и процессами, сопровождающимися выделением энергии (см. раздел 10.2).
Энергизация пермеаз при помощи трансмембранного электрохимического потенциала. Источником энергии для этого типа транспорта служит трансмембранный электрохимический потенциал гидрофильных субстратов, которые могут быть как неорганическими, так и органическими.
Если источником энергии служит собственный химический или электрохимический потенциал субстрата, то такой активный транспорт называется унипортом.
Источником энергии может быть также электрохимический потенциал неорганических катионов — Н+ или Ка+ (соответственно, протондвижущая сила Рmf или натрийдвижущая сила Smf; см. раздел 10.4). Поскольку пермеаза переносит субстрат совместно с катионами Н+ или Ка+, трансмембранный электрохимический потенциал этих катионов конвертируется в (электро)химический потенциал питательного субстрата. Перенос пары катион-субстрат в одном направлении называется симпортом, а в противоположных направлениях — антипортом.
Наконец, источником энергии для транспорта одного питательного субстрата может быть электрохимический потенциал другого питательного субстрата. В процессе активного транспорта электрохимические потенциалы этих субстратов взаимно конвертируются. Такая транспортная система представляет собой субстрат-субстратный антипорт.
Энергизация пермеаз при помощи фосфагена. В данном случае источником энергии для активного транспорта может быть гидролиз АТФ или другого фосфагена (см. ниже). При активном транспорте химический потенциал фосфагена конвертируется в химический или электрохимический потенциал транспортируемого субстрата.
Чаще всего при таком виде активного транспорта используется энергия гидролиза АТФ. Пермеазы, осуществляющие этот процесс, называются АВС-пермеазами (см. ниже).
В более редких случаях для транспорта используется энергия гидролиза более специфичного фосфагена — фосфоэнолпирувата. Данный процесс связан с последовательным фосфорилированием белковых субъединиц переносчика, или транслоказы и завершается фосфорилированием самого субстрата. Поэтому такая система называется переносом фосфорильной группы, или просто «переносом группы».
Рассмотрим перечисленные транспортные системы по отдельности. При этом мы будем учитывать, что некоторые типы пермеаз участвуют не только в трофическом транспорте, но и в других видах транспорта (см. выше). В частности, при помощи АВС-пермеаз бактерии секретируют экзоферменты, пептиды, капсульные полисахариды и Nod-факторы, а также экскретируют антибактериальные препараты, например, антибиотики или катионы тяжелых металлов.
Системы диффузионного транспорта (рис. 64, А). Самой распространенной транспортной системой, через которую осуществляется пассивная диффузия, является водный канал — аквапорин AqpZ. Он наиболее изучен на примере Е. coli.
Этот белок входит в большое и гетерогенное суперсемейство трансмембранных каналов, или главных интегральных белков (англ, major intrinsic protein, MIP), которые существуют у представителей всех трех глобальных доменов. Он имеет молекулярную массу 23 кДа и состоит из шести трансмембранных α-спиралей; две субъединицы объединяются в гомодимер. Аквапорин играет важную роль в осморегуляции. Индукция его транскрипции обеспечивает быстрое поступление или быстрый выход воды в ответ на резкое изменение осмомолярности окружающей среды. Именно поэтому аквапорины особенно важны для свободноживущих бактерий и архей; неслучайно они отсутствуют у внутриклеточных патогенов, например, Chlamydia trachomatis, Rickettsia prowazekii и Treponema pallidum.
Примером транспортной системы, служащей для облегченной диффузии, является глицериновый фасилитатор GlpF, который имеется у Е. coli. Он избирательно пропускает внутрь клетки глицерин, однако непроницаем для воды.
Унипортеры. Как уже указывалось, при унипорте активный транспорт осуществляется по градиенту электрохимического потенциала субстрата. Благодаря этому экспортируются накопленные в цитоплазме заряженные молекулы, которые не способны диффундировать через мембрану и поэтому нуждаются в пермеазе. Прокариотные унипортеры очень слабо изучены; возможно, что именно таким путем экспортируются нуклеотиды.
Однокомпонентные Pmf (Smf)-зависимые симпортеры и антипортеры (рис. 64, Б). Транслоказы данного типа представляют собой гидрофобные белки, которые используют хемиосмотическую энергию, т. е. электрохимический потенциал катионов Н+ или Na+.
Некоторые из них обладают обратимым действием (например, лактатпермеаза, в зависимости от того, какой градиент преобладает — градиент Н+ или градиент анионов лактата) и поэтому могут использоваться как для импорта субстрата, так и для его экспорта.
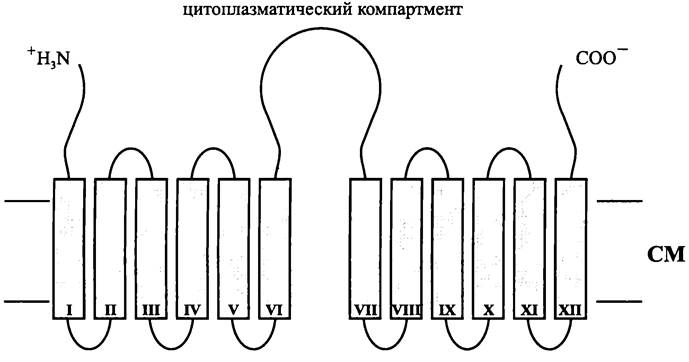
Рmf(Smf)-зависимые импортеры сахаров и аминокислот исключительно широко распространены и встречаются у представителей всех трех доменов глобального древа. Их молекулярная масса 40-70 кДа, и они состоят из двенадцати трансмембранных α-спиралей (рис. 65).
В частности, у Е. coli имеются Независимые импортеры арабинозы (АгаЕ), галактозы (GalP), ксилозы (ХуIЕ), лактозы (LacY), рамнозы (RhaT) и фукозы (FucP), а также Ха+-зависимый импортер мелибиозы (МеIВ).
Многие бактерии используют Pmf (Smf)-зависимые импортеры аланина и глицина (AGCS), алифатических аминокислот с разветвленной цепью — валина, изолейцина и лейцина (LIVCS), глутамата (GltS), а также ароматических гидроксиамино- кислот — тирозина, треонина и триптофана (НААР).
В отличие от Pmf (Smf)-зависимых симпортеров, которые осуществляют импорт, Pmf (Smf)-зависимые антипортеры вовлечены в экспорт. В качестве примера можно привести Независимый антипортер RhtB (от англ, resistance to homoserine and threonine), обеспечивающий у E. coli и других грамотрицательных бактерий экспорт гомосерина, который в форме γ-лактона выполняет роль автоиндуктора, или феромона.
Pmf (Smf)-зависимые симпортеры, использующие связывающий белок (рис. 64, В). Как уже указывалось, пермеазы растворимых субстратов образованы полипептидной цепью из двенадцати трансмембранных а-спиралей и не содержат вспомогательных субъединиц.
Единственное исключение — это семейство тройственных АТФ-независимых периплазматических транспортеров (англ. tripartite-ATP-independent periplasmic transporter, TRAP-T). Они обнаружены у некоторых бактерий, а также у некоторых архей. Характерным примером служит DctPQM — Н+-зависимый симпортер С4-дикарбоксилатов, в частности, сукцината и глутамата, который имеется у Rhodobacter capsulatus (класс «Alphaproteobacteria»). В отличие от обычных мономерных Рmf(Smf)-зависимых пермеаз он представляет собой гетеротример, состоящий из негомологичных субъединиц DctMQP (отсюда и происходит название «тройственный»). Субъединица DctM — это типичный 12-доменный интегральный переносчик, субъединица DctQ — это четырехдоменный интегральный белок, а субъединица DctP — это периплазматический субстратсвязывающий белок (англ, binding protein, BP). Иногда субъединицы М и Q слиты в один 16-доменный белок.
Функциональная роль TRAP-T окончательно еще не выяснена. У Е. coli эта пермеаза, скорее всего, импортирует пентозы.
Активный транспорт путем обмена анионов. В данном случае импорт экзогенного субстрата осуществляется за счет электрохимического градиента эндогенного субстрата.
Например, Е. coli содержит транспортеры DcuA и DcuB (от англ. Dicarboxylate uptake), которые попарно в любых комбинациях антипортируют аспартат, малат, фумарат и сукцинат.
В ряде случаев с помощью субстрат-субстратных импортеров достигается «неправильный» результат, а именно — создается трансмембранный электрохимический потенциал катионов Н+ (по Митчелу, за счет использования этого потенциала транспортируются субстраты, а здесь наоборот).
Механизм действия таких транслокаторов будет подробно рассмотрен в разделе 10.4.9. В данном случае мы ограничимся примером ОхIТ —оксалат/формиатного антипортера Oxalobacter formigenes (класс «Betaproteobacteria»). «Ведущим» субстратом здесь является формиат, а «ведомым» — оксалат.
После проникновения в клетку оксалат декарбоксилируется в формиат. Из-за того, что равновесие этой реакции сильно смещено в сторону образования формиата, внутриклеточная концентрация последнего на три порядка превышает внутриклеточную концентрацию оксалата, т. е. создается направленный наружу градиент формиата, за счет потенциальной энергии которого в клетку поступает оксалат.
Другими примерами антипортера анионов являются белок UhpT (от англ. uptake hexose phosphate transporter) и аналогичные ему транспортеры, которые преимущественно обменивают однозарядные органофосфатные анионы на однозарядный минеральный анион Н2РО4-.
Такие пермеазы можно рассматривать в качестве систем «третичного» транспорта, поскольку они обменивают экзогенный фосфорилированный субстрат на эндогенный ортофосфат. Последний предварительно аккумулируется с помощью вторичного Н+-зависимого симпортера Pit (от англ. inorganic phosphate transporter).
Транспортеры данного типа состоят из двенадцати трансмембранных α-спиралей, и в этом отношении они напоминают Рmf(Smf)-зависимые импортеры сахаров и аминокислот (см. рис. 65).
Рис. 65. Pmf(Smf)-зависимый импортер сахаров. Цифрами I-ХII обозначены интегральные спирали.
Индуцибельная система обмена анионов может импортировать разнообразные фосфорорганические соединения — фосфаты пентоз и гексоз, а также аминопроизводные и спиртовые производные сахаров. Обычно эти субстраты вначале дефосфорилируются экстрацитоплазматическими фосфатазами, затем импортируются Рmf(Smf)-зависимыми пермеазами, а уже после этого вновь фосфорилируются цитоплазматическими киназами. Система обмена анионов «коротко шунтирует» этот путь и доставляет такие соединения в цитоплазму в неизменном виде, что выгодно в энергетическом отношении.
Е. coli и ряд других энтеробактерий имеют две системы обмена анионов — транспортер глюкозо-6-фосфата UhpT и транспортер глицерол-3-фосфата GlpT (оба субстрата высвобождаются при обновлении клеток кишечного эпителия).
АВС-пермеазы (рис. 64, Г). Мембранные переносчики этого типа являются одной из наиболее распространенных транспортных систем. Они имеются у прокариотов и эукариотов и раздельно обеспечивают активный импорт или активный экспорт. Примеры АВС-пермеаз, которые совмещали бы обе эти функции, неизвестны.
О значении АВС-пермеаз для прокариотной клетки говорит такой факт — около 2% информационной емкости генома Е. coli отведено генам, кодирующим 80 вариантов данных переносчиков. В случае трофического транспорта АВС-пермеазы характеризуются высоким сродством к аминокислотам, витаминам, минеральным ионам, олигопептидам, сахарам и т. д. и создают высокие концентрационные градиенты этих субстратов (до пяти порядков).
АВС-пермеазы высококонсервативны и независимо от природы субстрата имеют стандартную структуру. Они состоят из нескольких мембранных белков и растворимого периплазматического белка-переносчика, который теряется при осмотическом шоке. Поэтому их второе название — «осмочувствительные периплазматические пермеазы».
При действии АВС-пермеаз субстрат реагирует с растворимым субстратсвязывающим белком-переносчиком, содержание которого в периплазме очень велико, и в таком виде презентируется мембранному компоненту АВС-пермеазы. Последний состоит из двух гидрофобных доменов (по шесть трансмембранных спиралей каждый) и двух периферических доменов, обладающих АТФазной активностью. В некоторых случаях АТФ-связывающие домены слиты в один белок, примером чего является транспортер рибозы Е. coli.
Из-за присутствия в периферическом домене консервативной последовательности, так называемой АТФ-связывающей кассеты (англ. ATP-binding cassette), эти транспортеры получили название АВС-пермеаз.
Субстратсвязывающие белки взаимно гетерологичны, и их молекулярная масса варьирует в пределах 25-60 кДа.
У грамположительных бактерий и архей, которые не имеют периплазматического пространства, субстратсвязывающий белок зафиксирован на наружной поверхности СМ.
Сигнал от комплекса субстрат-переносчик передается через трансмембранные субъединицы на АТФазные субъединицы, что увеличивает их сродство к АТФ. При взаимодействии с мембранными субъединицами субстрат диссоциирует от связывающего белка. В результате связывания и гидролиза АТФ открывается пора, через которую субстрат поступает в цитоплазму. Освобожденная энергия релаксирует комплекс, подготавливая его для очередного цикла.
Характерным примером трофических ABC-транспортеров является гистидин-пермеаза Salmonella typhimurium. Она состоит из периплазматического связывающего белка HisJ, интегральных субъединиц HisM и HisQ, а также двух АТФ-связывающих периферических субъединиц HisP. Другим примером является транспортер мальтозы MalEFGK2, в состав которого входит связывающий белок МаIЕ, трансмембранный канал из субъединиц MalF и MalG, а также две АТФазные субъединицы Ма1К.
Система переноса группы (рис. 64, Д). Единственным примером транспортера данного типа является фосфоэнолпируват-зависимая система транспорта углеводов (англ. phosphoenol pyruvate: sugar phosphotranspherase system, PTS). Судя по всему, она довольно поздно появилась в ходе эволюции бактерий и имеется в основном у мезофилов — в частности, она отсутствует у архаичных гипертермофилов Aquifex aeolicus и Thermotoga maritima. Гены фосфотрансферазной системы не найдены ни в одном из секвенированных геномов архей. Эукариоты этой системой также не обладают.
С помощью PTS-системы бактерии активно транспортируют моносахариды, дисахариды и многоатомные спирты — глюкозу, лактозу, маннитол, маннозу, сахарозу, сорбозу, фруктозу, целлобиозу и др.
PTS-система использует свободную энергию интермедиата гликолиза — фосфоэнолпирувата:
(фосфоэнолпируват)in+ (углевод)out —> (пируват)in + (углевод-Р) in,
где in и out — соответственно цитоплазматический и экстрацитоплазматический компартменты; Р — фосфатная группа.
Данный транспортный процесс исключительно выгоден, поскольку углевод концентрируется в уже фосфорилированном виде и может включаться в биосинтетические процессы без дополнительных энергетических затрат.
В состав PTS-системы Е. coli входят:
— генеральная фосфотрансферазная система, состоящая из цитоплазматических ферментов EI и НРг;
— специфичный транспортер, или фермент ЕII, состоящий из периферических доменов A/В и интегрального домена С (или интегральных доменов C/D).
Фермент EI представляет собой гомодимерный белок (субъединица 65-85 кДа; ген ptsl). С помощью фосфоэнолпирувата он автофосфорилируется по остатку His-189.
Фермент НРг (от англ. histidine protein) представляет собой мономерный термостабильный белок (9-10 кДа; ген ptsH). С помощью фермента EI он фосфорилируется по остатку His-15.
Фермент ЕII существует в нескольких вариантах. Это может быть трехдоменный белок АВС молекулярной массой 65 кДа с сайтами фосфорилирования Cys-384 и His-554 (транспортер маннитола), комплекс из однодоменного белка ЕII-А и двухдоменного белка ЕII-ВС (транспортер глюкозы), а также комплекс двухдоменного белка ЕII-АВ с двумя однодоменными белками ЕII-С и EII-D (транспортер маннозы).
Интегральный домен С содержит шесть трансмембранных спиралей, а в случае транспортера маннозы расщеплен на белки С и D, по три спирали каждый. Он содержит два сайта связывания субстрата (экстрацитоплазматический и цитоплазматический) и служит каналом для его транспортировки. Периферические домены содержат соответственно первый и второй гистидиновые сайты фосфорилирования.
Фосфорилирование играет двойственную роль в функционировании фермента ЕII. Во-первых, этим обеспечивается энергия для перемещения сахара через СМ. Во- вторых, фосфорилированый субстрат имеет очень низкое сродство к транслоказе и высвобождается в цитоплазму.
9.1.2. Транспорт через наружную мембрану
Диффузия. Поскольку в ОМ имеются водные поры, или порины она не может поддерживать на себе электрохимические градиенты катионов Н+ или Na+. Транспортные процессы на уровне этой мембраны ограничиваются пассивной диффузией или облегченной диффузией.
При пассивной диффузии субстрат попадает в периплазматический компартмент через порины «общего назначения» (англ. general porin; см. I том учебника). Через их отверстия проходят гидрофильные молекулы не крупнее 600 Да. Однако даже эти порины проявляют определенную избирательность в отношении транспортируемого субстрата. Например, Е. coli имеет два порина общего назначения — OmpF и ОmрС (от англ. outer membrane protein). Они преимущественно пропускают катионы.
При облегченной диффузии субстрат поступает в периплазматический компартмент через «специализированные» порины (англ. specific porin). В данном случае помимо радиуса отверстия порина важен знак заряда субстрата, и отдельно существуют порины для катионов и порины для анионов. Специализированные порины содержат сайты, связывающие специфические лиганды. Например, порин PhoE проявляет предпочтение в отношении анионов, в частности неорганического фосфата и фосфорорганических соединений. Установлено, что такая селективность обеспечивается протонированным радикалом аминокислотного остатка Lys, который выступает в просвет канала порина.
Активный транспорт. Примером активного транспорта на уровне ОМ является импорт железа.
Неорганические ионы доставляются в цитоплазматический компартмент специфическими переносчиками. Как правило, клетка имеет сразу несколько таких систем. Они различаются по характеру экспрессии и сродству, или аффинитету к субстрату. Конститутивные системы обладают малым аффинитетом и действуют лишь при значительной концентрации ионов во внешней среде. Индуцибельные системы обладают высоким аффинитетом и экспрессируются только когда ион находится в дефиците (особенно если голодание по нему вызывает метаболический стресс).
В бактериальной клетке содержатся 105— 106 катионов железа, хотя в некоторых случаях они накапливаются до 2% сухого веса. При нейтральном pH растворимость Fe3+ в окружающей среде составляет не свыше 10-18 М (6 • 106 ионов • л-1), т. е. его количество в свободной форме слишком мало, чтобы обеспечить развитие популяций, плотность которых может достигать 108 — 1012 клеток • л-1. Чтобы преодолеть гигантский разрыв между внутриклеточным и внеклеточным пулами железа, бактериям приходится жестко конкурировать друг с другом.
Для этого они могут использовать целых три стратегии:
— снижение pH окружающей среды, в результате чего повышается растворимость катиона Fe3+;
— восстановление слаборастворимого катиона Fe3+ в хорошо растворимый катион Fe2+;
— секреция хелаторов Fe3+, или сидерофоров.
Чаще всего бактерии пускают в ход последнюю стратегию.
Сидерофоры (греч. sideros — железо и phora — ноша) представляют собой железоспецифичные лиганды молекулярной массой 500-1000 Да, которые образуют с железом комплексы, окрашенные в красный цвет. Биосинтез сидерофоров регулируется минеральным железом; они выделяются клеткой в условиях лимитирования железом; в хелатном комплексе с ними Fe3+ специфически рецептируется и доставляется в цитоплазму.
Сидерофоры обладают исключительно высоким аффинитетом по отношению к катионам Fe3+ — константа образования хелатного комплекса составляет 1023 — 1049. Концентрация выделенных клеткой сидерофоров может быть очень значительной (до 0,2 г • л-1).
В настоящее время выявлены свыше 500 сидерофоров, в основном бактериального происхождения. Известны сидерофоры грибов и однодольных растений. У архей сидерофоры пока еще не обнаружены.
Сидерофоры имеются у всех аэробных и факультативно анаэробных бактерий, однако у строгих анаэробов и аэротолерантных молочнокислых бактерий они отсутствуют.
Молекулярными предшественниками при биосинтезе бактериальных сидерофоров являются обычные аминокислоты (которые связываются в полипептидную цепь с помощью нерибосомных пептидсинтетаз), а также дигидроксибензоат, N-ацил-М- гидроксиорнитин и цитрат.
По химическому строению сидерофоры относятся к гидроксаматам, катехолам или α-гидроксикарбоксилатам (рис. 66). Гены биосинтеза и экспорта сидерофоров организованы в хромосомные опероны и используют промоторы, которые находятся под контролем глобального регулятора железного гомеостаза Fur (от англ. ferric uptake regulator). В частности, для получения сидерофора энтеробактина требуются продукты хромосомных генов entАВС (синтезируют из хоризмата предшественник энтеробактина 2,3-дигидроксибензоат) и генов entDEFG (образуют этот сидерофор из трех молекул 2,3-дигидроксибензоата и одной молекулы L-серина). В других случаях — примером может служить гидроксаматный аэробактин Е. coli — оперон сидерофора содержится в плазмиде Col V.
Рис. 66. Главные типы сидерофоров (с примерами).
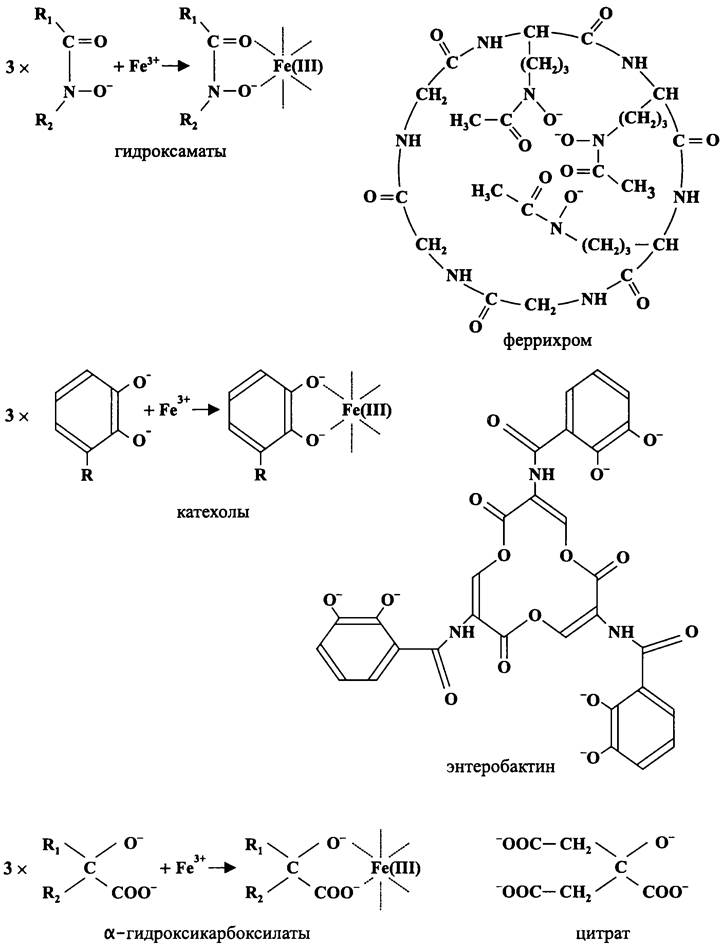
Наиболее известными представителями вышеуказанных групп сидерофоров служат соответственно феррихром, энтеробактин и цитрат; во всех случаях железо находится в центре шести лучевой звезды, образованной тремя парами лигандов.
Бактерии, обладающие грамотрицательным строением, и бактерии с грамположительным строением используют разные способы доставки хелатного комплекса железа с сидерофором в цитоплазму.
Поскольку диаметр пор в ОМ грамотрицательных бактерий составляет 600 Да, имеющий более крупный размер хелатный комплекс вначале взаимодействует с мембранным рецептором. Затем с помощью эндергонического процесса, в котором участвует система субъединиц TonB-ExbB-ExbD, комплекс проникает в периплазматический компартмент, где связывается белком-переносчиком. Тот, в свою очередь, передает хелатный комплекс ABC-транспортеру, расположенному в СМ. Последний, переносит железо в цитоплазму (рис. 67).
Рис. 67. Импорт железа у грамотрицательных (А) и грамположительных (Б) бактерий. ABC — цитоплазматическая субъединица АВС-пермеазы; РВР — периплазматический связывающий белок; МВР — мембранный связывающий белок; ТоnВ, ЕхbВ и ExbD — субъединицы межмембранного молекулярного проводника энергии.
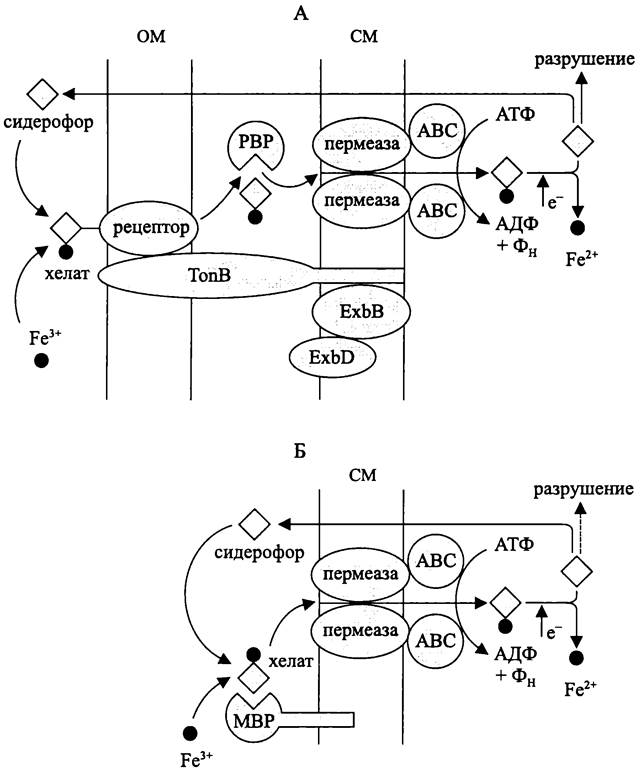
Грамположительные бактерии лишены ОМ, и при отсутствии системы TonB- ExbB-ExbD хелатный комплекс доставляется к ABC-транспортеру с помощью содержащегося в СМ липопротеинового рецептора.
Ton-зависимые рецепторы IROMP (от англ. iron-regulated outer membrane protein) содержатся в ОМ и представляют собой специфические пермеазы, которые индуцируются при железном голодании и обладают высоким аффинитетом по отношению к хелатному комплексу железа с сидерофором. Они имеют сходную структуру с поринами (см. I том учебника). Интегральный С-концевой домен размером 35 х 47 х 70 А образован двадцатью двумя антипараллельными β-цепями, которые соединены одиннадцатью длинными экзоплазматическими петлями и десятью короткими периплазматическими шпильками. N-концевой домен размером около 160 аминокислотных остатков образует гибкую петлю, состоящую из четырех β-цепей, чередующихся с короткими α-спиралями. Она играет роль «пробки» и запирает внутренний канал рецептора диаметром ~4 нм. В отличие от поринов общего назначения, пассивно фильтрующих гидрофильные молекулы, Ton-зависимые рецепторы действуют так же, как раскрывающиеся порины, которые энергизируются с помощью СМ.
Поскольку ОМ свободно проницаема для протонов, она не может самостоятельно сопрягать экзергонические и эндергонические процессы. Для того, чтобы перенести через нее хелатный комплекс, необходимо затратить часть энергии протонного градиента; при этом роль молекулярного проводника энергии выполняет система TonB-ExbB-ExbD.
Белок ТопВ состоит из 239 аминокислотных остатков. N-концевой домен заяко- ривает его в СМ. Содержащий пролиновые повторы средний гидрофильный домен расположен в периплазматическом компартменте. С-концевой домен взаимодействует с так называемым «ТопВ-боксом», или консервативным гидрофобным доменом из семи аминокислотных остатков, который расположен на N-конце Тоn-зависимого рецептора ОМ. N-концевой домен белка ЕхbВ обращен в сторону периплазматического компартмента, а белок ExbD заякорен своим N-концевым доменом в СМ. Стехиометрическое соотношение субъединиц TonB-ExbB-ExbD составляет 1:7:2.
Хотя механизм действия системы TonB-ExbB-ExbD точно не установлен, есть предположение, что белок ТоnВ тесно взаимодействует с комплексом ExbB/ExbD. При связывании хелатного комплекса с рецептором ОМ последний изменяет свою конформацию, и через ТоnВ-боксы сигнал передается белку ТоnВ, а уже от него — комплексу ExbB/ExbD. Затем в ход вступает петля обратной связи, и хемиосмотический потенциал преобразуется в конформационное изменение белка ТоnВ. При этом С-концевой домен белка ТоnВ открывает пробку рецептора, в результате чего хелатный комплекс проникает в периплазматический компартмент.
Большинство бактерий обладает параллельными системами, каждая из которых импортирует отдельный хелатный комплекс железа с сидерофором, распознаваемый своим рецептором. Например, Е. coli штамм К-12 содержит не менее шести рецепторов для импорта восьми хелатных комплексов. Помимо использования собственных сидерофоров, энтеробактина и цитрата, эта бактерия способна «похищать» сидерофоры своих партнеров по экосистеме — феррихром, копроген, родоторуловую кислоту и ферриоксамин.
Чаще всего для импорта железа Е. coli использует три сидерофора — феррихром, энтеробактин и цитрат. У каждого из них имеется свой собственный рецептор (соответственно, FhuA, FepA и FecA). Они передают хелатные комплексы специализированным периплазматическим переносчикам, соответственно FhuD, FepB и FecB. Доставка феррихрома, Fе3+-энтеробактина и Fе3+-цитрата через СМ осуществляется при помощи специализированных АВС-транспортеров, соответственно FhuBC, FepDGC и FepCDE.
Периплазматический белок-переносчик единовременно переносит только одну молекулу хелатного комплекса и действует в качестве челнока, с помощью которого высвободившийся в периплазматический компартмент хелатный комплекс передается АВС-транспортеру.
В состав АВС-транспортера входят два интегральных пермеазных модуля (2 х FhuB, FepDG или FepDE) и два периферических АВС-модуля (2 х FepC). В отличие от Ton-зависимых рецепторов в составе ОМ, АВС-пермеаза менее специфична — на шесть вариантов рецептора в случае Е. coli приходятся только три варианта транспортера. Доставленный в цитоплазму хелатный комплекс диссоциирует в результате восстановительной реакции Fе3+ + е- —> Fе2+. Это происходит потому, что сидерофор характеризуется относительно низким сродством к закисному железу. Существуют несколько флавин- или ферредоксинзависимых бактериальных ферментов, обладающих Fе3+-редуктазной активностью.
Особый интерес представляет импорт железа у патогенных бактерий.
Все живые организмы поддерживают содержание свободного железа в цитоплазме и внеклеточных структурах на крайне низком уровне, чтобы максимально ограничить участие этого металла в образовании свободных радикалов, повреждающих биомолекулы. В то же время железо является одним из важнейших микроэлементов и служит компонентом простетических групп многих ферментов, поэтому оно требуется клеткам в довольно большом количестве. Например, в организме взрослого человека до 3-5 г железа — главным образом в связанной форме. Основная часть внутриклеточного железа входит в состав железосвязывающих белков (ферритина, гемосидерина, гема и гемоглобина). Железо, присутствующее в сыворотке крови млекопитающих, преимущественно связывается гликопротеинами —лактоферрином и трансферрином. Незначительное количество выделяющегося в сыворотку гемоглобина незамедлительно вступает в комплекс с гаптоглобином и гемопексином.
Таким образом, несмотря на довольно большой запас железа в организме хозяина, оно существует в недоступной бактериям форме (в сыворотке крови здорового человека среднего возраста концентрация свободного железа составляет всего 10-18М). В острой фазе инфекционного процесса концентрация железа в сыворотке значительно снижается. От действия иммунной системы часть бактерий погибает, и в кровь высвобождается эндотоксин. Под его влиянием клетки иммунной системы синтезируют цитокины, в частности интерлейкин-1 и α-фактор некроза опухолей. В результате этого в сыворотке повышается концентрация трансферрина, что приводит к связыванию дополнительного количества железа. Сходный процесс протекает в очаге воспаления, где при дегрануляции лейкоцитов выделяется аполактоферрин. Лактоферрин-зависимое лимитирование бактериальных клеток железом происходит и в фагосомах лейкоцитов.
Следовательно, патогенные бактерии развиваются в организме хозяина в условиях острого лимитирования железом. Для того, чтобы инфекционный процесс оказался успешным, они должны эффективно извлекать железо из внеклеточной среды. Паразит и хозяин начинают остро конкурировать за данный микроэлемент, что позволяет рассматривать бактериальные системы связывания и импорта железа как самостоятельный фактор вирулентности.
Можно обозначить три стратегии железного питания патогенных бактерий в организме хозяина.
Первая стратегия — это биосинтез и выделение в среду сидерофоров. Патогены преодолевают лимитирование железом, используя сидерофоры, которые конкурируют с железосвязывающими белками хозяина. Это очень распространенная стратегия питания железом, как пример можно привести сидерофоры микобактерий — микобактины и экзохелины. В состав микобактинов входит остаток салицилата. В зависимости от длины алкильного заместителя микобактины относят к двум типам с разной полярностью и, следовательно, разной растворимостью в воде. Менее полярные микобактины, или собственно микобактины ассоциированы с клеточной стенкой, в то время как более полярные карбоксимикобактины секретируются во внеклеточную среду. Экзохелины представляют собой олигопептиды и встречаются только у непатогенных микобактерий. Эти соединения синтезируются нерибосомным путем с помощью пептидсинтетаз. Некоторые патогенные бактерии не образуют специфических сидерофоров, и переносчиком железа у них служит цитрат.
Вторая стратегия — это извлечение железа непосредственно из хозяйских железосвязывающих белков без использования сидерофоров. Например, представители рода Neisseria(возбудители го- норреи и менингита) способны заимствовать железо из комплекса с лактоферрином и трансферрином. Для этой цели в ОМ существуют индуцибельные рецепторы для связывания лактоферрина и трансферрина — LfR и TfR. Железосвязывающие белки не проникают в бактериальную клетку, и оно высвобождается на ее поверхности. Затем его транспорт осуществляется с помощью системы TonB-ExbB-ExbD, периплазматических связывающих белков и АВС-пермеаз.
Примером бактерии, для которой доступны разные ресурсы железа, служит Haemophilus influenzae (возбудитель хронических респираторных инфекций), которая извлекает его из гемоглобина, а также из комплексов гемоглобин-гаптоглобин, гем-гемопексин и гем-альбумин.
Третья стратегия — это образование гемолизинов. Способность синтезировать и секретировать в среду протеазы и гемолизины наделяет бактерии гемолитическими свойствами. Типичным представителем гемолизинов является α-гемолизин Е. coli. Этот пептид образует поры в СМ эукариотных клеток, что приводит к их лизису. С помощью гемолизинов бактерии-гемолитики получают доступ к запасам гема и гемоглобина в эритроцитах. Данная стратегия очень эффективна, и ее используют многие патогенные бактерии, поскольку основной пул железа в организме млекопитающих ассоциирован именно с гемом. Бактерия непосредственно поглощает освободившийся гем, а также может утилизировать его в комлексе с хозяйскими белками, например, гемопексином. После связывания гема или гем-белкового комплекса с Топ-зависимыми рецепторами ОМ свободный гем доставляется в периплазматический компартмент, а затем без помощи периплазматических связывающих белков транслоцируется АВС-пермеазой через СМ. В цитоплазматическом компартменте гем разрушается гемоксигеназой, что приводит к высвобождению железа.
9.2. Метаболизм
Термин «метаболизм» относится в биологии к разряду базовых. По частоте встречаемости он мог бы поспорить с такими терминами, как «клетка», «фермент» и «вид».
Обычно указывают, что этот термин впервые ввел в 1878 г. кембриджский профессор Майкл Фостер (М. Foster) в своей книге «А Text-Book of Physiology». Однако на самом деле Фостер образовал существительное «метаболизм» (англ, metabolism) от прилагательного «метаболический» (англ, metabolic). В свою очередь, немецкий прототип (metabolisch) этого прилагательного использовал еще в 1839 г. Теодор Шванн (Т. Schwann) в своей книге «Mirkoskopische Untersuchungen über die Ueberein- stimmung in der Struktur und dem Wachstum derTiere und Pflanzen». Таким образом, авторство термина «метаболизм» на самом деле принадлежит Шванну.
Греческое слово «метаболизм» (metabole) буквально означает «изменение». В естествознании для обозначения изменения существует еще один термин — «метаморфоз» (греч. metamorphosis —превращение). В 1842 г. Юстус фон Либих (J. von Liebig) употребил его в немецком варианте (Metamorphose) в своей книге «Die organische Chemie in ihrerAnwendung auf Physiologie und Pathologie» именно для обозначения метаболизма. Однако в настоящее время термин «метаморфоз» используется не в метаболическом, а в онтогенетическом контексте.
В связи с семантикой термина «метаболизм» упомянем и такой общеизвестный термин, как «обмен веществ» (нем. Stoffwechsel). Его предложил еще в 1815 г. немецкий химик Георг Зигварт (G. С. L. Sigwart). Как и многие другие биологические термины, пришедшие в русский научный лексикон из классического немецкого естествознания, термин «обмен веществ» используется до настоящего времени в качестве синонима термина «метаболизм».
Однако метаболизм связан не только с превращениями вещества, но и с превращениями энергии.
Метаболизм — это совокупность клеточных процессов превращения энергии и субстратов.
Кроме того, метаболизм не является обменом, т. е. пространственным перераспределением вещества. Если нато пошло, «обменом веществ» следовало бы назвать транспорт, который обычно не связан с превращением перераспределяемого субстрата.
Транспорт, включающий в себя поступление вещества из окружающей среды в клетку (импорт) и перемещение вещества во внеклеточное пространство (экспорт), не входит составной частью в метаболизм, а только является его предпосылкой и последствием.
Энергетический метаболизм. Энергетический метаболизм связан с двумя способами ассимиляции энергии — в форме трансмембранного электрохимического
потенциала при помощи мембранных электрогенераторов и в форме макроэргических соединений при помощи цитозольных редокс-ферментов и киназ (см. главу 10).
К сфере энергетического метаболизма еще относится расходование ассимилированной энергии в конструктивном метаболизме, мембранном транспорте и двигательных актах, а также в регуляторных процессах.
Конструктивный метаболизм. В отличие от энергетического метаболизма конструктивный метаболизм представляет собой совокупность реакций биосинтеза и биодеградации внутриклеточных, импортируемых и экспортируемых органических молекул.
Когда биосинтез и биодеградация затрагивают незаменимые компоненты клетки — мембранные компартменты, генетические структуры, аппарат трансляции, транспортные и регуляторные системы — речь идет об обновлении (англ. turnover).
Генеральный метаболизм и специализированный метаболизм. Биосинтетическую составляющую конструктивного метаболизма можно подразделить на первичный метаболизм (англ. primary metabolism) и вторичный метаболизм (англ. secondary metabolism). В последнее время для обозначения этих процессов начинают использовать более точные термины — «генеральный метаболизм» (англ. general metabolism) и «специализированный метаболизм» (англ, specialized metabolism).
Генеральный метаболизм — это биосинтез мономеров из стандартных предшественников и биосинтез полимеров из этих мономеров; он необходим для роста и размножения клеток.
Гены ферментов генерального метаболизма конститутивно экспрессируются в трофофазе (англ. trophophase; от греч. trophe — питаюсь и phasis — положение), т. е. по ходу роста и размножения клеток.
К числу генеральных метаболитов, или трофолитов (англ. tropholyte) относятся нуклеотиды, аминокислоты, моносахариды (пентозы и гексозы), а также важнейшие интермедиаты метаболических путей — например, пируват и ацетил-СоА.
Специализированный метаболизм — это биосинтез из стандартных предшественников низкомолекулярных нестандартных соединений (до 1,5 кДа), которые в основном играют роль экзогенных регуляторов; он не является необходимым условием роста и размножения клеток.
Гены ферментов специализированного метаболизма экспрессируются в идиофазе (англ. idiophase; от греч. idios — особенный и phasis — положение), т. е. при остановке роста и размножения клеток.
К числу специализированных метаболитов относятся, в частности, антибиотики и феромоны.
Специализированные метаболиты, или идиолиты (англ. idiolyte) характеризуются следующими особенностями:
— они не нужны для роста;
— их распространение не универсально и иногда даже видоспецифично;
— для них характерно большое разнообразие структуры (часто она уникальна), и они проявляют биологическую активность в качестве сигнальных молекул, факторов роста, ингибиторов, антибиотиков и т. д.;
— они синтезируются из первичных метаболитов и интермедиатов стандартных метаболических путей (например, ацетил-СоА) в цепи нестандартных реакций, которые катализируются ферментами специализированного метаболизма (англ. specialized metabolism enzymes, SEM);
— их биосинтез кодируется особыми оперонами, которые находятся под контролем регуляторных систем, определяющих момент и уровень экспрессии соответствующих генов.
9.2.1. Типы метаболизма
По инициативе французского генетика Андре Львова на биохимическом симпозиуме, проходившем в 1946 г. в Колд Спринг-Харборе (США), был принят алгоритм для классифицикации разных типов питания, и на его основе разработана унифицированная физиолого-биохимическая терминология. Благодаря своей логичности и удобству для произношения, она сразу же вошла в биологическую терминологию и без изменений сохранилась до настоящего времени.
В данной классификации используется набор терминов, составленных из смысловых приставок фото-, хемо-, авто-, гетеро-, лито- и органо- (по отдельности или по две-три) с прибавлением стандартного окончания -трофия. Таким способом можно охарактеризовать любой тип метаболизма, указывая на альтернативный:
— энергоноситель, который может быть электромагнитным (фототрофия) или химическим (хемотрофия);
— строительный материал, который может быть органическим (гетеротрофия) или неорганическим (автотрофия);
— донор электронов, который может быть органическим (органотрофия) или неорганическим (литотрофия).
Живой организм, обладающий конкретным типом метаболизма, обозначается составным термином с прибавлением окончания -троф (например, литотроф, хемо- гетеротроф, фотолитоавтотроф).
9.2.2. Энергоноситель
Чтобы сохранить свою структурную целостность и поддерживать свои физиологические процессы, прокариотная клетка постоянно испытывает потребность в энергии. Хотя эндогенным источником энергии на ограниченное время могут стать запасные вещества, они всегда вторичны по отношению к экзогенным энергоносителям.
Зависимость прокариотов от разных форм энергии — электромагнитной, химической, осмотической, тепловой и гравитационной — носит неоднозначный характер.
В некоторых случаях, находясь в энергетическом поле, прокариотная клетка может испытывать на себе его воздействие только косвенно. Например, поскольку удельный вес бактерий обычно близок к единице, они не оседают под воздействием гравитации. Если бактерия не обладает локомоторной системой, ее положение в пространстве определяется суммарным импульсным вектором от соударений клетки с молекулами раствора, находящимися в броуновом движении. В то же время гравитация может изменять положение планктонных форм, действуя через конвекционные токи. Такая энергетическая зависимость случайна и, как правило, не несет приспособительного значения.
Гораздо чаще зависимость от внешнего источника энергии является прямой. Конкретным примером служит пассивное перемещение бактерий в электрическом поле, или электрофорез. В конечном счете, это может закончиться иммобилизацией клеток на заряженной поверхности. Такая энергетическая зависимость в разных ситуа-
циях улучшает или ухудшает условия питания. Примером прямой и физиологически целесообразной энергетической зависимости служит редко встречающаяся у бактерий принудительная ориентация вдоль силовых линий магнитного поля (см. I том учебника).
Легко заметить, что во всех отмеченных случаях внешняя энергия преобразуется в механическую. Однако прямое использование энергии не обязательно сопровождается ее трансформацией. Типичным примером служит перенос тепловой энергии из окружающей среды внутрь клетки, что повышает кинетическую энергию молекул и, как следствие этого, скорость ферментативных реакций.
Наконец, живые организмы могут активно трансформировать экзогенную энергию.
Трансформированная энергия (точнее, свободная энергия; см. раздел 10.1) не обязательно ассимилируется, т. е. интегрируется в клетку, чтобы ее затем можно было использовать для полезной работы. Характерным примером служит альтернативный путь использования энергии видимого света. При фототрофии после захвата антенными системами она ассимилируется благодаря трансмембранному переносу протонов электрон-транспортной цепью (см. раздел 12.1). Наряду с этим свет вызывает конформационные изменения специализированных фоторецепторов, что порождает каскад сигналов, регулирующих поведенческие акты, в частности фототаксис.
Ассимиляцией энергии называется активное преобразование свободной энергии внешних поливариантных энергоносителей в свободную энергию внутреннего унифицированного энергоносителя.
Ассимилированная энергия расходуется при биосинтезах, а также при совершении осмотической, механической и иной полезной работы.
Живые клетки способны ассимилировать только две формы энергии — световую энергию, или энергию квантов электромагнитного поля, и химическую энергию, или энергию электронов в атомах или молекулах химических субстратов (органических и неорганических).
Ассимиляция энергии квантов электромагнитного поля, поглощенных специализированными пигментными структурами, называется фототрофией (греч. phos — свет и trophe — питаюсь). Когда ассимилируется энергия, освобождающаяся при энзиматическом окислении субстратов, такой способ энергетического питания называется хемотрофией (греч. chemeja — химия и trophe — питаюсь).
Энергетический метаболизм, основанный на окислении неорганических субстратов, носит название хемолитотрофии (греч. chemeja — химия, lithos — камень и trophe — питаюсь). Если же источником энергии служит реакция окисления органического субстрата, такой энергетический метаболизм называется хемоорганотрофией (греч. chemeja — химия, organikos— органический и trophe — питаюсь).
Естественно, что речь идет только о свободной энергии, т. е. о части полной энергии физико-химической системы, например, об энергии реагирующих веществ, которая преобразуется в ассимилированную энергию или полезную работу.
9.2.3. Строительный материал
Структурной основой всех живых существ являются органические соединения.
Термин «органический» ввел в 1860-х годах немецкий химик Фридрих Кекуле для обозначения любых соединений углерода.
В настоящее время органическими называют только такие соединения углерода, которые обладают углеродным скелетом, т. е. в них между атомами углерода существует одинарная или кратная ковалентная связь. Углеродные скелеты могут быть линейными, циклическими или смешанной структуры. Минимальный углеродный скелет состоит из двух атомов углерода (примером служит ацетилен С2Н2). Формально органическим соединением углерода является и карбид кальция СаС2.В случае линейных цепей длина углеродного скелета достигает >106 атомов (природный каучук).
В свою очередь, к неорганическим соединениям углерода относятся такие, которые либо содержат только один атом углерода, либо содержат несколько атомов углерода, но не имеют углеродного скелета. В этом случае атомы углерода соединены не напрямую, а через атомы кислорода, азота или серы. Примерами неорганических соединений углерода являются оксид углерода СО, диоксид углерода СО2, бикарбонат НСО3- и карбонат СО3-, а также метан СН4, его галогенозамещенные (например, хлороформ CHCI3) и кислородные производные (например, метанол СН3ОН, формальдегид НСНО и формиат НСОО-). Примерами многоуглеродных неорганических соединений являются диметиловый эфир СН3-О-СН3, тетраметиламмоний (СНз)4N+ и диметилсульфоксид CH3-SO-CH3.
В состав прокариотных клеток входят только органические соединения, т. е. молекулы с углеродным скелетом (если не принимать во внимание редкие примеры прижизненной биоминерализации, когда в клетках образуются кристаллы кальцита; см. I том учебника).
Для синтеза собственных органических соединений живые существа могут использовать готовые органические соединения углерода, неорганические соединения углерода, а также их смесь.
В конце 1890-х годов немецкий ботаник Вильгельм Пфефер (W. Pfeffer) назвал биосинтез органических веществ из диоксида углерода или бикарбоната автотрофией (греч. autos —сам и trophe — питаюсь). Субстратное питание, при котором в конструктивных целях используются экзогенные органические молекулы, в свою очередь, было названо гетеротрофией (греч. eteros — другой и trophe — питаюсь).
В настоящее время оба эти термина требуют уточнения. В частности, необходимо говорить отдельно об углеродной и азотной автотрофии.
Углеродной автотрофией называется совокупность биосинтетических реакций, приводящих к образованию углеродных скелетов из молекул или химических групп, не содержащих углерод-углеродных связей.
Субстратами углеродной автотрофии служат диоксид углерода СО2, а также его «физиологические эквиваленты» формиат НСОО- и бикарбонат НСО3. За ними, по возрастающей степени восстановленности, идут оксид углерода СО, формальдегид НСНО, метанол СН3ОН и метан СН4. Кроме того, субстратом углеродной автотрофии может быть «неорганическая» метильная группа, присоединенная через атом кислорода, азота или серы к другим метальным группам (от одной до трех) или к многоуглеродному скелету.
В качестве синонима термина «углеродная автотрофия» можно использовать термин «монокарботрофия» (греч. monos — один, лат. carboneum — уголь, элемент углерод, и греч. trophe — питаюсь; питание одноуглеродным веществом). Есть и сокращенное обозначение этого термина — «C1-трофия».
Помимо углеродной автотрофии существует азотная автотрофия.
Азотная автотрофия представляет собой совокупность биосинтетических реакций, превращающих молекулярный азот (N2) в аминогруппы органических молекул (-NH2).
В качестве синонима термина «азотная автотрофия» английские биохимики Бернс (R. Burns) и Харди (R. Hardy) предложили в 1970-е годы термин «диазотрофия» (греч. dio — два, azoos — безжизненный, элемент азот, и trophe — питаюсь; питание N2). Существует и сокращенное обозначение этого термина — «N2-трофия».
Термин «диазотрофия» лучше классического термина «биологическая фиксация атмосферного азота», который отражает только начальный этап диазотрофии, связанный с восстановлением азота в аммиак. Что касается сокращенного варианта «фиксация азота», то ему не хватает определенности — азот можно зафиксировать с помощью химической реакции или на инертном адсорбенте.
Конструктивные процессы монокарботрофов основаны на использовании ферментов, которые акцептируют одноуглеродные блоки и восстанавливают их до формильной -СНО, оксиметильной -СН2ОН или метильной -СН3 групп. Соответствующие метаболические системы носят название «циклов» и «путей» автотрофной ассимиляции углерода. Известен ряд таких систем; они приурочены к разным филогенетическим ветвям прокариотов и будут подробно рассмотрены в главе 13.
Конструктивные процессы диазотрофов складываются из универсальных метаболических путей, однако в основе диазотрофии лежит уникальная ферментативная активность нитрогеназ. С помощью сильного восстановителя и при затрате энергии АТФ эти ферменты разрывают тройную связь в молекуле N2 (в конечном счете образуются две молекулы аммиака NH3). Нитрогеназы часто, но не закономерно встречаются у представителей домена Bacteria и в редких случаях имеются у метаногенных Archaea. У представителей домена Еucаrуа нитрогеназы не обнаружены и, скорее всего, они у них вообще отсутствуют.
Смешанный тип конструктивного углеродного метаболизма называется углеродной миксотрофией (греч. mixis — смешение и trophe — питаюсь). В этом случае автотрофная ассимиляция одноуглеродных соединений происходит одновременно с ассимиляцией органических веществ (аминокислот, нуклеотидов, жирных кислот, стероидов, моносахаридов и т. д.), используемых при биогенезе надмолекулярных структур и биосинтезе запасных полимеров.
При органическом питании полимеры расщепляются на моноблоки, а сложные молекулы — на более простые, что в отдельных случаях завершается полной минерализацией углерода. Совокупность этих процессов называется катаболизмом (греч. kata — направление движения сверху вниз и metabole — изменение). Когда из неорганического углерода синтезируются простые органические вещества, или, когда из моноблоков образуются полимеры, мы говорим об анаболизме (греч. ana — направление движения снизувверх и metabole — изменение). Анаболизм и катаболизм — это взаимосвязанные стороны единой метаболической системы, которые не могут осуществляться в отрыве друг от друга.
Последовательные этапы катаболических и анаболических превращений образуют системы реакций, или метаболические пути (англ. metabolic pathway). Некоторые метаболические пути обратимы. В этом случае из поставщиков энергии, конструктивного субстрата и восстановителя они становятся их потребителями.
9.2.4. Донор электронов
Прежде всего следует уточнить, в какой сфере метаболизма будет использоваться донор — энергетической или конструктивной.
Если экзогенный восстановитель служит источником энергии, последняя ассимилируется в форме вещества-фосфагена или в форме трансмембранного электрохимического потенциала (см. главу 10). При этом электроны от восстановителя передаются терминальному акцептору, для обозначения которого существует образный термин — «сточная труба» для электронов (англ. electron sink).
Если экзогенный восстановитель используется для биосинтезов, электроны передаются эндогенному редокс-агенту (в частности, пиридиннуклеотиду НАДФ). Тот, в свою очередь, служит восстановителем при биогенезе клеточных структур или при биосинтезе внеклеточных полимеров (в частности, экзополисахаридов). Сформулированное положение можно иллюстрировать следующим примером.
Реакция автотрофного карбоксилирования органического акцептора (R-H)
R-H + СO2 —> R-COOH
связана с относительно небольшим изменением свободной энергии. Образующаяся карбоксильная группа (-СООН) менее восстановлена по сравнению с оксиметеновой (-СНОН-), метановой (-СН=), метеновой (-СН2-) и метальной (СН3-) группами, из которых состоят углеродные скелеты. Поэтому за исключением тех случаев, когда ассимилируемой одноуглеродной единицей служит формальдегид (НСНО) или метильная группа, для автотрофной ассимиляции углерода необходимы восстановительные эквиваленты. Их источником является экзогенный донор электронов. Как уже указывалось, при его окислении восстанавливаются простетические группы редокс-ферментов — пиридиннуклеотиды (НАД и НАДФ), флавиннуклеотиды (ФАД и ФМН) и железосерные центры.
Использование для питания неорганического донора электронов называется литотрофией, а органического — органотрофией.
Если пул восстановителя пополняется за счет неорганического донора электронов одновременно с использованием энергии света, такой тип метаболизма называется фотолитотрофией. Когда для фототрофа источником восстановителя в конструктивных процессах служит экзогенный органический субстрат, это называется фотоорганотрофией. Если органический субстрат служит для фототрофа источником восстановителя и одновременно с этим используется как конструктивный материал, мы имеем дело с фотогетеротрофией.
При хемолитотрофии неорганический субстрат может быть не только источником энергии, но и донором электронов в конструктивном метаболизме. В этом случае речь идет о хемолитоавтотрофии. Если же хемолитотроф использует органическое вещество как донор электронов для биосинтезов и одновременно с этим — как конструктивный субстрат, такой тип питания называется хемолитогетеротрофией.
При хемоорганотрофии окисляемое органическое вещество всегда играет двойственную роль — энергоносителя и донора электронов для биосинтезов. Окисленные формы кофакторов дегидрогеназ (пиридин- и флавиннуклеотидов) регенерируются при ассимиляции свободной энергии, а также расходуются в биосинтетических реакциях.