МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ II - А. В. ПИНЕВИЧ - 2007
ГЛАВА 10. ОСНОВЫ ЭНЕРГЕТИЧЕСКОГО МЕТАБОЛИЗМА
Химическая энергия пищи употребляется в организме для создания свободной энергии структуры, для построения, возобновления, сохранения этой структуры, а не непосредственно превращается в работу.
Э. С. Бауэр. Теоретическая биология (Москва-Ленинград, 1935)
Энергетический метаболизм — это совокупность процессов ассимиляции и диссимиляции энергии. Ассимиляция энергии заключается в том, что клетка преобразует свободную энергию экзогенного энергоносителя или запасных полимеров в такую форму, которая непосредственно поддерживает процессы жизнедеятельности. В состоянии глубокого энергетического стресса клетка может ассимилировать энергию катаболического распада своих собственных незаменимых компонентов (рибосом, мембран и ферментов генерального метаболизма). При ассимиляции энергия извлекается из вышеуказанных источников, преобразуется и аккумулируется в унифицированной форме.
При диссимиляции энергия переходит в окружающую среду в результате совершения полезной работы или просто рассеивается.
Для преобразования энергии, прежде всего для ее ассимиляции, используются специализированные молекулярные системы — биотрансформаторы.
10.1. Биотрансформаторы
Основу биотрансформаторов составляет полипептид или мультиполипептидный комплекс. Одни из биотрансформаторов находятся в растворенном виде в цитозоле, другие иммобилизованы на мембранах. Назовем их соответственно цитозольными биотрансформаторами и мембранными биотрансформаторами.
Цитозольные биотрансформаторы гидрофильны, поскольку на их поверхности сосредоточены полярные группы. Мембранные биотрансформаторы гидрофобны снаружи или имеют гидрофобные домены, в результате чего они погружены в липидный матрикс или заякорены в нем.
Специфика действия биотрансформатора определяется:
— типом экзогенного энергоносителя;
— типом эндогенного энергоносителя;
— анизотропией процесса и участием в нем небелковых структур.
Экзогенный энергоноситель. Цитозольные биотрансформаторы обеспечивают ассимиляцию энергии только органических субстратов (хемоорганотрофия). Мембранные биотрансформаторы функционально более разнообразны. С их помощью может осуществляться не только хемоорганотрофия, но и ассимиляция энергии неорганических субстратов (хемолитотрофия), а также ассимиляция энергии света (фототрофия).
Эндогенный энергоноситель. Ассимиляция энергии — это не самоцель, а лишь способ временно аккумулировать энергию для ее последующего полезного использования. Эндогенный энергоноситель существует в динамичной материальной форме, которая обеспечивает взаимосвязь между процессами, протекающими с выделением энергии, и процессами, в ходе которых энергия поглощается.
Из химической термодинамики известно, что переход системы из одного энергетического состояния в другое связан с изменением четырех функций этого состояния — Е, Н, S и G.
Е — это внутренняя энергия, или суммарная потенциальная и кинетическая энергия всех элементов системы.
Н — это энтальпия, или функция энергетического состояния системы при постоянном давлении и постоянной температуре.
S — это энтропия, или термодинамическая функция, характеризующая неупорядоченность взаимного расположения элементов системы и хаотичность их движения.
G — это свободная энергия, или «энергия Гиббса» (J.W. Gibbs; 1839-1903), т. е. часть внутренней энергии, которая может быть превращена в полезную работу. Изменение этой термодинамической функции связано с изменением энергетического уровня системы и меры ее упорядоченности следующей зависимостью:
∆G = ∆Н - T∆S,
где Т — температура в градусах по шкале Кельвина.
Для живых систем важно изменение не внутренней, а свободной энергии, поскольку от ее запаса зависит способность выполнять полезную работу.
Свободная энергия служит мерой устойчивости системы. Высокие значения G свойственны неустойчивым системам, которые имеют тенденцию спонтанно переходить на более низкий энергетический уровень.
Сказанное можно подкрепить примером химических реакций, протекающих в живой клетке. Если система переходит в более устойчивое состояние, то разница свободной энергии продуктов и субстратов реакции (∆G = Gпрод. — Gcyб.) имеет отрицательное значение. Такая реакция протекает с выделением энергии, т. е. она термодинамически выгодна. Поскольку освобожденная энергия может быть использована для полезной работы, реакция выгодна и в биологическом отношении. Если система переходит в менее устойчивое состояние, разница свободной энергии продуктов и субстратов реакции имеет положительное значение. Такая реакция термодинамически невыгодна; не выгодна она и в биологическом отношении, поскольку для нее необходимо дополнительно затратить энергию.
В 1940 г. американский химик Чарльз Кориэл (С. D. Coryell) предложил называть
реакции, протекающие с выделением энергии, экзергоническими (англ. exergonic), а реакции, протекающие с поглощением энергии, эндергоническими (англ. endergonic).
Когда в живых клетках происходят экзергонические реакции (∆G <0), это редко связано с бесполезным рассеиванием энергии в форме теплоты. Обычно освобождающаяся энергия затрачивается в эндергонических реакциях (∆G >0). Они энергетически взаимосвязаны с экзергоническими реакциями, т. е. находятся с ними в «сопряжении» (англ. coupling). Итоговый результат процесса становится экзергоническим.
Если химическая реакция
αА + bВ ⇄ сС + dD
происходит при постоянном давлении и температуре, или в изобарно-изотермических условиях, то изменение свободной энергии ∆G (кДж • моль-1) составляет:
∆G = ∆G° + RTIn[C]c[D]d/[А]a[В]b,
где ∆G° — изменение свободной энергии в стандартных условиях (концентрация каждого реагента 1 М, давление 1 бар, температура 25°С); R — универсальная газовая постоянная; Т — абсолютная температура; [А], [В], [С], [D] — молярные концентрации субстратов и продуктов реакции; а, b, с, d — стехиометрическое количество молекул, участвующих в реакции.
Поскольку в состоянии равновесия ∆G = 0, значение ∆G° составляет:
-RTIn [С]c[D]d/[А]a[В]b=-2,303RTIgK,
где К — константа равновесия, которую можно определить экспериментально при заданной температуре.
Физико-химические параметры, относительно которых оценивается свободная энергия в биологических системах, значительно отклоняются от стандартных условий (прежде всего, концентрация реагирующих веществ <<1 М). Поэтому энергетическую эффективность химических реакций в данном случае принято оценивать не истинным изменением функции свободной энергии (∆G°), а изменением для состояния, отличающегося от стандартного, в частности при pH = 7. Это «кажущееся» изменение свободной энергии обозначается как ∆G°'. Если вещества участвуют в химической реакции в концентрациях, близких к эквимолярным, т. е. [С]с[D]d/[А]а[В]b = 1(К = 1), соблюдается равенство ∆G' = ∆G°'.
Выражение, с помощью которого рассчитывается стандартное изменение функции свободной энергии (G° = - 2,303RTIgК), носит универсальный характер. Для конкретного случая, связанного с окислительно-восстановительными превращениями, стандартное изменение свободной энергии рассчитывается по формуле:
∆G° = -nFE°,
где n — количество электронов (моль), переданных от донора к акцептору, F — число Фарадея (0,09649 кДж • моль-1 • мВ-1), Е° — стандартный редокс-потенциал (мВ), представляющий собой разность электрических потенциалов между окисляющимися и восстанавливающимися компонентами системы.
Для физиологических условий величина ∆G° принимает кажущееся значение: ∆G°' = -nFE°' (Е°' = Е°; pH = 7).
При окислительно-восстановительном превращении электроны векторно передаются от донора к акцептору. В такой системе, или электрохимической ячейке происходит упорядоченное движение, т. е. она характеризуется низкой энтропией. Чем меньше энтропия, тем выше уровень свободной энергии, и поэтому окислительновосстановительная система способна производить полезную работу.
Итак, ассимиляция энергии играет роль сопрягающего звена между экзергоническими и эндергоническими процессами. В какой же форме энергия ассимилируется и каким образом осуществляется сопряжение?
Химическая энергия может ассимилироваться в форме химического потенциала субстрата (фосфагена) или в форме трансмембранного электрохимического потенциала катионов Н+ или Ка+. Световая энергия может ассимилироваться только в форме энергии трансмембранного электрохимического потенциала.
Замечательным свойством двух форм ассимилированной энергии является то, что они взаимно конвертируются, т. е. беспрепятственно преобразуются одна в другую.
Анизотропия процесса и участие в нем небелковых структур. Степень упорядоченности цитозольных и мембранных биотрансформаторов существенно различается.
В первом случае ассимиляция энергии протекает в изотропной среде. Действие цитозольных биотрансформаторов не носит векторного характера, оно подчиняется закономерностям молекулярной кинетики и в первую очередь зависит от диффузионного контакта между растворенными молекулами.
Во втором случае мембранные биотрансформаторы, или генераторы ионных градиентов осуществляют векторный процесс. Для таких систем решающее значение имеет ориентация по отношению к компартментам, изолированным друг от друга мембраной, а также различие состава двух фаз, разделенных мембраной. Действие мембранных биотрансформаторов определяется не диффузионными контактами между молекулярными партнерами, а их упорядоченным и близким взаимным расположением — вплоть до перекрывания электронных облаков отдельных атомов. Примером такого биотрансформатора служит фотосинтетический аппарат.
Цитозольные и мембранные биотрансформаторы, как правило, дополнительно содержат небелковые компоненты. В первую очередь к ним относятся органические или неорганические кофакторы, а также пигменты. Особое влияние на мембранные биотрансформаторы оказывают фосфолипиды. Их неполярные хвосты формируют гидрофобное окружение, стабилизирующее структуру биотрансформатора. В свою очередь, полярные головки липидов определяют взаимодействие мембранного биотрансформатора с его молекулярным окружением и образуют гидрофильную поверхность, что позволяет цитозольному биотрансформатору перейти в иммобилизованное состояние и тем самым повысить уровень своей упорядоченности.
Еще совсем недавно действие цитозольных биотрансформаторов рассматривали только как изотропный и хаотичный процесс. Однако последние данные свидетельствуют о существовании энзоскелета — физической ассоциации между цитозольными ферментами (см. I том учебника). Подобным образом, по-видимому, структурирован даже молекулярный аппарат гликолиза (см. раздел 11.3.2.1), центральным звеном которого является цитозольный биотрансформатор.
10.2. Фосфагены
Химические соединения, в форме которых клетки ассимилируют энергию, известны под разными названиями — «богатые энергией соединения», «макроэргические вещества» и «фосфагены». Термин «богатое энергией соединение» (англ, energy-rich compound) ввел в начале 1940-х годов американский биохимик Фриц Липманн (F.Lippmann, Нобелевская премия по физиологии и медицине, 1953 г.). В специальной литературе на русском языке используется равнозначный термин «макроэргическое вещество» (греч. makros — большой и ergon — работа), предложенный в конце 1930-х годов советским биохимиком В. А. Энгельгардтом.
В начале 1940-х годов Липманн предложил изображать лабильные химические связи в структурных формулах этих соединений знаком ~. Такие связи часто называют «богатыми энергией» в отличие от «обычных» связей. Однако это совершенно лишено оснований, поскольку энергия разрыва одинарной химической связи в молекулах органических соединений примерно одинакова (344 кДж • моль-1 для связи С-С, 350 кДж • моль-1 для связи С-О, 292 кДж • моль-1 для связи C-N и 360 кДж • моль-1 для связи Р-О).
С биоэнергетической точки зрения очень важно, что в структуре некоторых (в частности, фосфорилированных) молекул существует стерическое напряжение, вызванное электростатическим отталкиванием между одноименно заряженными группировками. Разрыв межатомных связей в таких молекулах, как и разрыв любой химической связи, требует затраты энергии (т. е. ∆G >0). Однако образующиеся продукты подвергаются изомеризации, нейтрализации и гидратации, в результате чего общее изменение свободной энергии принимает отрицательное значение. Распад рассматриваемых соединений представляет собой процесс, при котором изменение стандартной свободной энергии (∆G°) принимает значения в интервале от -7 до -70 кДж • моль-1. Ближе к нижней границе (по абсолютной величине) располагаются «бедные энергией соединения», а ближе к верхней границе — «богатые энергией соединения».
Фосфорильный остаток ~ РО3- (сокращенно «Р») мобилизуется путем гидролиза фосфоэфирной связи. При этом изменение свободной энергии принимает промежуточные значения между -7 и -70 кДж-моль-1. В частности, ∆G°' для реакции АТФ + Н2О —> АДФ + Ф составляет -30 кДж • моль-1. Кроме того, фосфорильный остаток может передаваться от одного фосфоэфира к другому путем энзиматической реакции «переноса (фосфатной) группы», в результате чего экзергонические соединения становятся взаимно конвертируемыми.
«Богатые энергией соединения» могут подвергаться и неферментативному гидролизу. Освобождающаяся энергия при этом переходит в теплоту. В случае полезного использования энергии фосфорильная группа отщепляется ферментативным путем. Тогда свободная энергия передается другому химическому носителю (не обязательно «богатому энергией») или непосредственно используется для полезной работы.
Если «богатое энергией соединение» принимает участие в фосфокиназной реакции, его фосфорильная группа переносится на другой субстрат, активируя его. В отсутствии подходящего акцептора происходит фосфогидролазная реакция, и фосфорильная группа освобождается в виде аниона ортофосфата (Ф):
субстрат1~Р + субстрат2 —> субстрат1 + субстрат2~Р,
субстрат1~Р + Н2О —> субстрат1 + Ф.
Путем обратимой мобилизации фосфорильной группы «богатые энергией соединения» осуществляют сопряжение между эндергоническими и экзергоническими процессами.
«Богатые энергией соединения» используются в первую очередь для выполнения осмотической или электрической работы при uphill-транспорте через мембраны. Их потребителями также служат эндергонические процессы в самой клетке (биосинтезы, работа цитоскелета и локомоторных систем, действие сигнальных каскадов).
К числу «богатых энергией соединений» относятся:
— нуклеозидтрифосфаты (АТФ, ГТФ, ТТФ, УТФ и ЦТФ);
— пирофосфат ФФ и конденсированные неорганические фосфаты, или полифосфаты (Ф)n;
— фосфоэнолпируват;
— О-ацилфосфаты (1,3-бисфосфоглицерат, ацетилфосфат, бутирилфосфат, β-аспартилфосфат и карбамоилфосфат);
— N-ацилфосфаты (креатинфосфат и аргининфосфат).
Структурные формулы некоторых из них приводятся на рис. 68.
Рис. 68. Примеры «богатых энергией соединений», или фосфагенов. А — нуклеозидтрифосфаты; Б — конденсированные неорганические фосфаты; В — энолфосфаты; Г — О-ацилфосфаты; Д — N-ацилфосфаты.
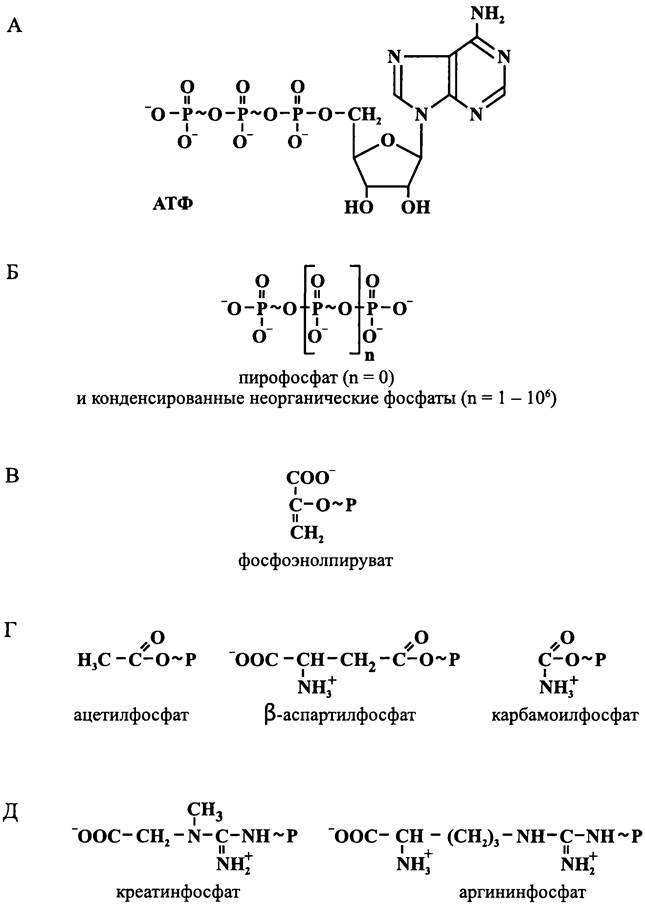
Чаще всего в роли «богатого энергией соединения» выступает АТФ, хотя вместо него могут использоваться и другие нуклеозидтрифосфаты (например, для трансляции на рибосомах необходим ГТФ, а для биосинтеза полигликозидов — УТФ). «Богатым энергией соединением», которое обеспечивает мышечное сокращение у позвоночных, служит креатинфосфат; перенос фосфорила между ним и АТФ осуществляется с помощью креатинфосфокиназы. В свою очередь, у некоторых беспозвоночных этот фермент отсутствует, и в роли «богатого энергией соединения» выступает аргининфосфат, который с помощью аргининфосфокиназы поддерживается в состоянии химического равновесия с АТФ.
Для того, чтобы в физиологических условиях стать предшественником АТФ, т. е. находиться с ним в химическом равновесии, соединение с фосфорильной группой должно иметь свободную энергию гидролиза не ниже -30 кДж • моль-1 (по абсолютному значению).
Из сказанного становится ясно, что термин «богатая энергией связь» обманчив, и никакого повышенного запасания энергии в структуре АТФ и других «богатых энергией молекул» не происходит. Истинная биологическая роль этих соединений заключается в том, что их гидролиз является экзергоническим процессом, т. е. изменение свободной энергии принимает отрицательное значение (∆G <0). Кроме того, свободная энергия гидролиза в данном случае достаточно высока по абсолютному значению.
Как уже говорилось, свободная энергия является термодинамической функцией отклонения системы от равновесного состояния, и поэтому при использовании внешнего источника энергии равновесие реакции (АДФ + Ф АТФ) смещено в сторону образования АТФ.
Таким образом, нам следует отказаться от терминов «богатое энергией соединение» и «макроэргическое вещество», поскольку, как выяснилось, эти молекулы не обладают повышенным запасом энергии, а только осуществляют сопряжение между экзергоническими и эндергоническими процессами. Вместо этого мы воспользуемся термином «фосфаген» (греч. phos — свет и gene — порождаю; несущий энергию).
Этот термин был введен в 1927 г. Эгглтонами (Р. Eggleton, С. Р. Eggleton). Исходно он обозначал неизвестное фосфорорганическое соединение, которое вскоре было идентифицировано как фосфорильное производное креатина — креатинфосфат. Позднее термин «фосфаген» был распространен на фосфорильные производные аргинина и другие N-фосфорилированные производные гуанидина, которые вместе с адениловыми нуклеотидами участвуют в реакциях переноса фосфорильной группы.
В нашем случае мы будем пользоваться этим термином не в его первоначальном узком смысле, а применительно ко всем способам ассимиляции энергии в форме химического потенциала растворенного субстрата.
Особое место среди фосфагенов занимают адениловые нуклеотиды (АТФ и, в меньшей степени, ГТФ и УТФ). Изменение свободной энергии при гидролизе их терминальной или субтерминальной фосфоэфирной связи соответственно составляет:
АТФ + Н2O —> АДФ + Ф
(∆G°'= -30,5 кДж • моль-1),
АТФ + Н2O —> АМФ + ФФ,
(∆G°'= -30,5 кДж • моль-1).
Реальный выход свободной энергии во второй реакции несколько больше, поскольку химическое равновесие сдвигается вправо благодаря удалению неорганического пирофосфата с помощью растворимой пирофосфатазы:
ФФ + Н2O —> 2Ф.
Причина термодинамической неустойчивости АТФ заключается в том, что при «нормальных» физиологических условиях (в частности, при pH 7) его молекула представляет собой полианион, несущий четыре диссоциированные гидроксильные группы (рис. 68, А). Соседние отрицательные заряды электростатически отталкиваются, кроме того, между атомами фосфора существует конкурентный резонанс за восемь неподеленных электронов при атомах кислорода. Из-за этих внутренних взаимодействий химические связи -Р-О-Р- испытывают напряжение и легко поддаются гидролизу. Стабильность продуктов гидролиза АТФ (АДФ и АМФ) прогрессивно увеличивается, что и объясняет экзергоническую энергетику приведенных реакций.
После создания Липманном концепции «богатых энергией соединений» использование АТФ непосредственно связывали с гидролизом фосфоангидридных связей в активном центре соответствующего фермента (АТФазы). До начала 1970-х годов предполагали, что количество энергии, получаемой в ходе реакции гидролиза, определяется только природой связи между фосфорилом и остальной частью молекулы. Помимо этого, существовала точка зрения, что экзергоничность фосфоиминной связи -М(~Р)- в молекуле креатинфосфата, фосфоэнольной связи =С(~Р)- в молекуле фосфоэнолпирувата, фосфоангидридной связи -O~Р в молекуле АТФ и (Ф)n, а также фос- фоацильной связи -СОО~Р в молекуле β-аспартилфосфата одинакова как в ферментосвязанной форме, так и в растворе. Наконец, направление переноса фосфорила от одного фосфагена к другому объясняли только различием в энергии гидролиза фосфорилированных молекул. В настоящее время большее значение придается изменению свободной энергии фосфагена еще до гидролиза, что определяется энергией его связывания и сольватации, а также изменением энтропии в этих процессах.
Экзергоничность таких фосфагенов, как АТФ, ГТФ, ТТФ, УТФ и ЦТФ объясняется наличием в их составе остатков фосфорила. Поскольку свободная энергия гидролиза этих нуклеотидов примерно одинакова, непонятно, в силу каких причин природа выбрала именно АТФ в качестве главного фосфагена. В. П. Скулачев предположил, что поскольку по сравнению с другими азотистыми основаниями аденин имеет умеренные донор-акцепторные свойства, это расширяет круг субстратов, с которыми может взаимодействовать АТФ. Кроме того, аденин относительно более устойчив к действию коротковолнового УФ-излучения, что могло иметь селективные преимущества на ранних этапах биологической эволюции, когда еще не существовал озоновый экран.
При переносе энергии с помощью АТФ образуются два продукта гидролиза — АДФ и АМФ. После этого АДФ может быть преобразован в АТФ путем фосфорилирования: АДФ + Ф —> АТФ. В свою очередь, АМФ превращается в АДФ при помощи аденилаткиназы:
АМФ + АТФ —> 2АДФ.
Из приведенных уравнений реакций следует, что перенос энергии с помощью АТФ сопровождается взаимными превращениями всех трех аденилатных нуклеотидов (АМФ, АДФ и АТФ). Хотя в качестве энергетической «валюты» все живые организмы используют АТФ, энергетическое состояние клетки определяется не только концентрацией этого аденилата. Важную роль играет концентрация АДФ и АМФ, а также ортофосфата.
Концентрация аденилатных нуклеотидов оказывает регуляторное воздействие на ход биохимических процессов. Активность многих ферментов зависит от соотношений конкурентных аллостерических субстратов — АТФ/АДФ или АТФ/АМФ, причем тип регуляции может быть, как стимулирующим, так и ингибирующим. Поэтому баланс между АТФ, АДФ и АМФ исключительно важен для поддержания клеточного гомеостаза.
Энергетический статус клетки определяется накоплением фосфоангидридных связей. В начале 1970-х годов английский биохимик Эткинсон (D.E.Atkinson) предложил называть соответствующую термодинамическую функцию энергетическим зарядом (англ. energy charge, ЕС). Он представляет собой усредненное частное от деления количества гидролизуемых фосфоангидридных связей (число которых в молекуле АТФ равно двум, а в молекуле АДФ одной), на сумму всех аденилатов:
ЕС = 1/2 (2[АТФ] + [АДФ]) / ([АТФ] + [АДФ] + [АМФ])
или
ЕС = ([АТФ] + 1/2[АДФ]) / ([АТФ] + [АДФ] + [АМФ]).
Максимальное значение ЕС равно единице (при этом [АДФ] = 0 и [АМФ] = 0; аденилатный пул состоит только из АТФ). Такое физиологическое состояние характеризуется предельно высоким энергетическим статусом. Минимальное значение ЕС равно нулю (при этом [АТФ] = 0 и [АДФ] = 0; аденилатный пул состоит только из АМФ). Такое физиологическое состояние характеризуется предельно низким энергетическим статусом. Регуляторные системы препятствуют наступлению обоих экстремальных энергетических состояний, и в нормально функционирующей клетке ЕС поддерживается на уровне 0,8-0,9. При ЕС <0,8 скорость синтеза АТФ возрастает, а при ЕС>0,9 уменьшается, что регулирует использование энергии в физиологических процессах и одновременно с этим — ферментативную кинетику образования АТФ.
Другой термодинамической функцией, характеризующей энергетический статус клетки, является потенциал фосфорилирования (англ. phosphorylation potential). Он выражается через константу равновесия К реакции (АДФ + Ф —> АТФ), т. е.:
К = [АТФ| / ([АДФ] [Ф]).
В отличие от энергетического заряда, потенциал фосфорилирования зависит от концентрации ортофосфата. Если [Ф] поддерживается на постоянном уровне, то физиологическое значение двух аденилатов оказывается одинаковым. Подобно энергетическому заряду, потенциал фосфорилирования регулирует активность ферментов, действующих в узлах метаболических путей.
10.3. Цитозольные биотрансформаторы
С помощью цитозольных биотрансформаторов химическая энергия ассимилируется в форме химического потенциала фосфагена (обозначаемого как субстрат~Р). Фосфагены образуются двумя способами.
Первый способ — это включение ортофосфата (Ф) в состав органической молекулы в ходе ферментативной дегидрогеназной реакции:
субстратred+ Аох + Ф —> субстратох~Р + Аrеd
где Аох и Ared — соответственно окисленный и восстановленный акцептор электронов.
В данном случае свободная энергия ассимилируется в структуре фосфорилиро- ванной молекулы. Например, при гликолизе в результате окисления 3-фосфоглицеринового альдегида (СН2ОР-СНОН-СНО) образуется такой фосфаген, как 1,3- бисфосфоглицерат (СН2ОР-СНОН-СОО~Р).
Второй способ образования фосфагена — это замена группы R, присоединенной лабильной тиоэфирной связью к скелету органической молекулы, на остаток ортофосфата:
субстрат~S-R + Ф —> субстрат~Р + НS-R.
Типичным примером служит фосфотрансацетилазная реакция, в результате которой тиоэфирная связь ацетил-СоА заменяется на фосфоэфирную связь с образованием такого фосфагена, как ацетилфосфат:
СН3-СО~SСоА + Ф —> СН3-СОО~Р + НS-СоА.
В зависимости от соотношения химических потенциалов фосфагенов между ними возможен направленный обмен фосфорильной группой. Однако только один фосфаген играет роль свободно конвертируемого и универсально распространенного аккумулятора фосфорила, и этим соединением является АТФ.
Фосфорилирование АДФ на уровне субстрата и АТФ-сопряженные фосфагены. Для обозначения механизма фосфорилирования путем переноса на АДФ фосфатной группы от другого фосфагена в отечественной литературе используется крайне неудачный термин «субстратное фосфорилирование» (если вдуматься, то любой биохимический процесс является субстратным, а фосфорилироваться могут самые разные субстраты).
Следуя международной традиции, мы воспользуемся термином «фосфорилирование АДФ на уровне субстрата» (англ. substrate-level phosphorylation).
Под этим названием объединяются протекающие в цитозоле однотипные ферментативные реакции, которые представляют собой обменный процесс — АТФ образуется путем переноса на АДФ фосфорильной группы от другого фосфагена. Реакция катализируется соответствующей киназой, и химическое равновесие смещено в сторону образования АТФ:
АДФ + субстрат~Р —> АТФ + субстрат.
Фосфорилирование АДФ на уровне субстрата встречается у представителей всех трех филогенетических доменов.
Существуют несколько разновидностей донора фосфорила. Однако не все они «богаты энергией» (точнее сказать, реакция их гидролиза обычно низко экзергонич- на). Кроме того, их физиологическая концентрация недостаточна, чтобы сместить равновесие реакции в сторону образования АТФ.
Набор соединений, способных в физиологических условиях играть роль донора фосфорильной группы для АДФ, невелик. Соответственно, существует небольшое число ферментных систем, обеспечивающих образование АТФ за счет энергии гидролиза других фосфагенов.
Приведем примеры АТФ-сопряженных фосфагенов.
Нуклеозидтрифосфатпы. Важнейшим среди них является гуанозинтрифосфат (ГТФ). Реакция его гидролиза умеренно экзергонична:
ГТФ + Н2O —> ГДФ + Ф
(∆G°′ = -33,5 кДж • моль-1).
ГТФ регенерирует АТФ с помощью нуклеозиддифосфаткиназы:
АДФ + ГТФ —> АТФ + ГДФ.
Конденсированные неорганические фосфаты (полифосфаты). Реакция их гидролиза умеренно экзергонична:
(Ф)n + Н2O —> (Ф)n-1 + Ф
(∆G°′ = -33,5 кДж • моль-1).
Конденсированные неорганические фосфаты регенерируют АТФ с помощью полифосфаткиназы:
АДФ + (Ф)n —> АТФ + (Ф)n-1.
Ацилфосфаты. Важнейшим среди них является 1,3-бисфосфоглицерат. Реакция его гидролиза высоко экзергонична:
СН2ОР-СНОН-СОО~Р + Н2O —> СН2ОР-СНОН-СООН + Ф
(∆G°′ = -49,4 кДж • моль-1).
Бисфосфоглицерат служит источником фосфорила в фосфоглицераткиназной реакции:
АДФ + СН2ОР-СНОН-СОО~Р —> СН3ОР-СНОН-СООН + АТФ.
Другим ацилфосфатом, свободная энергия гидролиза которого также составляет около -49,4 кДж • моль-1, является ацетилфосфат. Его фосфорильная группа мобилизуется ацетаткиназой:
АДФ + СН3-СОО~Р —> АТФ + СНз-СООН.
Ацетилфосфат образуется из ацетилтиоэфира коэнзима А (ацетил-СоА) с помощью фосфотрансацетилазы:
СНз — СО~SСоА + Ф —> СН3-СОО~Р + СоАSН.
Энолфосфаты. Важнейшим среди них является фосфоэнолпируват. Реакция его гидролиза особо экзергонична:
СН2 = СО(~Р)-СООН + Н2O —> СНз-СО-СООН + Ф
(∆G°′ = -62 кДж • моль-1).
Фосфоэнолпируват регенерирует АТФ в реакции, катализируемой пируваткина- зой:
АДФ + СН2 = СО(~Р)-СООН —> АТФ + СН3-СО-СООН.
Фосфоэнолпируват представляет собой наиболее распространенный донор фосфорила для АДФ у прокариотов и встречается как у аэробов, так и у анаэробов.
В отличие от фосфоэнолпирувата, ацетилфосфат используется преимущественно анаэробными бактериями-ферментаторами.
Фосфоэнолпируват и ацетилфосфат, а также 1,3-бисфосфоглицерат образуются при гликолизе, который является одним из важнейших путей хемогетеротрофного питания (см. раздел 11.3.2).
Значение цитозольных биотрансформаторов. Цитозольные биотрансформаторы исключительно важны для бактерий, жизнь которых протекает в средах с низким содержанием экзогенных акцепторов электронов, прежде всего кислорода.
Когда возможность ассимилировать энергию путем аэробного дыхания ограничена ввиду слабого доступа или отсутствия кислорода, возникает острая конкуренция за альтернативные акцепторы электронов, например, сульфат, нитрат и фумарат. Именно поэтому среди бактерий так широко распространено получение энергии путем брожений, основанных на гликолизе и анаэробном расщеплении пиру вата.
Для архей значение цитозольных биотрансформаторов в качестве систем ассимиляции энергии в целом невелико. Обычно они используют мембранные биотрансформаторы, для которых терминальными акцепторами электронов служит сера или такое нетривиальное соединение, как гетеродисульфид. Что же касается экстремально галофильных архей, то в анаэробных условиях они переключаются на квази- фототрофию (см. раздел 12.7.6).
Следует иметь в виду, что у многих бактерий и архей цитозольные биотрансформаторы функционируют наряду с мембранными.
Например, гликолитический путь предваряет полное окисление пиру вата в цикле Кребса, служащего поставщиком восстановленных пиридиновых и флавиновых нуклеотидов для дыхательной цепи.
10.4. Мембранные биотрансформаторы
С помощью мембранных биотрансформаторов химическая или световая энергия первично ассимилируется в форме трансмембранного электрохимического потенциала катионов Н+или Na+. После этого она используется в эндергонических процессах, важнейшими из которых являются:
— биосинтез АТФ или пирофосфата ФФ;
— импорт питательных субстратов;
— экспорт продуктов метаболизма;
— секреция белков;
— импорт гетерологичной ДНК;
— плавание при помощи вращающихся жгутиков;
— скользящее движение.
В соответствии с положениями хемиосмотической теории, электрохимический потенциал обеспечивает сопряжение эндергонических и экзергонических процессов, т. е. он выполняет такую же роль, как АТФ в изотропной среде. Перенос энергии в мембранных системах осуществляется векторным путем, в частности, с помощью векторных ферментативных реакций.
Мембранное фосфорилирование АДФ. Физиологической альтернативой фосфорилирования АДФ на уровне субстрата служит мембранное фосфорилирование АДФ.
Этот векторный способ образования АТФ осуществляется в соответствии с хе- миосмотическим механизмом, который Питер Митчел постулировал в начале 1960-х годов. У бактерий мембранное фосфорилирование АДФ происходит на уровне СМ или ICM. Археи не обладают ICM, и мембранное фосфорилирование АДФ у них осуществляется только на уровне СМ.
Мембрана играет роль барьера между цитоплазматическим и экзоплазматиче- ским компартментами и одновременно с этим — роль твердой фазы, которая иммобилизует ферментативный аппарат для синтеза АТФ.
Теория хемиосмотического сопряжения представляет собой адаптированный к биосистемам вариант физико-химической теории электродвижущей силы (э. д. с.), которую разработал в начале XX в. немецкий химик Вальтер Нернст (W. Nernst, Нобелевская премия по химии, 1920 г.). В ней э. д. с. рассматривается как функция электролитического напряжения и осмотического давления в растворе.
Применительно к живым системам свободная энергия двух разделенных мембраной водных растворов электролита, или иондвижущая сила (англ. ion motive force, Imf), выражается в трансмембранном электрохимическом потенциале этого иона. Точнее сказать, она состоит из двух компонентов — разности электрических потенциалов (А![]() ) и разности химических потенциалов (∆μ). Оба компонента иондвижущей силы удобно выражать в электрических единицах, для чего значение химического потенциала делят на число Фарадея. На примере катиона in+ имеем:
) и разности химических потенциалов (∆μ). Оба компонента иондвижущей силы удобно выражать в электрических единицах, для чего значение химического потенциала делят на число Фарадея. На примере катиона in+ имеем:
![]()
где n — абсолютная величина заряда катиона in+; ∆![]() — разность электрических потенциалов; ∆μ — разность химических потенциалов катиона in+; F — число Фарадея; R — универсальная газовая постоянная; Т — абсолютная температура; [in+]out и [in+]in — молярные концентрации, или активности катиона in+ в экзоплазматической (out) и цитоплазматической (in) фазах.
— разность электрических потенциалов; ∆μ — разность химических потенциалов катиона in+; F — число Фарадея; R — универсальная газовая постоянная; Т — абсолютная температура; [in+]out и [in+]in — молярные концентрации, или активности катиона in+ в экзоплазматической (out) и цитоплазматической (in) фазах.
В частном случае, когда мембрана изолирует водные фазы с разной активной кислотностью, т. е. с разной концентрацией протонов, речь идет о протондвижущей силе (англ. protonmotive force, Pmf). Преобразуя натуральный логарифм отношения молярных концентраций протонов (ln [H+]out/ [H+]jn) в единицы pH, получаем:
![]()
После подстановки стандартного значения Е (см. выше), а также стандартного значения R (8,3146 Дж • град-1 • моль-1) для «физиологической» температуры 25°С (переведенной в градусы шкалы Кельвина) окончательно получаем величину Рmf (в милливольтах, мВ):
![]()
Если концентрация протонов в разделенных мембраной компартментах различается на порядок, ∆рН = 1. Эта разность химических потенциалов при 25°С эквивалентна разности электрических потенциалов в 59,06 мВ, а при 80°С — 70 мВ.
Пытаясь объяснить способ образования АТФ в митохондриях, Митчел постулировал «хемиосмотический» механизм сопряжения дыхания с фосфорилированием. В соответствии с этим термином, химический потенциал АТФ (т. е. концентрация АТФ в митохондриальном матриксе) является производным от осмотического потенциала Н+ (т. е. градиента концентрации Н+), который создается в результате дыхания. В дальнейшем хемиосмотический механизм был распространен на пластиды, а также на клетки хемотрофных и фототрофных прокариотов.
Напомним, что изменение стандартной свободной энергии Гиббса (ДС°, кДж моль-1) в реакции фосфорилирования АДФ — это изменение химического потенциала ортофосфата (Ф):
∆С° = ∆μ(Ф) = -RTIn[АДФ][Ф]/[АТФ].
При субстратзависимом фосфорилировании АДФ фосфорильная группа переносится от другого фосфагена, и такой процесс зависит от химического потенциала последнего.
При мембранном фосфорилировании молекула АДФ непосредственно присоединяет к себе ортофосфат. В этой реакции источником свободной энергии служит трансмембранный электрохимический потенциал протонов (Рmf):
![]()
где ∆![]() — разность электрических потенциалов, ∆μ(Н+) — разность химических потенциалов протона.
— разность электрических потенциалов, ∆μ(Н+) — разность химических потенциалов протона.
Митчел предложил рассматривать электрохимический потенциал как форму ассимиляции энергии. Он также постулировал, что фосфорилирование АДФ катализируется «осмоэнзимом», преобразующим свободную энергию электрохимического потенциала протонов Рmf в свободную энергию потенциала фосфорилирования ∆μ(Ф). Наконец, он предположил, что эти формы ассимилированной энергии превращаются одна в другую:
∆μ(Ф) <-> Рmf.
Преобразование химического потенциала в осмотический потенциал и обратный процесс осуществляются с помощью митчеловой АТФазы/АТФ-синтазы (см. рис. 74).
Если АТФаза/АТФ-синтаза работает в сторону гидролиза АТФ, каталитический центр домена Их связывает АТФ и гидролизует его терминальную фосфоангидридную связь. За счет этой экзергонической реакции осуществляется эндергонический процесс — протоны движутся вверх по градиенту потенциальной энергии и переходят из цитоплазматического компартмента в экзоплазматический компартмент по каналу внутри домена F0. В результате этого экзоплазматический компартмент закисляется, и экзоплазматическая поверхность мембраны становится более элек- тропозитивной.
В свою очередь, если АТФаза/АТФ-синтаза работает в сторону образования АТФ, протоны движутся через канал внутри домена F0 вниз по градиенту потенциальной энергии. При этом каталитический центр домена F1 связывает субстраты (АДФ и Ф), и за счет потенциальной энергии протонов образуется терминальная фосфоангидридная связь АТФ. В результате этого экзоплазматический компартмент защелачивается, и экзоплазматическая поверхность мембраны становится более электронегативной.
Направление реакции, которую катализирует АТФаза/АТФ-синтаза, определяется соотношением между потенциалом фосфорилирования ∆μ(Ф) и Рmf.
Если ∆μ(Ф) >n х Рmf, где n —число протонов, которые переносятся через мембрану при гидролизе одной молекулы АТФ (по разным данным, оно составляет 0,5-3,0), то за счет свободной энергии этой реакции создается Рmf. Напротив, когда ∆μ(Ф) <n х Рmf, за счет использования энергии протонного градиента из АДФ и Ф синтезируется АТФ.
Протонтранслоцирующие АТФазы обратимого действия имеются у бактерий (F0F1-АТФазы/АТФ-синтазы) и архей (А0А1-АТФазы/АТФ-синтазы), а также у произошедших от бактерий энергоассимилирующих органелл — митохондрий и пластид
Более подробно эти ферменты мы рассмотрим в разделе 10.4.3.
Что касается мембранных АТФаз ядерных клеток (Р-АТФаз плазматической мембраны и V-АТФаз эндомембран), то они могут только однонаправленно преобразовывать свободную энергию АТФ в Рmf.
Зависимость Рmfот кислотности внешней среды и рН-гомеостаз. Величина Рmf, а также знак и абсолютное значение ее электрического (∆![]() ) и концентрационного Z∆рН) компонентов зависят не только от температуры. На них еще влияет кислотность окружающей среды и цитоплазмы. В свою очередь, постоянство цитоплазматического pH (рН-гомеостаз) зависит от механизмов, создающих Рmf. Важна также пассивная проницаемость СМ для протонов или катионов Nа+ — в первом случае она выше, чем во втором. Особо критична проницаемость для протонов у термофилов, а также у ацидофилов, которые сталкиваются с колоссальной (до шести порядков) разностью концентраций этого катиона по двум сторонам мембраны.
) и концентрационного Z∆рН) компонентов зависят не только от температуры. На них еще влияет кислотность окружающей среды и цитоплазмы. В свою очередь, постоянство цитоплазматического pH (рН-гомеостаз) зависит от механизмов, создающих Рmf. Важна также пассивная проницаемость СМ для протонов или катионов Nа+ — в первом случае она выше, чем во втором. Особо критична проницаемость для протонов у термофилов, а также у ацидофилов, которые сталкиваются с колоссальной (до шести порядков) разностью концентраций этого катиона по двум сторонам мембраны.
В результате действия мембранных биотрансформаторов, создающих Pmf внешняя поверхность СМ всегда заряжается положительно. Внутренняя поверхность СМ имеет меньший по величине положительный заряд или даже приобретает отрицательный заряд.
Прокариоты-нейтрофилы, например, Е. соli (табл. 9) существуют при pH 5-8,5, и pH цитоплазмы у них близок к нейтральному. При создании Рmf экзоплазматический компартмент закисляется, причем ∆рН достигает 1,5 и более единиц. Значение Рmf, ориентированной внутрь клетки, составляет около -170 мВ, и в ней примерно поровну представлены оба компонента (∆![]() и Z∆pH).
и Z∆pH).
Таблица 9. Зависимость Рmf от кислотности внешней среды

Прокариоты-ацидофилы, например, Acidithiobacillus ferrooxidans (табл. 9) развиваются при высокой кислотности среды (pH 0-5). Хотя такие местообитания могут возникать самым разным путем, экстремально кислые ниши создаются прежде всего в результате геотермальной активности. За счет выделения и окисления серы и сульфида значение pH может даже опуститься ниже 0 (>1 М серной кислоты). У ацидофилов при сохранении нейтральности внутриклеточной среды ∆рН достигает трех и более единиц. В результате этого главным компонентом Pmf становится Z∆pH, в то время как ∆![]() имеет относительно небольшое по абсолютной величине значение. Pmf ориентирована внутрь клетки и составляет около -230 мВ. Внутренняя поверхность СМ несет положительный заряд, что препятствует перемещению протонов по градиенту их концентрации и способствует сохранению рН-гомеостаза.
имеет относительно небольшое по абсолютной величине значение. Pmf ориентирована внутрь клетки и составляет около -230 мВ. Внутренняя поверхность СМ несет положительный заряд, что препятствует перемещению протонов по градиенту их концентрации и способствует сохранению рН-гомеостаза.
Прокариоты-алкалифилы, например, Bacillus firmus (табл. 9) развиваются в щелочной среде (pH 8,5-11,5). Такие условия создаются реже, чем кислые, и особенно это касается экстремально щелочных ниш. Главным образом речь идет о реликтовых содовых озерах, pH которых достигает 10,5 и более. Цитоплазматический pH алка- лифилов сдвинут в сторону щелочных значений. Главным компонентом Pmf здесь является ∆![]() , в то время как ZApH имеет относительно низкое значение и «инвертированное» направление — цитоплазматический pH меньше экзоплазматического. В данных условиях pH-гомеостаз цитоплазмы обеспечивается Nа+/Н+-антипорте- ром, с помощью которого внутриклеточные катионы Na+ обмениваются на протоны из внешней среды. Главным источником энергии для вторичного транспорта служит ∆
, в то время как ZApH имеет относительно низкое значение и «инвертированное» направление — цитоплазматический pH меньше экзоплазматического. В данных условиях pH-гомеостаз цитоплазмы обеспечивается Nа+/Н+-антипорте- ром, с помощью которого внутриклеточные катионы Na+ обмениваются на протоны из внешней среды. Главным источником энергии для вторичного транспорта служит ∆![]() , который создается с помощью дыхательной цепи, перекачивающей протоны из цитоплазмы во внешнюю среду (см. раздел 10.4.6).
, который создается с помощью дыхательной цепи, перекачивающей протоны из цитоплазмы во внешнюю среду (см. раздел 10.4.6).
Поскольку Pmf алкалифилов имеет низкое значение, тривиальный механизм фосфорилирования АДФ с помощью Н+-АТФазы/АТФ-синтазы становится малоэффективным. Выход из создавшегося положения могут, в принципе, обеспечивать два компенсаторных энергетических механизма.
В первом случае действует «натриевая» АТФаза/АТФ-синтаза, которая для фосфорилирования АДФ использует Smf — трансмембранный потенциал катионов Ка+ (см. раздел 10.4.10). Однако у большинства алкалифилов нет этого осмоэнзима, а также нет биотрансформаторов, которые бы ассимилировали энергию в форме Smf.
Во втором случае интенсифицируется работа дыхательной электрон-транспортной цепи, создающей Pmf, причем нужно, чтобы перекачиваемые протоны не уравновешивались с окружающей средой, а каким-то образом концентрировались вблизи Н+-АТФазы/АТФ-синтазы. Сегодня реальным кажется именно этот механизм, поскольку аэробные алкалифилы (особенно экстремальные представители этой группы) имеют повышенное содержание цитохромов и других компонентов дыхательной системы.
В связи со сказанным попытаемся выяснить, почему ацидофилы не паразитируют на градиенте pH между цитоплазмой и окружающей средой, что фактически означало бы жизнь за счет осмотической энергии? Ответ на этот «наивный» вопрос заключается в том, что градиент pH существует не независимо от клеточных биотрансформаторов, а только благодаря им. В частности, дыхательные цепи ацидофилов экскретируют протоны против сильного градиента их концентрации, что позволяет сохранять pH-гомеостаз. При этом Рmfподдерживается на физиологическом уровне путем инверсии![]() (положительный внутри), что достигается в результате импорта катионов, в частности К+.
(положительный внутри), что достигается в результате импорта катионов, в частности К+.
Физиологический уровень Рmf или Smf, с одной стороны, определяется пассивной ионной проницаемостью СМ, а с другой стороны — отражает баланс между экзергоническими и эндергоническими процессами. Конкретнее, имеет место цикл «сопрягающего» иона (трансмембранный электрохимический потенциал которого служит посредником между экзергоническими и эндергоническими процессами). Смысл этого цикла — динамическое равновесие между выделением сопрягающего иона с помощью мембранных электрогенераторов и поглощением сопрягающего иона, когда клетка выполняет полезную работу.
Рассмотренные нами варианты «мембранной» энергетической стратегии прокариотов представлены на рис. 69.
В случае мезофилов/нейтрофилов, существующих при умеренной температуре и одновременно с этим — при pH, близком к нейтральному, Рmf создается с помощью дыхательной цепи (рис. 69, А). За счет систем гомеостаза pH цитоплазмы поддерживается на уровне, близком к нейтральному, и внутренняя поверхность СМ несет отрицательный заряд. Рmfиспользуется для симпорта экзогенных субстратов и мембранного фосфорилирования АДФ. Такую стратегию использует, в частности, Е. соli.
Некоторые термофилы/нейтрофилы, существующие при высокой температуре, не способны поддерживать Рmf из-за высокой проницаемости СМ для протонов. Поэтому они запасают энергию в форме Smf с помощью Nа+-транслоцирующей АТФазы/АТФ-синтазы (рис. 69, Б). Такие бактерии решают проблему рН-гомеостаза путем незначительных энергетических затрат, и внутренняя поверхность СМ у них заряжена отрицательно. Smf используется для симпорта экзогенных веществ, в то время как фосфорилирование АДФ осуществляется на уровне субстрата. Такую стратегию использует, в частности, Caloramator fervidus (фила ВХIII Firmicutes).
В случае алкалифилов Рmf создается с помощью дыхательной цепи (рис. 69, В). Смещенный в сторону щелочных значений pH цитоплазмы поддерживается на гомеостатическом уровне с помощью Na+/Н+-антипортера, и внутренняя поверхность СМ имеет отрицательный заряд. Для унипорта экзогенных субстратов используется ∆![]() , а для мембранного фосфорилирования АДФ — Z∆pH. Такую стратегию использует, в частности, В. alcalophilus.
, а для мембранного фосфорилирования АДФ — Z∆pH. Такую стратегию использует, в частности, В. alcalophilus.
Рис. 69. Разные варианты «мембранной» энергетической стратегии прокариотов. А — мезофилы/нейтрофилы; Б — термофилы/нейтрофилы; В — алкалифилы; Г — ацидофилы; S — молекула растворимого субстрата; D — донор электронов для дыхательной цепи; А — акцептор электронов для дыхательной цепи.

Наконец, ацидофилы создают Рmf с помощью дыхательной цепи (рис. 69, Г). Путем антипорта внешних катионов К+ и внутренних протонов pH цитоплазмы поддерживается на уровне, близком к нейтральному. Одновременно с этим внутренняя поверхность СМ приобретает положительный заряд. Рmf используется для симпорта экзогенных субстратов и мембранного фосфорилирования АДФ. Такую стратегию применяет, в частности, умеренно термофильный археот Picrophilus ashimae (фила АII Euryarchaeota).
Рассмотрим основные типы мембранных биотрансформаторов. Напомним, что мембранные биотрансформаторы, создающие Рmf, называются первичными транспортерами. В свою очередь, транспортные системы, переносящие субстрат за счет использования Рmf, называются вторичными транспортерами (см. раздел 9.1).
У эукариотов первичные транспортеры содержатся в СМ, а также в мембранах, образующих цистерны ICM. Источником энергии для первичного транспорта у них служит гидролиз одного из двух фосфагенов — АТФ или ФФ. В первом случае реакция катализируется V-АТФазой, во втором случае — протонтранслоцирующей пирофосфатазой (ФФазой).
У прокариотов первичные транспортеры также содержатся в СМ и могут входить в состав ICM (при наличии). Однако по сравнению с эукариотами прокариоты имеют гораздо более широкий спектр биоэнергетических возможностей. Помимо АТФ-зависимого и ФФ-зависимого механизмов у них выявлены еще несколько типов мембранных биотрансформаторов (см. табл. 10).
Прежде чем перейти к примерам мембранных биотрансформаторов, отметим, что в их состав часто входят цитохромы и железосерные белки, простетические группы которых содержат соответственно геминовое и негеминовое железо.
Геминовое железо лигандируется атомами азота порфиринового кольца, а вспомогательными лигандами служат остатки His и Met. Негеминовое железо входит в состав [FenSn]-кластеров, которые лигандируются остатками Cys или одновременно остатками Cys и His. Аминокислотные лиганды всегда занимают консервативные позиции в полипептидной цепи апопротеина.
Цитохромы. Термин «цитохром» (греч. kitos — сосуд и chroma — краска; клеточный пигмент) предложил в конце XIX в. английский биохимик Дэвид Кейлин (D. Keilin).
В настоящее время цитохромами называют хромофилированные, т. е. имеющие окрашенную группировку окислительно-восстановительные ферменты. В зависимости от молекулярной структуры и локального окружения цитохромов их редокс- потенциал лежит в пределах от -200 до +600 мВ. При работе цитохромов изменяется редокс-состояние простетической группы — тетрапиррольного хелата железа, что связано с валентным переходом:
Fe3+ + е- ⇄ Fe2+.
Коричневатый цвет цитохромов обусловлен резонансной структурой хромофора, что позволяет ему интенсивно поглощать кванты длиной волны 600-750 нм.
Цитохромы традиционно обозначают по типу гема — a, b, с в порядке убывания длины волны «дальнего» максимума на разностном спектре поглощения (спектр окисленной формы вычитается из спектра восстановленной формы). Конкретные значения составляют 630 нм для цитохрома а2 (цитохром d в новой литературе), 600 нм для цитохрома а, 560 нм для цитохрома b и 555 нм для цитохрома с. Более современная классификация цитохромов основана не на этом формальном признаке, а учитывает специфику аминокислотной последовательности апопротеина, тип простетической группы и способ их взаимодействия.
Простетические группы цитохромов (рис. 70) представляют собой железопорфиноиды, или гемы (греч. aimatos — кровь). Цитохромы а содержат нековалентно связанный гем а, цитохромы b — нековалентно связанный протогем IX (гем 6), цитохромы с — связанный тиоэфирными связями с апопротеином протогем IX, цитохромы d — нековалентно связанный гем d или сирогем (греч. sideros — железный). Две последние простетические группы относятся к производным хлорина и имеют восстановленную двойную связь соответственно в пиррольных кольцах III и III/IV. В детализированной номенклатуре цитохромов используется надстрочный или подстрочный номер, отражающий хронологическую последовательность описания новых членов этого суперсемейства (цитохром c1, цитохром с1, цитохром c2 и т. д.), а также строчный цифровой индекс, который обозначает длину волны α-максимума в нанометрах (например, цитохром 6563).
Таблица 10. Мембранные биотрансформаторы, создающие Рmf
Тип биотрансформатора |
Локализация биотрансформатора |
Объект-представитель |
Протонофорные системы |
||
Бактериородопсин |
СМ |
Halobacterium salinarium (фила АII Euryarchaeota) |
Протеородопсин |
— |
Кластер SAR-86 (фила ВХII Proteobacteria) |
F0F-АТФаза/АТФ-синтаза |
CM, ICM |
Escherichia coli (фила ВХII Proteobacteria) |
Р-АТФаза |
CM |
Methanococcus jannaschii (фила All Euryarchaeota) |
ФФаза/ФФ-синтаза |
СМ, ICМ |
Rhodospirillum rubrum (фила BXII Proteobacteria) |
Протон-электронофорные системы |
||
НАДН-дегидрогеназа |
CM |
Paracoccus denitrificans — (фила BXII Proteobacteria) |
Цитохром bc1(b6f)-комплекс |
CM, ICM |
Synechococcus sp. (фила BX Cyanobacteria) |
Гетеродисульфид-редуктаза |
CM |
Methanosarcina barkeri (фила All Euryarchaeota) |
Цитохром с-оксидаза |
СМ, ICМ |
Rhodobacter sphaeroides (фила BXII Proteobacteria) |
Электронофорные системы |
||
Цитохром bd-оксидаза |
CM |
Azotobacter vinelandii (фила BXII Proteobacteria) |
Система экстрацито- плазматического окисления «простых» субстратов |
CM |
Achromatium oxaliferum (фила BXII Proteobacteria) |
Системы вторичного транспорта |
||
Лактатпермеаза |
CM |
Lactobacillus lactis (фила BXIII Firmicutes) |
Металлофосфат/Н+-симпортер |
CM |
Acinetobacter sp. (фила BXII Proteobacteria) |
Оксалат:формиат-антипортер |
CM |
Oxalobacter formigenes (фила BXII Proteobacteria) |
Обозначение: (-) — локализация неизвестна.
Рис. 70. Простетические группы цитохромов (гемы).
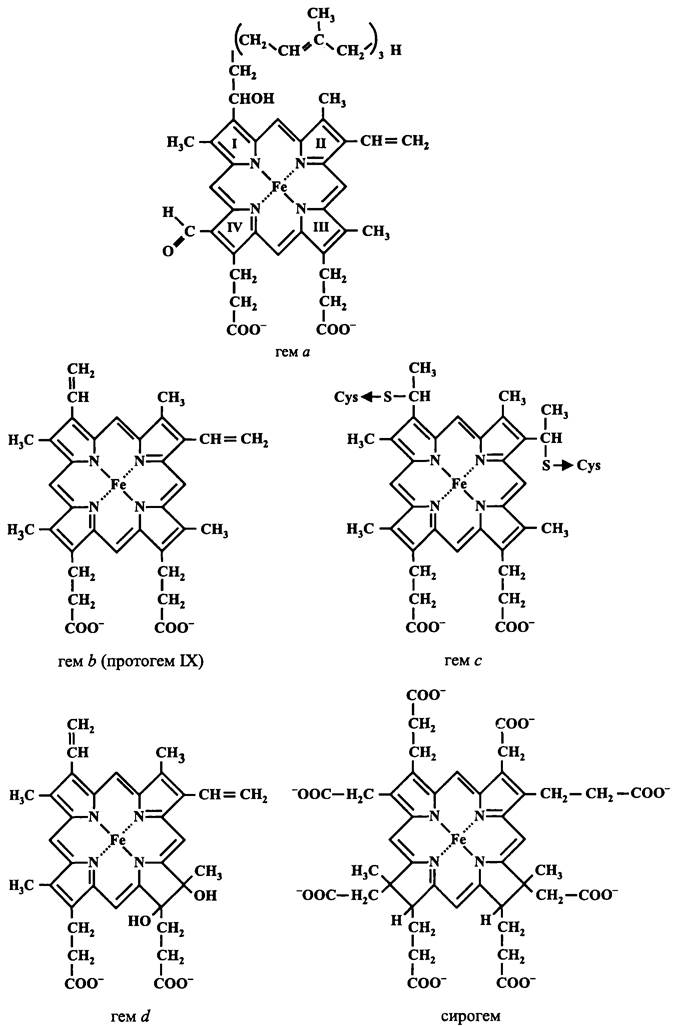
В зависимости от степени гидрофобности и характера распределения гидрофобных остатков по длине полипептидной цепи (профиля гидропатичности) цитохромы относят к мембранным и растворимым. Мембраносвязанные цитохромы, в свою очередь, можно подразделить на гидрофобные, амфипатические и периферические.
Железосерные белки. Эти содержащие [FеnSn]-кластеры редокс-белки являются молекулярными реликтами — они унаследованы современными организмами от анаэробных прокариотов, существовавших еще в докислородную эпоху. Хотя [FеnSn]-кластеры участвуют в важнейших окислительно-восстановительных превращениях, они инактивируются в аэробной среде, и поэтому имеются преимущественно у анаэробов. Для сохранения [FеnSn]-кластеров у аэробов создается редуцирующее микроокружение или используются разнообразные механизмы структурной, физиологической и иной защиты.
Железосерные белки функционально гетерогенны, однако их [FеnSn]-кластеры организованы по единому принципу. Они имеют тетраэдрическую симметрию лигандирования, или нековалентного связывания железа и относятся к четырем основным типам (рис. 71).
Рис. 71. Железосерные кластеры.

Простейшим типом является [Fe1S0]-кластер, в котором единственный атом железа координирован четырьмя остатками Cys. Основной тип — это моноромбический [Fе2S2]-кластер, на основе которого формируются триромбический [Fе3S4]-кластер и гексаромбический [Fе4S4]-кластер.
Большинство [FenSn]-кластеров лигандирует атомы неорганической серы, которую называют кислотолабильной, поскольку при протонной атаке она выщепляется в виде сульфида.
Подобно гемам, [FenSn]-кластеры служат одноэлектронными переносчиками между партнерами в донор-акцепторной паре, и их окислительно-восстановительные свойства также определяются белковым окружением.
Среди железосерных белков, входящих в состав мембранных биотрансформаторов, особое место занимают ферредоксины (лат. ferrum — железо и англ. reduction/oxidation — окисление/восстановление; окислительно-восстановительный железопротеин). Этот термин предложил в начале 1960-х годов Мортенсон (L. Е. Mortenson) для обозначения редокс-активного коричневого белка, выделенного из диазотрофной бактерии Clostridium pasteurianum.
Ферредоксины образуют суперсемейство кислых низкомолекулярных (6-13 кДа) растворимых белков, содержащих [FenSn]-кластеры. Собственно, ферредоксины обладают высоким по абсолютной величине электронегативным редокс-потенциалом (порядка -400 мВ), благодаря чему они могут использоваться в качестве сильного восстановителя или участвовать в окислении низкопотенциальных доноров электронов. Классификация ферредоксинов учитывает содержание в них негеминового
железа и кислотолабильной серы, величину спинового сигнала (g), окислительновосстановительные свойства, источник происхождения, особенность методики препаративного выделения и т. д.
В отдельную группу ферредоксинов входят высокопотенциальные железопротеины (англ. high-potential iron-sulfur protein; HiPIP), имеющие редокс-потенциал около +300 мВ. Они функционируют сопряженно с высокопотенциальными цитохромами с-типа и используются для окисления «слабых» (высокопотенциальных) доноров электронов. Например, HiPIPпурпурной серной бактерии Chromatium vinosum содержит [Fe4S4]-кластер и выступает в роли акцептора электронов для тиосульфат- окисляющего фермента.
Классификация мембранных биотрансформаторов, создающих Pmf. По принципу действия все мембранные биотрансформаторы, создающие Pmf, можно разбить на три группы:
— протонофорные системы (греч. phoros — несущий), которые играют роль протонного канала;
— протон-электронофорные системы, которые транслоцируют протоны и одновременно с этим переносят электроны от донора к акцептору, расположенному на той же самой или на противоположной стороне мембраны;
— электронофорные системы, переносящие электроны от донора к акцептору, которые расположены на разных сторонах мембраны; при этом протоны освобождаются на экзоплазматической поверхности и заимствуются из цитоплазмы, что приводит соответственно к закислению экзоплазмы и защелачиванию цитоплазмы.
Кроме того, некоторые бактерии способны создавать Pmf косвенным путем, используя для этого системы вторичного транспорта (см. раздел 9.1.1).
В сответствии с принципом действия такие мембранные биотрансформаторы можно разбить на две группы:
— экспортерные системы, которые симпортируют протоны и конечный продукт метаболизма;
— импортерно-экспортерные системы, которые антипортируют субстрат и продукт его цитоплазматического декарбоксилирования, что приводит к увеличению электрического потенциала на экзоплазматической поверхности мембраны за счет импорта отрицательного заряда или экспорта положительного заряда.
10.4.1. Протонофорная система: бактериородопсин
Данный светозависимый электрогенератор впервые обнаружили Дитер Эстер- хельт (D. Oesterhelt) и Вальтер Стекениус (W. Stoeckenius) в 1971 г. у экстремально галофильного археота Halobacterium salinarium. Подобно многим таксономическим названиям и терминам, относящимся к археям, термин «бактериородопсин» несет на себе отпечаток того времени, когда этих микроорганизмов считали бактериями. Наряду с позже описанным бактериальным протеородопсином бактериородопсин — наиболее рационально устроенный генератор Pmf.
Белковая часть, или бактериоопсин (27 кДа) состоит из 249 аминокислотных остатков и образует семь интегральных доменов А-G (рис. 72). Домен G содержит консервативный остаток Lys-216, с которым ковалентно связан каротиноид ретиналь (рис. 73). В результате взаимодействия бактериоопсина с ретиналем образуется фиолетовый хромопротеин — бактериородопсин.
Рис. 72. Бактериородопсин. A-G — интегральные спирали.
Рис. 73. Ретиналь. Показана ось trans-cis изомеризации в положении 13:14.
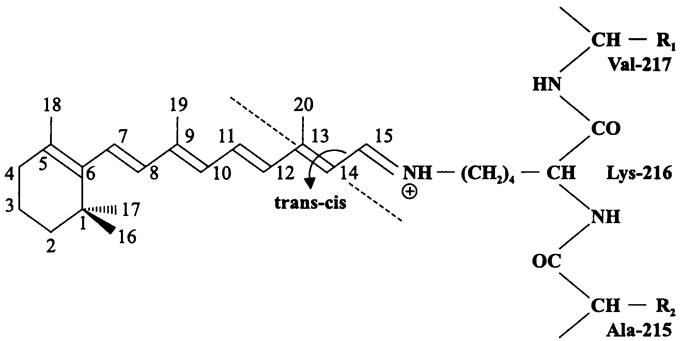
В молекуле бактериородопсина белок соединен с хромофором через карбоимин- ную группировку (-CH=N:-), или «шиффово основание» (англ. Schiff base), которое за счет двух неспаренных электронов при атоме азота может существовать в альтернативных формах — протонированной и депротонированной. При поглощении «зеленых» квантов (А=520 нм) бактериородопсин активируется и проходит через серию короткоживущих возбужденных состояний, которые образуют фотоцикл общей продолжительностью 2 • 10-2 с. Свободная энергия запасается путем изменения конформации полипептидной цепи, а также trans-cis изомеризации ретиналя в положении 13:14 (рис. 73).
В одном из промежуточных возбужденных состояний бактериородопсина шиффово основание депротонируется; протон передается по цепочке аминогрупп и карбоксильных групп на экзоплазматическую поверхность СМ. Протонированная форма шиффова основания регенерируется путем заимствования протона из цитоплазматического компартмента.
Многократное повторение фотоцикла обеспечивает транслокацию протонов в экзоплазму, в результате чего и создается Pmf.
10.4.2. Протонофорная система: протеородопсин
При проведении PCR-зондирования эуфотической зоны прибрежных вод и свободной акватории Атлантического и Тихого океанов в 2001 г. Веха (O.Bejä) обнаружил у «фантомных» бактерий ген нового ретинопротеина — протеородопсина. Обладающие им штаммы относятся к кластеру SAR86, который входит в класс «Аlphaproteobacteria» (фила ВХIIProteobacteria).
Бактериальный ген протеородопсина высоко гомологичен гену археотного бактериородопсина. Путем трансформации он был введен в хромосому Е. coli, и продукт его экспрессии оказался сходным с археотным бактериородопсином по третичной структуре, локализации хромофора, а также временным параметрам фото цикла. Поскольку бактерии, содержащие протеородопсин, относятся к некультивируемым формам, неизвестно, следует ли рассматривать их как фотогетеротрофов или как фотоавтотрофов с уже известным или новым путем ассимиляции неорганического углерода. Неясно также, являются они истинными фототрофами или это квази- фототрофы (см. раздел 12.7.6.2).
10.4.3. Протонофорная система: бактериальная F0F1-АТФаза/АТФ-синтаза и археотная A0A1-АТФаза/ АТФ-синтаза
Бактериальная F0F1-АТФаза/АТФ-синтаза (от англ. fraction) имеется у всех бактерий, а также у произошедших от них митохондрий и пластид. У хемотрофных бактерий этот фермент находится в СМ, а у большинства фототрофных бактерий он входит в состав ICM (в митохондриях и пластидах в состав гомологов ICM — крист и тилакоидов).
Археотная А0A1-АТФаза/АТФ-синтаза (от лат. Archaea) имеется у всех архей, за исключением рода Thermoplasma. Поскольку археи не обладают ICM, единственным местом локализации этого фермента является СМ.
Действие бактериальных F0F1-АТФаз/АТФ-синтаз и археотных A0A1- АТФаз/АТФ-синтаз обратимо: они преобразуют свободную энергию Pmf в свободную энергию АТФ или, наоборот, поддерживают Pmf за счет энергии гидролиза АТФ.
В физиологических условиях F0F1-АТФазы/АТФ-синтазы и A0A1- АТФазы/АТФ-синтазы преимущественно выполняют роль АТФ-синтаз. В связи с этим отметим, что, хотя мембранное фосфорилирование и не зависит от способа энергизации мембраны, реакцию, которая сопутствует фототрофии и катализируется АТФ-синтазой, или фактором сопряжения (англ. coupling factor, CF) упорно называют «фотосинтетическим фосфорилированием»; в свою очередь, «окислительным фосфорилированием» называют реакцию, которая сопутствует хемотрофии.
В дальнейшем мы увидим, что помимо протонофорных F0F1-АТФаз/АТФ- синтаз способностью обратимо трансформировать энергию градиента катионов (Imf) в энергию АТФ обладают бактериальные Na+-транслоцирующие F0F1- АТФазы/АТФ-синтазы (см. раздел 10.4.10).
У эукариотов существует другая филогенетическая группа двухдоменных АТФаз. Это «ваку- олярные» V0V1-АТФазы (от англ. vacuole). В их состав входят не менее двенадцати субъединиц А3 : В3 : С : D : Е : F : Gy: Hz: а : d : е : с6. Вакуолярные АТФазы связаны с мембранами, окружающими лизосомы, хромаффиновые гранулы и клатриновые пузырьки. В виде исключения, они содержатся в СМ остеокластов позвоночных животных.
Во всех перечисленных случаях фермент обладает однонаправленным действием и за счет гидролиза АТФ создает Pmf, которая используется для транспорта, сигналинга и поглощения питательных субстратов.
Мембранные АТФазы у представителей трех филогенетических доменов сходны по архитектуре и состоят из трех частей: интегрального ионного канала Fo/Ao/Vo, соединительного стебелька и периферической каталитической головки F1/A1/V1.
Бактериальная F0F1-АТФаза/АТФ-синтаза. Данная протонофорная система представляет собой «осмоэнзим», т. е. фермент, преобразующий химическую энергию в осмотическую. Он либо синтезирует АТФ благодаря использованию Pmf либо создает Pmf за счет гидролиза АТФ.
Бактериальная FoFi-АТФаза/АТФ-синтаза, изученная в основном на примере Е. coli, состоит из двух доменов — интегрального (F0) и периферического (F1). Она имеет суммарную молекулярную массу ~500 кДа и построена из восьми типов субъединиц α3β3: y: δ : ε: : а : b2 : c9-12. По сложности строения она уступает митохондриальной АТФ-синтазе (>11 субъединиц).
Интегральный домен F0 (150 кДа) состоит из трех типов субъединиц в соотношении 1:2: (9-12):
— а (30 кДа; ген atpB);
— b (17 кДа; ген atpF);
— с (8,1 кДа; ген atpE; из-за очень высокой гидрофобности названа «протеоли- пидом»; служит мишенью для ингибитора дициклогексил-карбодиимида, DCCD).
Периферический домен F1(350 кДа) состоит из пяти субъединиц в соотношении 3: 3:1:1:1:
— α (53-57 кДа; ген atpA);
— β (50-54 кДа; ген atpD);
— y (30-38 кДа; ген atpG);
— δ (15-21 кДа; ген atpH; гомолог митохондриальной субъединицы OSCP, или фактора чувствительности к олигомицину);
— ε (6-15 кДа; ген atpC).
В интактном комплексе F0F1-АТФазы/АТФ-синтазы морфологически различаются три части — цитоплазматическая головка диаметром ~90À, соединительный
стебелек (диаметр ~50А, длина ~45А) и мембранное основание. В настоящее время показано, что стебелек состоит из двух частей: центральной части и внешней части, образованной b2-субъединицами (рис. 74).
Рис. 74- АТФаза/АТФ-синтаза. Греческими и латинскими буквами обозначены белковые субъединицы. Снизу указано направление вращения ротора при гидролизе АТФ.

Интегральный домен F0 находится в мембране и состоит из диска, образованного с-субъединицами; каждая из них представляет собой α-спиральную шпильку. Мебранная α-субъединица исключительно гидрофобна и состоит из пяти интегральных α-спиралей. Димер b-субъединиц взаимодействует с доменом F1 при посредстве δ-субъединицы, локализованной в верхней части цитоплазматической головки снаружи от тримера αβ-субъединиц (рис. 74).
Периферический домен F1 имеет форму неправильного сфероида диаметром 9-9,5 нм и образован гексамером чередующихся α- и β-субъединиц. Сквозь его внутреннюю полость проходит асимметричная y-субъединица, состоящая из двух взаимно перевитых α-спиралей (рис. 74). Интегральный домен F0 выполняет функцию канала, который пропускает протоны по градиенту их концентрации.
Периферический домен F1 содержит сайты связывания АТФ, АДФ и неорганического фосфата (числом шесть), которые расположены на субъединицах обоего типа. Каталитические центры, осуществляющие образование или гидролиз АТФ (числом три), находятся только на β-субъединицах. Домен F1 относительно слабо связан с доменом F0, легко диссоциирует от него в бесклеточных препаратах и тогда становится растворимой АТФазой. Напротив, в клетке связь между ними прочна. В этом отношении бактериальный фермент сходен с археотным и отличается от эукариотного, где домены V1 и V0 способны обратимо диссоциировать друг от друга, что лежит в основе регуляции его активности.
В настоящее время блестяще подтвердилась гипотеза Питера Митчела о том, что двухдоменная АТФаза/АТФ-синтаза представляет собой ротационное устройство, преобразующее энергию Рmf или энергию гидролиза АТФ в механическую энергию. Другим примером такого биологического мотора служит прокариотный жгутик (см. I том учебника). Однако он использует в качестве источника энергии только Рmf или Smf и не обладает обратимым действием.
Роторная часть домена F0 имеет состав c9-12yε и представлена диском, состоящим из девятидвенадцати идентичных с-субъединиц, от которого отходит ось, образованная y-субъединицей и ε - субъединицей. Функцию статора выполняют субъединицы аb2δα6β6 (рис. 74).
При гидролизе одной молекулы АТФ происходит конформационное изменение αβ-субъединиц, которое создает торзионное усилие, действующее на y-субъединицу, и она проворачивается внутри головки F1 на 120°, увлекая за собой ε-субъединицу вместе с диском с9-12. Это сопровождается депротонированием четырех с-субъединиц, находящихся напротив а-субъединицы. Как показали исследования на точечных мутантах, ключевую роль в транслокации протонов выполняют остатки Аrg-210, Glu-219 и His-245 а-субъединицы.
Протонный канал, или «пора» находится на границе раздела между а-субъединицей и с-диском. Через него протоны переходят в экзоплазматический компартмент, в результате чего создается Рmf. Таким образом, сопряжение между гидролизом или синтезом АТФ и транслокацией протонов через мембрану достигается в результате взаимодействия между диском и а-субъединицей домена F0.
Механизм действия АТФ-синтазы изучен в основном на митохондриях. По-видимому, он такой же и для прокариотных АТФаз/АТФ-синтаз. Установлено, что при гидролизе АТФ y-субъединица вместе с ε-субъединицей вращаются против часовой стрелки (если смотреть изнутри клетки). За один полный оборот y-субъединицы гидролизуются три молекулы АТФ, причем к. п. д. процесса преобразования химической энергии в механическую приближается к 100%. При синтезе АТФ y-субъединица вращается в обратном направлении. Движущей силой служит Рmf, т. е. поворот y-субъединицы обеспечивается транслокацией протонов через Го-домен АТФ-синтазы.
Археотная А0А1-АТФаза/АТФ-синтаза. Этот осмоэнзим устроен сложнее бактериального и содержит субъединицы десяти типов А3: В3: С: D: Е: F: G: Н: I: Кх.
Археотная А0А1-АТФаза/АТФ-синтаза, изученная в основном на примерах Мethanosarcina mazei и Sulfolobus acidocaldarius, состоит из двух доменов — интегрального (А0) и периферического (А1).
Интегральный домен состоит из IК-субъединиц, причем 1-субъединица является эквивалентом а-субъединицы бактерий. К-субъединица (ее стехиометрическое соотношение с остальными неизвестно) эквивалентна с-субъединице бактерий и образует диск.
Периферический домен состоит из субъединиц АВСDF (65, 51, 41, 24 и 11 кДа). Диаметр комплекса А2В3СDF составляет ~90А. Подобно бактериальным αβ-субъединицам, АВ-субъединицы выполняют каталитическую функцию.
СDЕFG-субъединицы образуют соединительный стебелек (диаметр 60А, длина ~85А).
Эволюция мембранных АТФаз. Аминокислотные последовательности каталитических субъединиц, входящих в состав прокариотных АТФаз/АТФ-синтаз (αβ и АВ) и эукариотных АТФаз (АВ), гомологичны более чем на 25%, что свидетельствует о происхождении всех двухдоменных АТФаз от общего прототипа.
Субъединицы стебелька у бактерий (yδεb2), архей (СDЕFG) и эукариотов (СDЕFGН) различаются более существенно, что говорит о глубокой дивергенции мембранных АТФаз у представителей трех эволюционных доменов, хотя в целом, судя по набору субъединиц и их первичной структуре, археотная мембранная АТФаза эволюционно ближе к эукариотному ферменту, чем к бактериальному.
10.4.4. Протонофорная система: Р-АТФаза
Ферменты, относящиеся к данному суперсемейству, образуют фосфорилирован- ный промежуточный продукт, или интермедиат. Этим и объясняется их название (от англ. phosphorylated). Они специфически ингибируются ортованадатом — стерическим аналогом ортофосфата.
Протонофорные Р-АТФазы, входящие в состав СМ, широко распространены у эукариотов. Они действуют только в направлении гидролиза АТФ.
Эукариотные Р-АТФазы содержат главную каталитическую субъединицу (>100 кДа), в которой насчитываются до десяти интегральных доменов, и одна-две вспомогательные некаталитические субъединицы. Большая периферическая петля, расположенная в главной субъединице между доменами IV и V, содержит активный центр для гидролиза АТФ (рис. 75). В зависимости от того, фосфорилирован или не фосфорилирован консервативный сайт Asp в составе этой петли, фермент может находиться в альтернативных конформационных состояниях — латентном нефосфорилированном состоянии E1 (от англ. enzyme) и активированном фосфорилированном состоянии Е2.
Рис. 75. Р-АТФаза. I-VIII — интегральные спирали; темными кружками обозначены сайты фосфорилирования и гидролиза АТФ.
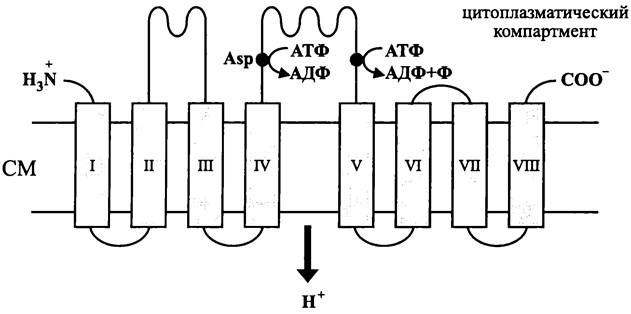
У бактерий представители суперсемейства Р-АТФаз также входят в состав СМ. Однако вместо того, чтобы обеспечивать АТФ-зависимый экспорт протонов, они переносят катионы Nа+/К+, Са2+, Mg2+ или Сu2+.
В полностью секвенированном геноме метаногенного археота Methanococcus jannaschii присутствует нуклеотидная последовательность, гомологичная консервативному участку «эукариотного» гена протонтранслоцирующей Р-АТФазы, однако еще неизвестно, какова физиологическая функция возможного продукта ее экспрессии.
10.4.5. Протонофорная система: ФФаза/ФФ-синтаза
Протонтранслоцирующая «неорганическая» пирофосфатаза имеется в составе эндомембран у ряда простейших и некоторых Chlorophyceae, а также в тонопласте высших растений, где она используется наряду с V-АТФазой для закисления этого компартмента.
У прокариотов протонтранслоцирующая ФФаза встречается довольно редко. В настоящее время она обнаружена только у фототрофной бактерии Rhodospirillum rubrum и хемотрофных бактерий Syntrophus gentianae и Thermotoga maritima, а также у некоторых представителей метаногенных и термоацидофильных архей.
Установлено, что у R. rubrum ФФаза входит в состав ICM. Данный фермент исключительно гидрофобен, что затрудняет его выделение с целью биохимического анализа. Показано, что ФФаза обладает как пирофосфатазной, так и пирофосфат- синтазной активностью, т. е. это единственный пример функционального аналога F0F1-АТФазы/АТФ-синтазы.
Согласно результатам секвенирования гена ФФазы/ФФ-синтазы, а также по данным анализа мембранных препаратов R. rubrum, данный фермент существует в виде гомодимера. Мономер (67-72 кДа) содержит 660-700 аминокислотных остатков и состоит из шестнадцати интегральных доменов. Полярность расположения ФФазы/ФФ-синтазы в мембране соответствует таковой F0F1-АТФазы/АТФ-синтазы, т. е. каталитическая субъединица ориентирована в сторону цитоплазмы. Так же, как и в случае АТФ, стехиометрия хемиосмотического процесса составляет 0,5-2 Н+ на молекулу фосфагена.
10.4.6. Протон-электронофорная система: цитохром bc1(b6f)-комплекс
Это важнейший и наиболее распространенный электрогенератор, который играет роль центрального звена электрон-транспортных цепей. Им обладают все фототрофы, а также большинство хемотрофов. В виде исключения цитохром bc1(b6f)- комплекс отсутствует у некоторых членов семейства Lactobacillaceae, а также у «автотрофных» (не использующих метанол и ацетат) метаногенных архей.
В состав цитохром bс1(b6f)-комплекса входят два цитохрома — цитохром b-типа и цитохром с-типа, а также железосерный белок Риске. Поэтому точное название этого комплекса— «железосерный белок Риске/цитохром bс1(b6f)-комплекс» (англ. Rieske iron-sulfur protein/cytochrome bc-complex, RBC). Применительно к цианобактериям и пластидам цитохром с называют цитохромом а (от лат. frons — листва).
У цианобактерий цитохром b6f-комплекс состоит из четырех субъединиц (рис. 76):
— белка Риске (20 кДа; ген petC):
— цитохрома 6563 (24 кДа; ген petB);
— цитохрома 1557 (32 кДа; ген petА)]
— субъединицы IV (17 кДа; ген petD).
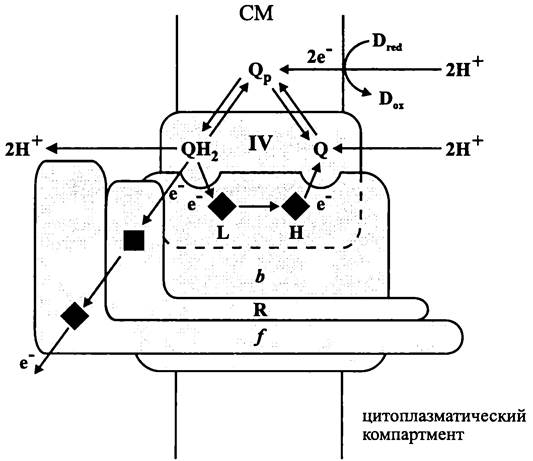
Рис. 76. Цитохром bс1 (b6f)-комплекс (по: Пиневич, Аверина, 2002). R, f и IV — белковые субъединицы; L и Н — геминовые группы цитохрома b; темный квадрат — [Fe4S4]-кластер белка Риске; темный ромб — геминовая группа цитохрома f; Q — хинон; Qp — хинонный пул; D — растворимый донор электрона.
В хромосоме цианобактерии Nostoc sp. гены, кодирующие субъединицы цитохром b6f-комплекса, организованы в опероны petСА и petBD. У бактерий цитохром 6 кодируется генами-ортологами (гомологичные гены у разных организмов), в то время как у архей это могут быть гены-паралоги (гомологичные гены в составе одного и того же генома). Хотя в большинстве случаев гены цитохром bс1(b6f)-комплекса экспрессируются конститутивно, в некоторых физиологических условиях он не функционирует, в частности в отсутствии кислорода у облигатно аэробных бактерий.
Результаты сравнения аминокислотной последовательности апоцитохрома b, а также белка Риске для филогенетически удаленных объектов свидетельствуют об очень древнем происхождении этого генератора Pmf. Скорее всего, он входил в состав биоэнергетической системы прогенота — общего предка доменов Bacteria, Агchaea и Еuсаrуа (см. I том учебника). В отличие от прокариотов эукариоты в ходе эволюции не сохранили этот генератор Pmf, и поэтому они используют мембранные системы ассимиляции энергии, полученные «в приданное» прокариотных эндосимбионтов — митохондрий и пластид.
Железосерный белок Риске и цитохром b-типа обладают консервативной структурой, что также характерно для цитохрома с1 большинства прокариотов. Однако известны исключения — цитохром / цианобактерий не гомологичен цитохрому с1. В свою очередь, гелиобактерия Heliobacillus mobilis обладает нестандартным цитохром bс-комплексом, в состав которого входит дигемовый цитохром с. Наконец, у зеленой серной бактерии Chlorobium limicola в этом комплексе вообще отсутствует цитохром с.
Цитохром bс1(b6f)-комплекс выполняет роль хинол: цитохром с-оксидоредуктазы, т. е. он передает электроны от восстановленного хинона периферическому, или «растворимому» цитохрому с.
Механизм работы цитохром bс1(b6f)-комплекса одинаков у бактерий, архей, митохондрий и пластид — в основе лежит способность хинонов одновременно выполнять функцию электронофора (переносчика электронов) и протонофора (переносчика протонов). Хиноны, входящие в состав хинонного пула, числом до 50 молекул, не только диффундируют в плоскости мембраны, но и «кувыркаются», переходя из одного пол у мембранного листка в другой.
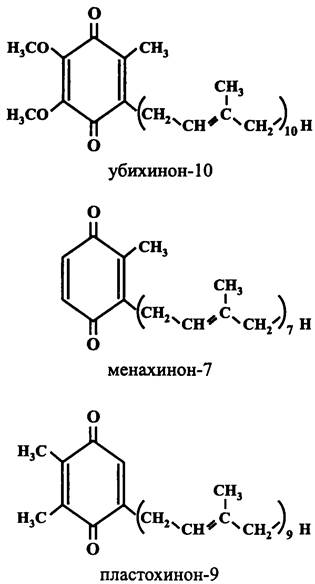
Цитохром bс1(b6f)-комплекс аэробных бактерий и митохондрий окисляет восстановленную форму убихинона — убихинол (англ. ubiquinol, UQH2), цианобактерий и пластид — пластохинол (англ. рlаstoquinol, РQH2), анаэробных организмов — менахинол (англ. menaquinol, MQH2) (рис. 77). Акцептором электронов служит растворимый цитохром с или, в случае цианобактерий и пластид, медьсодержащий белок пластоцианин. Одновременно с переносом электронов от одного компонента цитохром bc1(b6f)-комплекса к другому восстановленный хинон транслоцирует протоны из цитоплазмы в экзоплазму в стехиометрическом соотношении 2Н+/е-.
Рис. 77. Хиноны, взаимодействующие с цитохром bс1(b6f)-комплексом.
В составе цитохром bс1(b6f)-комплексов имеются четыре простетические группы, переносящие электроны. Две из них принадлежат соответственно цитохрому c1(f) и белку Риске и имеют высокий редокс-потенциал (> 0 мВ). Две другие входят в состав дигемового цитохрома b и имеют низкий редокс-потенциал (<0 мВ).
Гипотетический механизм работы цитохром bс1 (b6f)-комплекса, или «Q-цикл» (от англ. quinone) был предложен Питером Митчелом в 1975-1976 гг.; в настоящее время он полностью доказан на экспериментальном материале.
В ходе Q-цикла на противоположных концах внутримембранной частицы цитохром bс1(b6f)-комплекса, преимущественно на молекуле апоцитохрома b, расположены два сайта для связывания хинона. Один из них — Qox (от англ. oxidation), или Qp (от англ. positive) находится близко к экзоплазматической поверхности мембраны. В этом сайте восстановленный хинон окисляется (QH2 —> Q + 2е- + 2Н+). Другой сайт для связывания хинона — Qred (от англ. reduction), или Qn (от англ. negative) находится близко к цитоплазматической поверхности мембраны. В нем окисленный хинон восстанавливается (Q + 2е- + 2Н+ —> QH2).
Восстановленный хинон (QH2) связывается с Qox-сайтом и теряет один за другим два электрона (рис. 76). Первый из них передается [Fе2S2]-кластеру белка Риске.
Белок Риске представляет собой интегральный железосерный белок, названный в честь американского исследователя (J. S. Rieske), который впервые обнаружил его в митохондриях кардиомиоцитов быка. Он характеризуется высоким значением ре- докс-потенциала (от +280 до +320 мВ). Лигандами для простетической [Fe2S2]-группы служат остатки His и Cys, что отличает белок Риске от ферредоксинов, у которых лигандирование [FеnSn]-кластеров осуществляется только через остатки Cys.
От белка Риске электрон передается гему цитохрома с1(f), имеющему высокий редокс-потенциал (от +318 до +365 мВ). Тот, в свою очередь, восстанавливает высокопотенциальный эпимембранный акцептор — цитохром с или пластоцианин (+400 мВ). В результате первого акта окисления хинон превращается в более низкопотенциальный семихинон (QH-), который восстанавливает расположенный по соседству с Qox-сайтом низкопотенциальный (-150 мВ) гем цитохрома b — bL (от англ. low). Последний передает электрон высокопотенциальному (-45 мВ) гему bH (от англ. high), находящемуся на противоположной стороне мембраны поблизости от Qred- сайта. Наконец, гем bH восстанавливает окисленный хинон (Q) в семихинон (QH-), который временно остается в Qred-сайте.
За два оборота Q-цикла семихинон превращается в полностью восстановленный хинон (QH2), который проявляет низкое сродство к Qred-сайту и переходит в липидную фазу мембраны, где он вливается в смешанный пул окисленных и восстановленных молекул хинона.
Таким образом, хинон полностью восстанавливается за два полных оборота Q- цикла. За это время две молекулы QH2 окисляются, два электрона передаются растворимому низкопотенциальному акцептору (цитохрому с или пластоцианину) и четыре протона транслоцируются в экзоплазматическое пространство. Расход QH2 пополняется за счет двухэлектронного восстановления молекулы Q, которая извлекается из общего хинонного пула.
При фототрофии QH2 регенерируется неферментативным способом. Это происходит в акцепторном участке фотосинтетического реакционного центра, и электроны спонтанно передаются от молекул хлорофилла, активированных видимым светом (см. раздел 12.7.2). При хемотрофии QH2 регенерируется в результате ферментативных дегидрогеназных реакций, и электроны передаются от низкопотенциальных доноров — экзогенных химических субстратов или эндогенных запасных веществ.
10.4.7. Электронофорные системы: экстрацитоплазматическое окисление «простых» субстратов
Генераторы Рmf, относящиеся к данному типу, используются в разных вариантах хемолитотрофии у бактерий и архей. Они действуют сходным образом (рис. 78). При окислении субстрата, находящегося в периплазматическом или экзоплазматическом пространстве, электроны переносятся к акцептору, расположенному на внутренней поверхности СМ, которая в результате этого становится более электроотрицательной. Одновременно с этим экзоплазматический компартмент обогащается протонами. Таким образом, создаются оба компонента электрохимического потенциала — ![]()
Рис. 78. Генератор Рmf, действующий по принципу экстрацитоплазматического окисления «простых» субстратов. D — растворимый донор электронов; А — растворимый акцептор электронов.

Окисление субстрата называется «экстрацитоплазматическим», если оно происходит снаружи цитоплазматического компартмента, т. е. в периплазме или в экзоплазме (у грамотрицательных бактерий) или в экзоплазме (у грамположительных бактерий и архей). В свою очередь, ферменты или мультиферментные системы называются экстрацитоплазматическими, если они растворены в периплазме или экзоплазме, а также если они связаны с внешней поверхностью СМ.
Под «простыми» субстратами подразумеваются простые вещества (например, S0 или Н2), катионы металлов переходной валентности (например, Fe2+ или Мn2+), многоатомные неорганические катионы (например, NH4+), неорганические оксиды (например, СО), неорганические кислотные остатки (например, S2- или S2O32-), а также метан (СН4) и его окисленные производные (например, СН3ОН).
Экстрацитоплазматическое окисление простых субстратов осуществляется с помощью интегральных, периферических или секретируемых дегидрогеназ.
В зависимости от происхождения экзоплазматических протонов можно выделить три типа реакций, связанных с экстрацитоплазматическим окислением простых субстратов.
В первом случае источником протонов служит сам окисляемый субстрат:
DH2 —> D + 2Н++ 2е-,
где D — донор электронов (от англ. donor).
Пример такой реакции — окисление сульфида пурпурной серной бактерией Thiocapsa roseopersicina или бесцветной серной бактерией Achromatium oxaliferum (см. раздел 11.4.4.6):
Н2S —> S0 + 2Н+ + 2е-.
Во втором случае субстрат служит только источником электронов, а источником протонов становится молекула воды:
D + Н2O —> DО + 2Н+ + 2е-.
Подобную реакцию осуществляют бактерии, окисляющие нитрит, в частности Nitrobacter winogradskyi (см. раздел 11.4.4.5):
NO2- + H2O —> NO3- + 2Н+ + 2е-.
В третьем случае энзиматическая реакция окисления простого субстрата может вообще не приводить к высвобождению протонов, как это происходит у тионовой бактерии Acidithiobacillus ferrooxidans (см. раздел 11.4.4.7):
Fе2+ —> Fе3+ + е-.
Тогда протоны являются продуктом абиотической реакции гидролиза окисного железа:
Fе3+ + ЗН2O —> Fе (ОН)3 + 3Н+.
Электроны от субстрата векторно переносятся через СМ при помощи металсодержащих редокс-центров.
Терминальный акцептор электронов (в том числе, молекулярный кислород) расположен на внутренней стороне СМ. Он восстанавливается редуктазой (в частности кислородредуктазой, или оксидазой) и одновременно с этим протонируется:
А + 2е- + 2Н+ —> АН2,
1/2O2 + 2е- + 2Н+ —> Н2O.
У пурпурной бактерии Rhodobacter capsulatus роль акцептора электронов в анаэробных условиях выполняют свободные протоны в цитоплазме:
2Н+ + 2е- —> Н2.
Хотя во всех описанных примерах через мембрану переносятся только электроны, неравновесное осмотическое распределение протонов достигается за счет обогащения ими экзоплазматического компартмента.
Особый случай экстрацитоплазматического окисления простых субстратов — это ферментативное окисление воды. Оно осуществляется кислородвыделяющим комплексом оксигенных фототрофов, который расположен на экзоплазматической поверхности тилакоида и катализирует реакцию (см. раздел 12.7.4):
Н2O —> 1/2O2 + 2Н+ + 2е-.
Реакция окисления молекулы воды не приносит свободной энергии, и чтобы она сделалась экзергоничной (∆G°′ <0), необходимо использовать энергию четырех квантов красного света (см. раздел 12.7.4). Хотя вода не является хемолитотрофным энергоносителем, освобождающиеся при ее окислении протоны создают электрохимический градиент. Из этого следует, что оксигенную фототрофию можно одновременно рассматривать и как «водяную» хемолитотрофию.
Протоны (в данном случае главный компонент Рmf — это ∆рН) накапливаются внутри тила- коида в результате действия двух электрогенераторов:
— цитохром b6f-комплекса (со стехиометрией 2Н+/е-);
— кислородвыделяющего комплекса (со стехиометрией Н+/е-).
Таким образом, при оксигенной фототрофии окисление воды в полости тилакоида обеспечивает ~30% суммарной ассимилированной энергии.
10.4.8. Экспортерная система: симпорт Н+ и конечного продукта
Эндогенные продукты метаболизма могут выходить из клетки путем пассивной диффузии только по градиенту концентрации и только в том случае, если они обладают липофильными свойствами.
В свою очередь, на пути свободной диффузии эндогенных гидрофильных молекул стоит барьер СМ, и поэтому для их экскреции необходимы переносчики-пермеазы. Их роль могут выполнять системы активного импорта (см. рис. 64), которые начинают работать в обратном направлении, если накопление субстрата внутри клетки делает экспорт термодинамически «выгодным».
При импорте субстрата против его концентрационного градиента симпортер использует в качестве движущей силы градиент Н+, направленный внутрь клетки (см. раздел 9.1.1). В свою очередь, при экспорте эндогенного продукта его концентрационный градиент направлен наружу. Это служит источником энергии для переноса катионов Н+ против их концентрационного градиента, в результате чего создается ∆рН. В такой ситуации![]() возникает только если транслоцируется суммарный положительный заряд, т. е. когда экспорт моновалентного аниона сопровождается транслокацией двух протонов.
возникает только если транслоцируется суммарный положительный заряд, т. е. когда экспорт моновалентного аниона сопровождается транслокацией двух протонов.
Описанный нами механизм создания Pmf используют некоторые представители ферментирующих бактерий (помимо основного для них способа — за счет гидролиза АТФ при помощи F0F1-АТФазы).
В качестве примеров можно назвать экспорт лактата у молочнокислой бактерии Lactobacillus lactis, ацетата — у ацетогенной бактерии Syntrophomonas wolfei и сукцината — у возбудителя «смешанных» брожений Е. coli.
Эндогенный лактат при низких значениях цитоплазматического pH существует в недиссоциированной форме и выходит из клетки посредством пассивной диффузии. При значениях pH, близких к нейтральному, лактат диссоциирован и может преодолеть барьер СМ только путем активного переноса. В результате симпорта лактата вместе с двумя протонами создаются оба компонента Pmf — осмотический и электрический. По некоторым данным, молочнокислые бактерии обеспечивают таким путем до 30% энергии Pmf.
К рассмотренному примеру логически примыкает механизм образования Pmf, обнаруженный в середине 1990-х годов у Acinetobacter sp. (класс «Gammaproteobacteria»). Правда, в данном случае экспортируется не конечный продукт метаболизма, а запасное вещество. При избытке питательных субстратов эта бактерия накапливает большое количество неорганических полифосфатов, отрицательный заряд которых нейтрализуется катионами Са2+ и Мg2+ (см. I том учебника). При деполимеризации полифосфата образуется электронейтральная молекула металлофосфата МФ (МНРО4):
Мn(Ф)n + Н2O —> Мn-1(Ф)n-1 + МФ.
Направленный наружу химический градиент «мономерного» металлофосфата, эквивалентный 100 мВ, служит движущей силой для симпорта МФ и цитоплазматического протона. Аналогичный механизм существует и у других бактерий, например, Е. соli.
10.4.9. Импортерно-экспортерная система: антипорт субстрата и продукта его декарбоксилирования
Свободную энергию реакции декарбоксилирования органических кислот нельзя ассимилировать в форме Рmf (но можно ассимилировать в форме Smf; см. раздел 10.4.10). Тем не менее, энергетический выигрыш можно получить косвенным путем — благодаря распределению между разными компартментами субстрата и продукта реакции.
Механизм создания Рmf таков: дикарбоновая кислота с помощью активного транспортера поступает в цитоплазму, где она подвергается декарбоксилированию по одной из своих карбоксильных групп. Продукт реакции — монокарбоновая кислота — экспортируется тем же самым переносчиком, который в данном случае выступает в роли электрогенного антипортера. В результате неравноценного обмена заряда (на один импортируемый двухвалентный анион приходится один экспортируемый одновалентный анион) наружная поверхность СМ становится более электропозитивной.
В качестве примера можно привести процесс декарбоксилирования оксалата в формиат, с помощью которого получает энергию Оxalobacter formigenes (рис. 79, А). При помощи оксалат2-: формиат1--антипортера ОхIТ оксалат доставляется в цитоплазму. Там путем ацилтиоэфирного обмена, который катализируется растворимой ацилтиотрансферазой, оксалат превращается в оксалил-СоА, причем донором СоА в этой реакции служит формил-СоА.
Рис. 79. Генератор Рmf, действующий по принципу антипорта субстрата и продукта декарбоксилирования. А — декарбоксилирование оксалата в формиат; Б — малата в лактат; В — аспартата в аланин; Г — гистидина в гистамин; 1 — ацилтиотрансфераза; 2 — оксалил-СоА- декарбоксилаза; 3 — малатдекарбоксилаза («малик-энзим»); 4 — аспартатдекарбоксилаза: 5 — гистидиндекарбоксилаза.
Растворимая декарбоксилаза молекулярной массой 260 кДа использует в качестве кофермента тиаминпирофосфат, или витамин В1 (см. рис. 89) и декарбокси- лирует оксалил-СоА в формил-СоА. В свою очередь, под воздействием ацилтио- трансферазы формил-СоА превращается в формиат. Наконец, в результате антипорта одновалентного аниона формиата (НСОО-) и двухвалентного аниона оксалата (-ООС-СОО-) на наружной поверхности СМ создается более высокий электрический потенциал.
Поскольку равновесие экзергонической реакции декарбоксилирования оксалата сильно смещено в сторону образования конечного продукта, а константа равновесия ацилтиотрансферазной реакции равна единице, внутриклеточная концентрация формиата на целых три порядка превышает внутриклеточную концентрацию оксалата. В итоге возникают высокие встречные химические градиенты оксалата и формиата, что служит источником энергии для создания![]() Кроме того, при де- карбоксилировании происходит гетеролитический распад молекулы оксалата (т. е. электронная пара остается с образующимся формиатом). При спонтанном протонировании формиата протоны заимствуются из цитоплазмы, которая в результате этого защелачивается. Таким образом, помимо
Кроме того, при де- карбоксилировании происходит гетеролитический распад молекулы оксалата (т. е. электронная пара остается с образующимся формиатом). При спонтанном протонировании формиата протоны заимствуются из цитоплазмы, которая в результате этого защелачивается. Таким образом, помимо![]() возникает еще и АрН.
возникает еще и АрН.
Аналогичного результата добиваются молочнокислые бактерии Lactococcus lactis в ходе яблочно-молочнокислого «брожения», когда двухвалентный анион малата
(-OOC—CH2—CHOH—COO-) переносится антипортером MalP совместно с продуктом своего цитоплазматического декарбоксилирования — одновалентным анионом лактата (СН3—CHOH—СОО-) (рис. 79, Б). В отличие от простого декарбоксилирования оксалата, малат вначале окислительно декарбоксилируется НАДН-зависимой малатдекарбоксилазой («малик-энзимом») с образованием пиру вата, а затем уже пируват восстанавливается в лактат. Описываемый процесс происходит на поздних стадиях ферментации красного вина. В результате снижается кислотность сбраживаемого сусла (двухосновный малат заменяется эквивалентным количеством одноосновного лактата). Кроме того, содержащийся в красном вине лактат обладает антисептическими свойствами и приятен на вкус.
Данный механизм создания Pmf также может быть связан с антипортом аминокислот. Например, Lactobacillus sp. М3 использует в энергетических целях неидентифицированный аспартат2-: аланин1--антипортер в сочетании с цитоплазматической реакцией декарбоксилирования аспартата (рис. 79, В).
Наконец, Pmf может создаваться не за счет импорта отрицательного заряда, а путем экспорта положительного заряда. Таким механизмом пользуется молочнокислая бактерия Lactobacillus buchneri, когда импортируемый гистидин декарбоксилируется в цитоплазме с образованием гистамина. Имидазольные ядра гистидина и гистамина находятся на равном уровне протонирования, однако благодаря удалению отрицательно заряженного карбоксила гистамин приобретает дополнительный (по сравнению с гистидином) положительный заряд. В результате действия электрогенного гистидин1+: гистамин2+-антипортера наружная сторона СМ становится более электропозитивной (рис. 79, Г).
Можно привести еще ряд примеров аналогичных реакций декарбоксилирования аминокислот. Это декарбоксилирование глутамата в y-аминобутират (Lactobacillus sp.), лизина в кадаверин (Е. coli), орнитина в путресцин (Е. coli), тирозина в тира- мин (Pediococcus sp.) и фенилаланина в фенетиламин (Lactobacillus sp.). При этом, как и в случае L. lactis, клетки импортируют отрицательный заряд. Затем Pmf используется для синтеза АТФ, что в данном случае крайне неудачно называют «декарбоксилительным фосфорилированием».
Два особых случая связаны с использованием малата и цитрата умеренно ацидофильной «винной» бактерией Leuconostoc oenos, а также с использованием цитрата умеренно ацидофильной бактерией Leuconostoc mesenteroides, которая колонизирует молоко и молочные продукты.
В первом случае поглощение малата или цитрата не сопряжено с экскрецией конечного продукта, а происходит путем электрогенного унипорта аниона (см. раздел 9.1.1). Нейтральные конечные продукты метаболизма малата или цитрата, в частности недиссоциированный ацетат, покидают клетку путем пассивной диффузии.
Во втором случае при поступлении цитрата создается![]() в результате обмена двухвалентного цитрата на одновалентный лактат с помощью цитратпермеазы CitP. Однако в отличие от яблочно-молочнокислого «брожения» лактат не является продуктом прямого декарбоксилирования поглощаемого субстрата, а образуется в результате серии ферментативных превращений.
в результате обмена двухвалентного цитрата на одновалентный лактат с помощью цитратпермеазы CitP. Однако в отличие от яблочно-молочнокислого «брожения» лактат не является продуктом прямого декарбоксилирования поглощаемого субстрата, а образуется в результате серии ферментативных превращений.
10.4.10. Натриевая биоэнергетика
Итак, мы рассмотрели биотрансформаторы, которые на уровне одной из двух мембранных структур прокариотной клетки — СМ или ICM — ассимилируют свободную энергию химического (при хемотрофии) или квантового (при фототрофии) энергоносителя. Независимо от конкретного механизма общим результатом их действия становится трансмембранная разность электрохимических потенциалов Н+, хотя для этого не обязательно переносить протоны через мембрану.
Напомним, что разность электрохимических потенциалов Н+ складывается из разности химического потенциала этого катиона по две стороны мембраны (чаще всего pHjn > pHout) и разности электрического потенциала на противоположных поверхностях мембраны![]() Протоны, неравновесно распределенные по
Протоны, неравновесно распределенные по
двум сторонам мембраны, испытывают на себе сочетанное воздействие этих разностей потенциалов, т. е. протондвижущей силы (Pmf). Она направлена внутрь клетки и в большинстве случаев составляет приблизительно -100 мВ.
Протоны выполняют функцию главного «сопрягающего» катиона. Только некоторые прокариотные организмы могут использовать в качестве сопрягающего иона катионы Na+.
В данном случае катионы Na+ транслоцируются в окружающую среду через СМ, в результате чего создается разность электрохимических потенциалов этого иона, которую В. П. Скулачев назвал «натрийдвижущей силой» (англ. sodium motive force, Smf). Подобно Pmf этот источник энергии складывается из разности химических потенциалов Na+ по две стороны СМ (чаще всего pNajn > pNaout) и разности электрических потенциалов на противоположных поверхностях мембраны ![]() Катионы Na+, неравновесно распределенные по двум сторонам СМ, испытывают на себе общее действие этих разностей потенциалов, т. е. направленной внутрь клетки натрийдвижущей силы (Smf):
Катионы Na+, неравновесно распределенные по двум сторонам СМ, испытывают на себе общее действие этих разностей потенциалов, т. е. направленной внутрь клетки натрийдвижущей силы (Smf):
![]()
Предпосылки для использования Na+ в качестве сопрягающего катиона. Действие мембранных биотрансформаторов, с помощью которых прокариоты ассимилируют энергию на уровне СМ или ICM, чтобы затем использовать ее в эндергонических процессах, связано с поддержанием электрохимического потенциала катионов Н+ или Na+. Для этого необходимы два предварительных условия — наличие внешнего или запасенного источника энергии, а также низкая проницаемость мембран для этих сопрягающих катионов.
С ростом температуры усиливается подвижность мембранных липидов, что увеличивает проницаемость мембран для протонов и мешает поддерживать Pmf на необходимом уровне. Например, в случае Bacillus subtilis при увеличении температуры от 20 до 50° С проницаемость СМ для протонов возрастает на два порядка. Некоторые термофилы, в частности В. stearothermophilus, компенсируют утечку протонов усиленным дыханием. Однако в данных условиях более распространено запасание энергии в форме Smf (непосредственно или путем конвертирования Pmf в Smf). Проницаемость для катионов Na+ на несколько порядков ниже, чем для протонов, что позволяет поддерживать Smf даже при экстремально высоких температурах.
Выше мы уже говорили о том, что Smf играет важную роль в биоэнергетике алкалифилов. Как правило, у них электрохимический потенциал Na+ создается
вторичными транспортерами и затем расходуется не на синтез АТФ, а на импорт питательных субстратов, вращение жгутиков и другие эндергонические процессы. Это позволяет «сэкономить» протоны, сосредоточенные на наружной поверхности СМ, чтобы их в основном могла бы использовать Н+-АТФаза/АТФ-синтаза.
Мембранные биотрансформаторы, создающие Smf. Таким образом, в роли сопрягающего иона катионы Nа+ могут заменить протоны. Для создания Smf катионы Nа+ обязательно нужно перенести через СМ, и для этого могут использоваться два типа транспортеров (табл. 11):
— «прямые» Nа+-транспортеры, которые преобразуют энергию внешнего энергоносителя или запасенного энергоносителя непосредственно в 5т/;
— «непрямые» Nа+-транспортеры, действующие по приципу: Рmf —> Smf или по принципу АТФ —> Smf.
Таблица 11. Мембранные биотрансформаторы, создающие Smf
Тип биотрансформатора |
Локализация биотрансформатора |
Объект-представитель |
«Прямые» Na+-транспортеры |
||
НАДН-дегидрогеназа |
СМ |
Vibrio alginolyticus (класс «Gammaproteobacteria») |
«Метансинтезирующая» метил-H4МРТ : CoM-SН- метилтрансфераза |
СМ |
Methanosarcina barkeri (фила All Euryarchaeota) |
«Ацетатсинтезирующая» N-метил-H4МРТ : C/Fe-SP-метилтрансфераза |
СМ |
М. barkeri (фила АII Euryarchaeota) |
«Ацетатсинтезирующая» N-метил-H4 фолат: С/Fe-SP-метилтрансфераза |
CM |
Acetobacterium woodii (фила BXIII Firmicutes) |
Оксалоацетат- декарбоксилаза |
CM |
Klebsiella pneumoniae (класс «Gammaproteobacteria») |
Метилмалонил-СоА-декарбоксилаза |
CM |
Propionigenium modestum (фила BXXI Fusobacteria) |
Малонатдекарбоксилаза |
CM |
Malomonas rubra (класс « Deltaproteobacteria » ) |
«Непрямые» Na+-транспортеры |
||
Na+ /Н+-антипортер |
CM |
Escherichia coli (класс « Gammaproteobacteria» ) |
Nа+-транслоцирующая F0F1- АТФаза/АТФ-синтаза |
CM |
P. modestum (фила BXXI Fusobacteria) |
Прямой Na+ -транспортер — НАДН-дегидрогеназа. Характерным примером является факультативно анаэробная морская бактерия Vibrio alginolyticus. При анаэробном росте она создает Smf благодаря декарбоксилированию оксалоацетата в пи- руват так же, как это делают энтеробактерии Klebsiella pneumoniae и Salmonella typhimurium (см. ниже). Однако при аэробном росте Smf образуется с помощью НАДН-дегидрогеназы, или НАДН: убихинон-оксидоредуктазы (см. раздел 11.4.3). Этот фермент состоит из субъединиц α (52 кДа), β (46 кДа) и y (32 кДа), находящихся в стехиометрическом соотношении 2:2:2, и содержит два кофактора — ФМН и ФАД.
Помимо «прямого» механизма образования Smf с помощью дыхательной цепи известны примеры нетривиальных «прямых» механизмов. Их особенность состоит в том, что цитозольные катаболические или анаболические реакции сопровождаются мембранными реакциями превращения субстрата, в ходе которых свободная энергия ассимилируется в форме Рmf.
Такие реакции представляют собой либо Nа+-электрогенное трансметилирование, либо Nа+-электрогенное декарбоксилирование, т. е. свободная энергия соответствующих реакций ассимилируется в форме Smf.
Прямой Nа+ -транспортер — электрогепная трансметилаза. Первый пример электрогенного трансметилирования, сопряженного с действием Nа+-транспортера, связан с метаногенезом. Точнее сказать, он связан с одной из промежуточных реакций на пути биосинтеза метана у метаногенных архей.
Ее катализатором служит мембранная «метансинтезирующая» N-метил- H4МРТ: СоМ-SН-метилтрансфераза. Структура и действие этого фермента будут рассмотрены в разделе 11.4.5.5. Предполагается, что две субъединицы «метансинтезирующей» метилтрансферазы, MtrD и МtrЕ, непосредственно переносят катионы
Nа+ через мембрану.
Коферментом «метансинтезирующей» метилтрансферазы служит кобальтсодержащий тетрапиррол — 5-гидроксибензимидазолилкобамид, он же коррин, или витамин В12 (рис. 80). Другими В12-зависимыми ферментами у прокариотов являются:
— растворимая метионинсинтаза, которая образует метионин из гомоцистеина и N-метил-Н4 фолата;
— растворимая метилмалонил-СоА-мутаза, которая превращает сукцинил-СоА в метилмалонил-СоА (см. раздел 11.4.5.2);
— мембраносвязанная «ацетатсинтезирующая» метилтрансфераза ацетогенных бактерий (см. раздел 11.4.5.6).
Рис. 80. Корриноид (витамин В12).
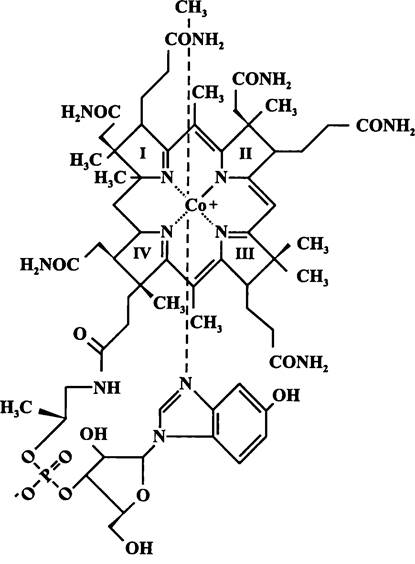
Вторым примером электрогенного трансметилирования, сопряженного с действием Na+-транспортера, служит автотрофный биосинтез ацетата. Точнее сказать, речь идет об одной из промежуточных реакций на пути образования ацетил-СоА у метаногенных архей и ацетогенных бактерий. Ее катализатором служит лишенная простетических групп мембраносвязанная «ацетатсинтезирующая» метилтрансфераза (см. раздел 11.4.5.6). Она передает метил от промежуточного переносчика (N- метил-H4МРТ у метаногенных архей или N-метил-Н4фолата у ацетогенных бактерий) корриноид/железосерному белку (англ. corrinoid/Fe-sulfur protein, C/Fe-SP), который в качестве простетической группы содержит 5-гидроксибензимидазолилко- бамид.
Предполагается, что у метаногенных архей и ацетогенных бактерий гомодимерная «ацетатсинтезирующая» метилтрансфераза непосредственно переносит катионы Na+ через мембрану.
Прямой Nа+-транспортер — электрогенная декарбоксилаза. Первым примером электрогенного декарбоксилирования, сопряженного с действием Na+-транспортера, является превращение оксалоацетата в пируват (рис. 81). Оно описано у энтеробактерий Klebsiella pneumoniae и Salmonella typhimurium, осуществляющих «необычное» ацетатное брожение, исходным субстратом для которого является цитрат (см. раздел 11.3.4.7).
Рис. 81. Электрогенное декарбоксилирование при ацетатном брожении. 1 — цитратлиаза; 2 — оксалоацетат-декарбоксилаза; 3 — пируват: формиатлиаза; 4 — фосфотрансацетилаза; 5 — ацетаткиназа.
Оксалоацетат образуется из цитрата под действием цитратлиазы. Затем он декарбоксилируется в пируват с помощью оксалоацетат-декарбоксилазы, которая экспортирует два катиона Na+ в расчете на одну молекулу оксалоацетата. Данный фермент состоит из трех субъединиц. Амфипатическая а-субъединица (60-65 кДа) выполняет функцию трансферазы и переносит карбоксил от оксалоацетата на биотин, или витамин Н (рис. 82).
Рис. 82. Биотин (витамин Н). Карбоксилированная форма присоединена ковалентной связью к апопротеину.
Интегральная β-субъединица (30-35 кДа) катализирует реакцию декарбоксилирования карбоксибиотина сопряженно с переносом двух катионов Na+. Третья, вспомогательная y-субъединица представляет собой интегральный белок молекулярной массой 12-14 кДа.
Образование Smf играет важную роль в питании этих бактерий, т. к. при «электронейтральном» импорте цитрата этот трехвалентный анион симпортируется с двумя катионами Na+ за счет Smf и одним катионом Н+ за счет Pmf. Поскольку Pmf создается путем симпортического экспорта протонов совместно с конечными продуктами метаболизма — ацетатом и формиатом (см. раздел 10.4.8), клетка не испытывает необходимости тратить образованный при брожении АТФ на поглощение цитрата.
Вторым примером электрогенного декарбоксилирования, сопряженного с действием Na+-транспортера, служит превращение экзогенного сукцината в пропионат. Этот катаболический путь изучен на примере облигатно аэробной бактерии Propionigenium modestum (фила BXXI Fusobacteria). Доставленный в клетку сукцинат с помощью СоА-трансферазы превращается в сукцинил-СоА, а затем метилмалонил-СоА-мутаза превращает сукцинил СоА в метилмалонил-СоА. Точно такие же
реакции происходят на пути биосинтеза пропионата пропионовокислыми бактериями (см. раздел 11.4.5.2). Однако в данном случае вместо растворимой метилма- лонил-СоА-карбокситрансферазы используется биотинзависимая мембраносвязанная метилмалонил-СоА-декарбоксилаза. Ее продуктами являются пропионил-СоА и диоксид углерода (рис. 83). Свободная энергия этой экзергонической реакции (∆С°' = -27,0 кДж • моль-1) используется для переноса катионов Nа+ из цитоплазмы во внешнюю среду. Роль натриевой помпы играет сама метилмалонил-СоА- декарбоксилаза — так же, как и оксалоацетат-декарбоксилаза.
Рис. 83. Электрогенное декарбоксилирование при превращении экзогенного сукцината в пропионат. 1 — СоА-трансфераза; 2 — метилмалонил-СоА-мутаза; 3 — метилмалонил-СоА-декарбоксилаза.

Третьим примером электрогенного декарбоксилирования, которое сопряжено с действием Nа+-транспортера, является превращение экзогенного малоната в ацетат. Данная реакция служит единственным источником энергии для анаэробных бактерий Malomonas rubra (класс «Deltaproteobacteria»), Sporomusa malonica и S. termitida (фила BXIII Firmicutes), выделенных соответственно из морских осадков, пресноводных илов и кишечника термитов. Кроме перечисленных бактерий данный способ образования Smf используют Klebsiella oxytoca, К. pneumoniae и Citrobacter diversus (класс «Gammaproteobacteria»). Детально он представлен на рис. 84. Установлено, что малонат активируется посредством образования тиоэфира. Однако это происходит не «тривиальным» путем с помощью CoASH, как в случае метилмалонил-СоА- декарбоксилазы, а в результате связывания с особым ацилпереносящим белком АСР (от англ. acyl carrier protein; ген madH). Предварительно SH-форма этого белка переводится с целью активации в ацетил-форму при помощи АТФ-зависимой лигазы. Затем АСР переносится от ацетила на малонат с помощью АСР-трансферазы (ген madA). Далее карбокситрансфераза (гены madC и madD) передает карбоксильную группу от малонил-АСР биотинсодержащему белку ВР (от англ. biotin carrier protein; ген madF), в результате чего регенерируется ацетил-АСР. В конечном счете, карбокси-форма белка ВР диффундирует к мембране, где ее декарбоксилирует интегральный белок (ген madB). Эта реакция экзергонична и сопряжена с переносом катионов Na+через СМ.
Рис. 84. Электрогенное декарбоксилирование при превращении экзогенного малоната в ацетат (по: Dimroth, Schink, 1998). АСР — ацилпереносящий белок; ВР—биотинсодержащий белок; 1 — АСР: ацетат- лигаза; 2 — ацетил: малонат-АСР-трансфераза; 3 — карбокситрансфераза; 4 — ВР-декарбоксилаза.

Подчеркнем, что во всех трех случаях «Smf-декарбоксилирование» (так же, как и не запасающее энергию декарбоксилирование метилмалонил-СоА у пропионово- кислых бактерий; см. раздел 11.4.5.2) осуществляется с помощью ферментов, содержащих ковалентно связанный биотин.
Непрямой Nа+ -транспортер — Nа+/Н+ -антипортер. Резкий сдвиг концентрации катионов и Н+ в окружающей среде действует на прокариотные клетки как стрессовый фактор. Поэтому одной из важнейших задач регуляторных систем служит Na+- и Н+-гомеостатирование, что, в частности, достигается с помощью Nа+/Н+-антипортеров. Наряду с этим Nа+/Н+-антипортеры могут выполнять задачу непрямого Na+-транспортера, позволяющего создать Smf за счет Pmf. В некоторых случаях, например, у алкалифилов, это обеспечивает энергией синтез АТФ, активный транспорт и подвижность.
Открытые в 1960-е годы Питером Митчелом Nа+/Н+-антипортеры, входящие в состав СМ, распространены практически универсально. В случае бактерий их характерным представителем является антипортер Е. coli — NhaA. Его транскрипция находится под позитивным контролем сенсорного белка NhaR, который взаимодействует с Nа+-специфичным промотором Р1; негативный контроль осуществляет ДНК-связывающий белок — глобальный регулятор H-NS. Подобно другим вторичным транспортерам, белок NhaA состоит из двенадцати трансмембранных сегментов, связанных между собой гидрофильными «шпильками» (см. рис. 65). В группу прокариотных Nа+/Н+-антипортеров, которые гомологичны или не гомологичны NhaA, входят белки NapA, NhaB — D и NhaP.
Непрямой Na+-транспортер — Na+-транслоцирующая F0F1-АТФаза/АТФ- синтаза. Как показано на примере Р. modestum, бактерии могут создавать Smf с помощью «обратимой» Na+-транслоцирующей F0F1-АТФазы/АТФ-синтазы. Этот осмоэнзим состоит из «стандартного» набора субъединиц, гомологичных субъединицам Н+-транслоцирующей F0F1-АТФазы/АТФ-синтазы (см. рис. 74). С помощью генноинженерных методов получен функционально полноценный «гибрид», состоящий из αβyε-субъединиц Е. coli и abcδ-субъединиц Р. modestum.
Другим примером использования энергии фосфагена для создания Smf служит Caloramator fervidus (см. рис. 69). При температуре роста СМ этой бактерии обладает повышенной проницаемостью для протонов, и поэтому единственным способом энергизации систем для импорта питательных субстратов у нее становится образование Smf за счет гидролиза АТФ с помощью Na+-транслоцирующей F0F1- АТФазы/ АТФ-синтазы.
Пути использования Smf. По аналогии с использованием Pmf натрийдвижущая сила может обеспечивать энергией таких потребителей, как мембранное фосфорилирование АДФ и активный транспорт, а также вращение жгутиков и другие типы подвижности.
Мембранное фосфорилирование АДФ. В случае Р. modestum единственным источником энергии для синтеза АТФ является Smf и это осуществляется с помощью «обратимой» Na+-транслоцирующей F0F1-АТФазы/АТФ-синтазы.
К семейству Na+-АТФаз/АТФ-синтаз также относится АТФаза/АТФ-синтаза автотрофного ацетогена Acetobacterium woodii. Интересно, что в составе этого фермента имеются три типа интегральной «протеолипидной» с-субъединицы (см. раздел 10.4.3) — c1, c2 и с3. Ген субъединицы c1(atpE1) гомологичен гену протеолипидной субъединицы эукариотной V0V1-АТФазы. Таким образом, Na+-АТФаза/АТФ-синтаза А. woodii является уникальным примером природного «гибрида» прокариотной и эукариотной мембранных АТФаз.
Если Smf создается с помощью реакции декарбоксилирования (см. табл. 11), а затем расходуется на синтез АТФ, последний часто называют «декарбоксилительным фосфорилированием». Такой термин мы уже встречали, когда речь шла о создании Pmf в результате антипорта субстрата и продукта его цитоплазматического декарбоксилирования (см. раздел 10.4.9).
Активный транспорт. В разделе 9.1.1 мы уже останавливались на примерах, Smf-зависимых симпортеров, которые бывают однокомпонентными или могут дополнительно включать в себя связывающие белки.
Обеспечение подвижности. Возможность прямого использования Smf (а не Pmf) локомоторными системами рассматривается на примере экстремально алка- лифильных бактерий, обитающих в континентальных содовых озерах, а также на примере некоторых морских бактерий.
В первом случае, у алкалифильных бацилл, скорость плавания при помощи вращающихся жгутиков экспоненциально растет с увеличением концентрации катионов Na+и зависит не от ∆pNa+, а от ∆![]() .
.
Во втором случае, у морских цианобактерий из рода Synechococcus, обнаружен уникальный тип плавания при полном отсутствии жгутиков и иных цитологически выявляемых локомоторных органелл (см. I том учебника). Установлено, что клетки теряют подвижность при концентрации Na+ <10 мМ и достигают максимальной скорости перемещения в морской воде 15 мкм • с-1 при концентрации катионов Na+ в пределах 150-250 мМ, что обеспечивает величину Smf> -100 мВ (по абсолютному значению). Механизм такой подвижности точно неизвестен, скорее всего, он связан с волнообразным импульсом, который передается от СМ на ОМ.
* * *
Из рассмотренных примеров видно, что в «физиологическом» диапазоне внешних условий у прокариотов реализуются все теоретически возможные варианты электрогенераторов. Биогенез и действие этих систем зависят от генетически обусловленной адаптации бактерии или археота к тому или иному энергоносителю. Кроме того, для использования конкретного энергоносителя требуется ряд сопутствующих физико-химических и биотических факторов.
В заключение к данному разделу напомним, что прокариотам доступны два типа энергоносителей (химические субстраты и кванты электромагнитного поля), а затем перейдем к рассмотрению двух типов энергетического питания — хемотрофии и фототрофии.