МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ III - А. В. ПИНЕВИЧ - 2009
ГЛАВА 17. ОНТОГЕНЕЗ
Les organismes composés d’une seule cellule (tels que les Infusoires ainsi que beaucoup d’autres Protozoaires et de plantes inférieures) se reproduisent par division et se transforment en deux ou plusieurs êtres nouveaux; l’organisme mère s’est pour ainsi dire dissous dans celui de la progéniture, sans avoir subi la mort véritable.
(Одноклеточные организмы (как, например, инфузории и многие другие простейшие и низшие растения) размножаются делением и превращаются в две или несколько новых особей; у них материнский организм не умер, а, так сказать, растворился в своем потомстве).
Е. Metchnikoff. Essais optimistes (Paris, 1907).
Термин онтогенез (англ. ontogeny; от греч. on — сущее и genesis — созидание; «становление живого существа»; «судьба особи»), предложенный в 1866 г. немецким натуралистом Эрнстом Геккелем (Е. Haeckel), сначала относился только к многоклеточным организмам, размножающимся половым путем. Позднее его стали использовать в очень широком смысле, и в настоящее время под онтогенезом подразумевается цикл индивидуального развития любого живого существа, в том числе одноклеточного или даже имеющего неклеточное строение.
Сущность онтогенеза у разных живых существ. Онтогенез неклеточного живого существа, или вируса, соответствует промежутку между двумя репликативными состояниями генома.
Онтогенез одноклеточного организма (протиста или прокариота) эквивалентен клеточному циклу, т. е. периоду между двумя последовательно происходящими клеточными делениями или периоду между завершающим делением и клеточной смертью.
Онтогенез многоклеточного организма (который в своей основе имеет онтогенез отдельной клетки) складывается из ряда возрастных стадий; исходным моментом служит оплодотворение яйцеклетки или начало самостоятельного существования органа вегетативного размножения, а финалом — смерть особи.
Особь у прокариотов. У бактерий особью является либо одиночная клетка, либо квази-синцитиальное образование (трихом). Археи, в отличие от бактерий, никогда не образуют трихомов, и особью у них практически всегда является клетка. В качестве исключения, например, у метаногенов Methanosaeta thermophila и
Methanospirillum hungatei, особь представлена нитью (не путать с трихомом!), которая состоит из выстроенных в ряд цилиндрических клеток и разделяющих их спейсеров в окружении общего чехла (см. раздел 17.4.6).
Напомним, что трихом образуется как минимум из двух клеток, соединенных друг с другом микроплазмодесмами и окруженных общей ОМ (см. I том учебника).
После сегрегации сестринских хромосом цитоплазматический компартмент материнской клетки расчленяется диафрагмой, состоящей из плоской кольцевой инвагинации СМ с прослойкой «септового» муреина, который синтезируется de novo. У одноклеточных бактерий деление проходит до конца, и септовый муреин расслаивается на два листка, между которыми инвагинирует ОМ. В трихоме процесс деления частично заблокирован, и септовый муреин не расслаивается, а дочерние клетки остаются в окружении общей ОМ.
Цитоплазматические компартменты соседних клеток сообщаются между собой через микро- плазмодесмы, которые пронизывают общую поперечную стенку.
Таким образом, у одноклеточных прокариотов онтогенез соответствует клеточному циклу, а у трихомных бактерий и нитчатых метаногенов — периоду между двумя последовательными актами фрагментации трихома или нити.
17.1. Клеточный цикл
Под клеточным циклом (англ. cell cycle) подразумевается совокупность событий, происходящих в интервале между двумя клеточными делениями.
По ходу клеточного цикла развертываются транспортные, метаболические и регуляторные процессы, которые решают глобальную биологическую задачу — копирование генов и их передачу по вертикали от материнской клетки дочерним клеткам или их перенос по горизонтали между двумя генетически не идентичными клетками (см. раздел 16.6.1.3).
Ключевыми фазами клеточного цикла являются:
— репликация хромосом(ы);
— сегрегация сестринских геномных эквивалентов;
— клеточное деление.
Мономорфный клеточный цикл и мультиморфные клеточные циклы. В основе ключевых фаз клеточного цикла с соответствующими генетическими событиями лежат клеточный рост и морфогенез, которые сопровождаются процессами обновления и репарации (см. раздел 17.3).
Если после деления клетки не дифференцируются, то клеточный цикл называется мономорфным (даже если дочерние клетки отличаются друг от друга по форме и размеру). Типичным примером бактерии с мономорфным клеточным циклом служит Е. coli.
Наблюдая морфологический результат бинарного эквивалентного деления (см. раздел 17.4 и рис. 228), мы не можем определить, какая из двух новых особей является материнской, а какая — дочерней. По образному выражению И. И. Мечникова, которое выбрано в качестве эпиграфа к настоящей главе, в момент деления старая особь «растворяется», и вместо нее появляются две новые одинаковые особи. Компоненты старой особи, в том числе несущие повреждения, распределяются между новыми особями поровну (а не консервативно, как было бы в том случае, когда их сохраняет материнская клетка).
Если клеточное деление сопровождается клеточной дифференциацией, мы имеем дело с мулытиморфными клеточными циклами. В том случае, когда образуются дифференцированные клетки только одного типа, клеточный цикл называется диморфным, а если двух типов — триморфным.
В зависимости от способа дифференциации, физиолого-биохимических свойств и выполняемой функции, дифференцированные клетки подразделяются на активные (см. раздел 17.5.1) и покоящиеся резистентные (см. раздел 17.5.2).
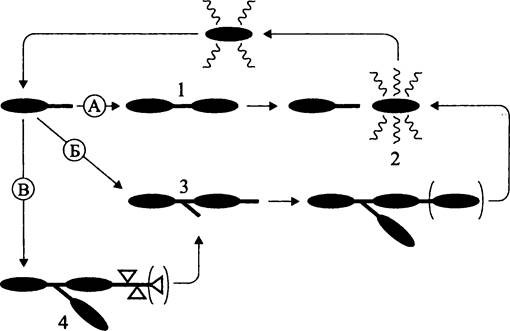
Примером бактерии со сложным онтогенезом, в котором представлены три типа клеточных циклов, служит Rhodomicrobium vannielii (рис. 221). Роль активной клетки, обеспечивающей распространение этой бактерии, играет швермер, а роль покоящейся резистентной клетки — экзоспора (см. раздел 17.5.2.1).
Рис. 221. Клеточные циклы Rhodomicrobium vannielii. А — диморфный цикл с вегетативной немицилиальной (1) и подвижной дифференцированной (2) стадиями; Б — диморфный цикл с вегетативной мицелиальной (3) и активной дифференцированной (2) стадиями; В — триморфный цикл с вегетативной мицелиальной (3), активной дифференцированной (2) и покоящейся резистентной дифференцированной (4) стадиями.
Что касается архей, то в данном случае говорить о мультиморфных клеточных циклах преждевременно, поскольку данных об их дифференцированных клетках еще мало (см. раздел 17.5.2.1).
Абортивный клеточный цикл («выход» из цикла). В отдельных случаях у прокариотов имеет место абортивный клеточный цикл (англ, abortive cell cycle), когда после очередного деления новый раунд репликации хромосомы по той или иной причине не инициируется или преждевременно прерывается. В данном случае по аналогии с эукариотами можно сказать, что клетка «выходит» из клеточного цикла. Такой сценарий, несмотря на способность прокариотов к потенциально неограниченному размножению, заканчивается запрограммированной смертью клетки (см. ниже).
Отсутствие фазы репликации и абортивный клеточный цикл характерны для терминально дифференцированных клеток. Классическим примером служат гете-
роцисты цианобактерий из Субсекций IV и V (см. I том учебника). Они образуются при азотном голодании и специализируются на диазотрофии. Зрелые гетероцисты неспособны к дедифференциации и рано или поздно обречены на запрограммированную смерть (см. раздел 17.5.1.2).
Наконец, абортивный клеточный цикл имеет место в результате абортивного деления (англ. abortive cell division), правильнее сказать, из-за ошибки в ходе взаимной изоляции сестринских хромосом (см. раздел. 16.4.2). В данном случае одна из дочерних клеток получает неполноценный фрагмент хромосомы или оказывается «безъядерной», т. е. вообще без хромосомы, что неизбежно заканчивается автолизом.
17.1.1. Структура клеточного цикла
Для понимания особенностей клеточного цикла у прокариотов его необходимо сравнить с клеточным циклом у ядерной клетки.
Клеточный цикл эукариотов состоит из четырех фаз:
— первой промежуточной фазы G1 (сокр. англ. gap — промежуток);
— фазы репликации S (сокр. англ. synthesis; в данном случае — синтез ДНК);
— второй промежуточной фазы G2;
— фазы митоза М (сокр. англ. mitosis).
Все четыре фазы взаимно обособлены и сменяют друг друга в строгой очередности: G1 —> S —> G2 —> М. Каждая фаза начинается не раньше, чем закончится предыдущая. Иными словами, у эукариотов репликация, сегрегация хромосом и клеточное деление разобщены во времени.
Для прокариотов модель клеточного цикла, учитывающая особенности регуляции их репликации и известная как «I + С + D», была разработана в 1968 г. группой американских микробиологов во главе с Хелмстетером (С. Е. Helmstetter). Они же предложили стандартизированные обозначения для отдельных фаз клеточного цикла прокариотов — по аналогии с клеточным циклом эукариотов (табл. 29).
Таблица 29. Сравнительные обозначения фаз клеточного цикла у эукариотов и прокариотов
Фаза клеточного цикла |
Эукариоты |
Прокариоты |
Пререпликативная |
G1 |
I(B) |
Репликативная |
S |
С |
Пострепликативная |
G2 + M |
D |
В случае прокариотов период от завершения взаимной изоляции дочерних клеток до начала нового раунда репликации, называется фазой /, или фазой В (сокр. англ. intermediarj', или between); он соответствует фазе G1 эукариотов. Репликативная фаза С прокариотов (сокр. англ. chromosome) соответствует фазе S эукариотов. В свою очередь, фаза D у прокариотов (сокр. англ. division) соответствует периоду G2 + М, который у эукариотов проходит от терминации репликации до завершения митотического деления.
В отличие от эукариотной модели клеточного цикла G1 —> S —> G2 —> М. прокариотная модель не обязательно реализуется в линейной последовательности I —> С —> D, когда за инициацией/элонгацией/терминацией репликации следует деление и т. д. При малой продолжительности клеточного цикла репликативная фаза С выходит за его пределы!
Дело в том, что общая картина репликации, связанная с числом репликационных вилок, определяется реальным соотношением между продолжительностью фазы С и временем генерации (т. е. периодом от деления до деления).
При большом времени генерации на хромосоме образуется единственная репликационная вилка, и до завершения раунда репликации реинициация не происходит, т. е. фаза С укладывается в клеточный цикл. Иными словами, после терминации репликации синтез ДНК, как у эукариотов, на некоторое время прекращается.
В свою очередь, при частом делении продолжительность фазы С больше, чем время генерации, и на хромосоме образуется несколько репликационных вилок, которые передаются в дочерние клетки (см. раздел 16.4.1.1, а также рис. 178).
17.1.2. Регуляция клеточного цикла
Для быстро размножающихся бактерий, которые делятся 1-3 раза в час, продолжительность фаз С и D постоянна и равна, соответственно, ~40 и ~20 мин. В случае медленно размножающихся бактерий фазы С и D составляют, соответственно, 2/3 и 1/3 клеточного цикла. У очень медленно размножающихся бактерий клеточный цикл растягивается за счет адаптивной фазы 1(B), которая при постоянной температуре зависит от прочих физико-химических условий природной или лабораторной среды.
Каким образом осуществляется регулярная смена отдельных событий, а также целых фаз клеточного цикла?
По современным представлениям, для этого существуют особые контрольно-пропускные пункты (англ. checkpoint), которые в случае нарушений, допущенных на предшествующей фазе, блокируют переход к следующей фазе.
Центральным событием клеточного цикла является репликация ДНК, и неудивительно, что именно этот процесс считается главным checkpoint’ом.
Как известно, повреждения ДНК блокируют репликационную вилку, вызывая SOS-ответ (см. раздел 16.5.1.4). Для него характерна активация белка RecA, который не только сам участвует в репарации ДНК, но и стимулирует автопротеолиз репрессора SOS-ответа — белка LexA. Также элементом SOS-ответа служит активация ингибитора клеточного деления SulA (см. раздел 17.4.1), в результате чего блокируется фаза D клеточного цикла. Таким образом, в случае стресса мы имеем дело с SOS-checkpoint’oм и негативной регуляцией клеточного цикла.
Очевидно, что в отсутствии стресса речь идет о позитивной регуляции и check- point’e, который разрешает переход от фазы С к фазе D. Предполагается, что в данном случае главным checkpoint’oм служит терминация репликации, хотя природа соответствующего сигнала неизвестна. Роль промежуточных регуляторов клеточного цикла могут играть аналоги митотического аппарата (см. раздел 16.4.2.1). Однако, какие checkpoint’ы нужно пройти на данном этапе — не выяснено. Фаза D тоже должна иметь свой checkpoint, но мы не знаем, что дает сигнал на сборку Z- кольца.
У эукариотов прохождение отдельных фаз клеточного цикла и его общая продолжительность зависят от последовательной активации системы циклинов/циклинзависимых киназ, acheckpoint’ами служат отдельные стадии репликации и физическая организация хромосом. Существует ли аналогичный механизм у прокариотов, пока еще неизвестно.
17.1.3. Циркадные ритмы и их связь с клеточным циклом
Если условия окружающей среды на короткое время изменяются, клеточный цикл регулируется внутренними сигналами и имеет относительно постоянную продолжительность. Иными словами, он играет роль биологических часов, хотя точно не известно, каково их устройство и как они работают.
Циркадные ритмы. Наряду с клеточным циклом бактерии могут использовать второй механизм, работающий по эндогенной программе — биологические часы, которые являются водителем циркадного ритма.
Термином «циркадный ритм» (англ. circadian rhythm; от лат. circa diem — примерно день), применительно к одноклеточному или многоклеточному организму, обозначается суточное повторение или волнообразное изменение интенсивности биологических процессов. Осциллирующий, т. е. колебательный характер могут принимать экспрессия генов, метаболическая активность, процессы развития и поведенческие реакции.
Биологические часы, задающие циркадный ритм, характеризуются тремя каноническими свойствами:
— они имеют независимый ход, т. е. при постоянных внешних условиях совершают полный оборот приблизительно за 24 ч;
— они могут переводиться, т. е. при изменении внешних условий (сигналами служат интенсивность света, темнота или температура) циркадный ритм сдвигается по фазе, по аналогии с тем, как человек после дальнего авиаперелета привыкает к местному времени;
— они термокомпенсированы, т. е. идут с одной и той же скоростью в физиологическом интервале температур подобно нашим биологическим часам, для которых географический полюс субъективно не отличается от экватора (хотя при изменении температуры, как и других внешних условий, часы могут сдвигаться по фазе).
Скорость вращения Земли является наиболее стабильным физическим параметром на протяжении всей истории существования органической жизни. Поэтому неудивительно, что живые организмы регулируют свои эндогенные процессы с помощью биологических часов, ход которых совпадает с ходом космических часов. Это позволяет адаптироваться к суточным изменениям таких факторов внешней среды, как свет, температура и влажность. В частности, температура обычно минимальна перед восходом солнца и максимальна в полдень. Соответственно, устойчивость к тепловому шоку должна быть минимальна ночью, а днем максимальна, и живым организмам выгодно это предвидеть.
Феномен суточного ритма впервые описал в 1729 г. французский ботаник Дэмеран (de Mairan) на примере движения листьев, которые разворачиваются и свертываются независимо от смены периодов света и темноты. В последующие 250 лет было показано, что помимо растений биологическими часами обладают животные, грибы и протисты.
К числу осциллирующих процессов у низших организмов, в частности, относятся:
— клеточный цикл Chlorella spp., Е. gracilis и S. cerevisiae\
— образование конидий аскомицетом Neurospora crassa;
— образование половых пар инфузориями Paramecium. spp.;
— биолюминесценция у динофлагеллата Gonyaulax polyedra;
— хемотаксис у Chlamydomonas reinhardtii;
— фотосинтез сифональной водоросли Acetabularia mediterránea и т. д.
У высших организмов, в частности у человека, зарегистрированы циркадные ритмы температуры тела, уровня ферментов и гормонов, а также чувствительности к лекарственным препаратам.
Существование циркадных ритмов у прокариотов, время генерации которых обычно меньше 24 ч, не допускалось a priori. Одпако в 1985 г. немецкие микробиологи Шталь (L. J. Stahl) и Крумбайн (W. Е. Krumbein) на примере нитчатой цианобактерии Oscillatoria sp. 23, а следом за ними в 1986 г. японская группа под руководством Мицуи (А. Mitsui) на примере Synechococcus sp. Miami BG 43511 и китайская группа под руководством Тань-Чи Юаня (Т. С. Huang) на примере Synechococcus sp. RF-1 обнаружили, что если культуры выращивать при сменном режиме света и темноты (по 12 ч), а затем перейти на непрерывное освещение, то в течение нескольких дней пик нитрогеназной активности будет повторяться с периодичностью ~24 ч.
Кроме того, в случае Synechococcus sp. Miami BG 43511 было показано, что ритм фотосинтетической активности (дневной пик) находится в противофазе с ритмом нитрогеназной активности (ночной пик). Физиологический смысл этого очевиден и связан с «темпоральной» защитой нитрогеназы (см. II том учебника).
Биологические часы у цианобактерий контролируют экспрессию генов в онтогенезе через систему глобальных регуляторов, и их ход внешне выражается в осцилляции уровня мРНК (см. ниже).
В настоящее время показано, что циркадно экспрессируются гены нитрогеназы (nif), ген апопрогеина D1 реакционного центра ФС II (psbAI), ген белка теплового шока (DnaK), гены транспортеров аминокислот, гены цитокинетического аппарата (fis) и ряд других, не менее важных генов.
Основным инструментом для изучения биологических часов у цианобактерий служат мутанты, полученные в середине 1990-х гг. с помощью химического мутагенеза.
Для анализа циркадного ритма используется автоматизированное измерение люминесценции микроколоний цианобактерий со встроенным в хромосому репортерным геном люциферазы.
В частности, клетки трансформируют гибридной конструкцией из структурных генов люциферазы (luxAB), фрагмента гена psbAI и его промотора. В результате гомологической рекомбинации она встраивается в хромосому, и гены люциферазы начинают экспрессироваться, подчиняясь циркадному ритму (рис. 222).
Для глобального скрининга ритмического контроля промоторов гены люциферазы путем конъюгации переносят в Synechococcus spp. Донором служит Е. coli, содержащая «библиотеки» гибридов luхАВ с фрагментами цианобактериальной ДНК. После случайного встраивания в хромосому гены luxAB попадают под контроль резидентных промоторов.
Рис. 222. Циркадная экспрессия генов люциферазы luxAB в клетках Synechococcus sp. под контролем промотора гена psbAI. По оси абсцисс — время (ч) после помещения в условия непрерывного освещения; по оси ординат — интенсивность люминесценции (импульсе-1).
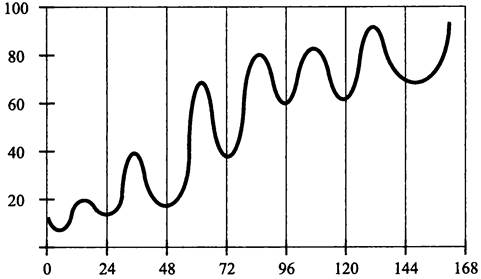
Таким методом были выявлены циркадные ритмы с волнами разной формы, амплитуды и фазы. В ряде случаев гены люциферазы попадают под контроль промоторов известных генов (например, rrnА и psbAI). Среди них различают гены класса I, которые максимально экспрессируются днем (в частности, psbAI), и гены класса II, которые максимально экспрессируются ночью (в частности, glnA). Заметим, что это не какие-то специализированные гены, а гены, отвечающие за метаболизм в целом, а также за такой фундаментальный процесс, как клеточное деление.
В результате фенотипической комплементации мутантов с нарушенным циркадным ритмом (аритмия; продолжительность 14-60 ч; изменение длины волны и фазы) у ряда цианобактерий, в частности Synechococcus sp. РСС 7942, идентифицированы гены, продукты которых обеспечивают ход биологических часов (см. ниже). Важно подчеркнуть, что они не гомологичны соответствующим генам у ядерных организмов.
Биологические часы Synechococcus sp. 7942, задающие эндогенный циркадный ритм, соединены с фоторецепторным устройством и, подчиняясь внешнему световому сигналу, ежедневно переводятся по фазе (т. е. устанавливаются по локальному времени). Кроме того, хотя природный суточный цикл равен 24 ч, реальная периодичность циркадного ритма обычно несколько меньше или больше этого времени, в зависимости от продолжительности светового дня.
Циркадная система состоит из входа (англ. input), центрального осциллятора (англ. central oscillator) и выхода (англ. output). Вход передает сигнал для перевода часов по фазе; осциллятор служит водителем эндогенного 24-часового ритма; выход обеспечивает внешнее проявление циркадного ритма (рис. 223, А).
Вход циркадной системы. На входе находится фоторецептор — гистидинкиназа CikA (сокр. англ. circadian input kinase; 754 а. о.). Она содержит характерный для бактериофитохромов мотив Gly-Ala-Phe (см. раздел 1S.3.1.1), однако лишена консервативных остатков Cys и His, необходимых для ковалентного связывания билинового хромофора, т. е. билин или другой кофактор присоединяются к апопротеину нековалентно.
Центральный осциллятор циркадной системы. Сердцевину центрального осциллятора составляет трио белков, которые кодируются генами kaiA, kaiB и kaiC (от японск. kai — цикл). Гены каiВА образуют оперон, в то время как ген kaiC транскрибируется независимо от них. Белки KaiАВС незаменимы, и отсутствие хотя бы одного приводит к исчезновению циркадного ритма.
Белок KaiC (519 а. о.), принадлежащий к семейству ААА-АТФаз, содержит АТФ/ГТФ-связывающий мотив Уокера (см. разделы 16.4.1.1 и 16.6.1.3).
Белки KaiA (284 а. о.) и KaiB (102 а. о.) обладают N-концевыми доменами, которые у регуляторов ответа обычно играют роль приемника сигнала, или ресивера (англ. receiverdomain). В двухкомпонентной сигнальной системе регулятор получает от гистидинкиназы, или сенсора фосфорильную группу, которая связывается с консервативным остатком Asp в составе приемника (см. раздел 18.2). Однако в белках KaiA и KaiB такие остатки отсутствуют, т. е. в данном случае N-концевые домены играют роль псевдоресивера.
Выход циркадной системы. На выходе циркадной системы находится белок SasA (сокр. англ. Synechococcus adaptive sensor). По сути дела, это умножитель ритма, задаваемого центральным осциллятором. Подобно белкам KaiA и KaiB, он играет роль регулятора ответа; его псевдоресиверный домен получает сигнал от белка KaiC. Белок SasA активирует сигма-факторы RpoD2-D4 и SigC (группа 2).
Попутно заметим, что кроме главного сигма-фактора RpoDl (группа 1), гомолога и функционального эквивалента σ70 Е. coli, у цианобактерий существует несколько
взаимно родственных сигма-факторов группы 2, которые также гомологичны σ70, однако не участвуют в реализации процессов роста (см. раздел 18.1.1).
Биохимический механизм водителя циркадного ритма стал проясняться в 2005 г., когда было показано, что он связан с осцилляциями уровня фосфорилирования белка KaiC.
Рис. 223. Общая организация циркадной системы цианобактерий (А) и механизм работы центрального осциллятора (Б). N и С — N- и С-концевой домены; 1 — первое фосфорилирование; 2 — второе фосфорилирование; 3 — первое дефосфорилирование; 4 — второе дефосфорилирование.
Пунктирные стрелки — передача сигнала; тупые стрелки — негативный контроль.
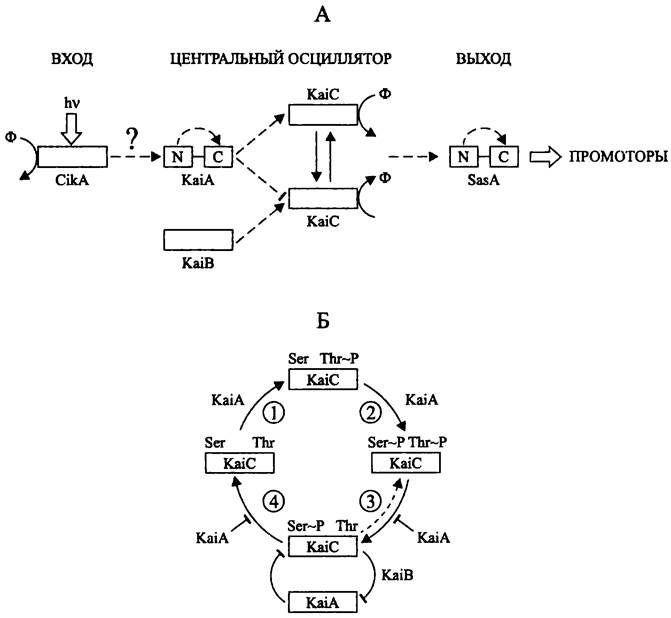
По данным, одновременно опубликованным в конце 2007 г. группами 'Гакао Кондо (Т. Kondo) и Майкла Руста (М. Л. Rust), белок KaiC последовательно автофосфорилируется и автодефосфорилируется по остаткам Thr и Ser (рис. 223, Б), причем белок KaiА позитивно регулирует автофосфорилирование и негативно регулирует автодефосфорилирование.
Почему фосфорилирование белка KaiC носит циклический характер? Как выяснилось, белок KaiC, фосфорилированный по остатку Ser (KaiC--Ser~P), образует стехиометрический комплекс с белками KaiA и KaiB. И если свободный белок KaiA активирует фосфорилирование и препятствует дефосфорилированию белка KaiC, то в составе комплекса KaiA/KaiB/KaiC-Ser~P он этого не делает (рис. 223, Б). Когда концентрация белка KaiC-Ser~P возрастает, белок KaiA «иммобилизуется» в комплексе, и начинает преобладать дефосфорилирование белка KaiC. В свою очередь, когда концентрация белка KaiC-Ser~P снижается, белок KaiA покидает комплекс, и начинает преобладать фосфорилирование белка KaiC. Иначе говоря, KaiC-Ser~P и KaiA являются взаимными антагонистами. Белок KaiA негативно регулирует белок KaiC-Ser~P, сдвигая равновесие реакции первого дефосфорилирования в сторону образования комплекса KaiC-Ser~P/KaiC-Thr~P. В свою очередь, белок KaiC-Ser~P негативно регулирует белок KaiA, «иммобилизуя» его в комплексе.
Процесс протекает по циклической схеме: нефосфорилированный КаiC —> низкая концентрация КаiC-Sег~Р/КаiА —> преобладание фосфорилирования —> накопление КаiС-Seг~Р/КаiC-Тhг~Р —> накопление КаiС-Sег~Р —> «иммобилизация» КаiА —> накопление КаiC-Sеr~Р —> дальнейшая «иммобилизация» КаiА —> преобладание дефосфорилирования —> нефосфорилированный КаiС.
Таким образом, циклический характер фосфорилирования белка КаiC обеспечивается двойной петлей обратной связи.
Возможность существования циркадных ритмов у прокариотов, не относящихся к цианобактериям. Предполагается, что циркадные ритмы характерны для всех цианобактерий. У других прокариотов они не обнаружены, хотя в геномах ряда представителей филы ВХII Proteobacteria и архей содержатся гомологи генов kaiC и kaiB, которые могли быть приобретены горизонтальным путем от цианобактерий.
Если цель использования 24-часового осциллятора медленно растущими цианобактериями очевидна, то зачем он может понадобиться быстро растущим хемотрофным прокариотам? Например, когда Е. coli находится в пищеварительном тракте человека, она не нуждается в циркадном ритме, поскольку находит там богатую питательную среду и другие оптимальные условия для роста. Иное дело, когда эта бактерия временно оказывается в воде или почве. Не исключено, что в стрессовой обстановке она может пускать в ход биологические часы, имеющие адаптивное значение для ее выживания.
Связь циркадных ритмов с клеточным циклом. У одноклеточных ядерных организмов, в частности Е. gracilis, G. polyedra и Tetrahymena pyriformis, циркадная система часто контролирует начало деления.
Связь между делением и проявлением циркадных ритмов у эукариотов подчиняется «циркадно-инфрадному» правилу (англ. circadian-infradian rule; от лат. infra diem — позже дня). Оно гласит, что циркадные ритмы наблюдаются только у клеток, которые делятся раз в день или реже. В свою очередь, у клеток, которые делятся чаще одного раза в день, клеточный цикл не контролируется циркадным осциллятором. Более того, при скорости деления больше одного раза в день циркадные осцилляции вообще не происходят, т. е. они имеют адаптивный смысл только в том случае, если время генерации равно одному дню или больше дня (т. е. клетки делятся не чаще раза в день).
Распространяется ли циркадно-инфрадное правило на прокариотов? Иными словами, могут ли они параллельно использовать два типа биологических часов — циркадный таймер и таймер, основанный на клеточном цикле? Если да, то какой из них является ведущим?
В опытах, проведенных с относительно быстро растущими штаммами цианобактерий, в частности с пресноводным штаммом Synechococcus sp. РСС 7942 и морским штаммом Synechococcus sp. WH 7803 (время генерации ~10 ч), культуры тренировали путем выращивания в сменном режиме света и темноты (по 12 ч). Когда их помещали в условия непрерывного освещения, первый пик делений наблюдался через 12 ч, а затем повторялся с 24-часовым интервалом (хотя культура так и не становилась синхронной). Иными словами, частота деления находится под контролем циркадного осциллятора, и оба типа биологических часов идут одновременно, причем циркадный таймер действует независимо от таймера, основанного на клеточном цикле.
В темноте фотоавтотрофные цианобактерии не делятся, хотя на свету они накапливают достаточно резервных веществ. Клеточный цикл абортируется из-за прекращения биосинтеза ключевых макромолекул, прежде всего ДНК. В свою очередь, при попадании на свет инициируется новый клеточный цикл.
На примере Synechococcus sр. РСС 6301 показано, что свет регулирует транскрипцию оперонов рибосомной РНК rrnА и rrnВ. В частности, транскрипция оперона rrnА контролируется ДНК- связывающим белком Rbр1, а тот, в свою очередь, активируется на свету и дезактивируется в темноте.
Как уже указывалось, живым организмам физиологически выгодно адаптироваться к суточной смене физико-химических параметров среды, в частности предвидеть наступление рассвета. Это особенно важно для фотосинтезирующих организмов, таких как цианобактерии, пигментные комплексы которых легко травмируются светом. Распространяется ли принцип селективного преимущества циркадных ритмов на других прокариотов, пока еще неизвестно.
17.1.4. Клеточный цикл и клеточное развитие
Клеточным развитием (англ. cell development) называется сочетание процессов роста и размножения.
Центральным модельным объектом при изучении соотношения между клеточным циклом и клеточным развитием служит стебельковая бактерия Caulobacter cres- centus (класс «Alphaproteobactena»). Она обладает диморфным клеточным циклом и образует два морфо-функционально разных типа клеток — стебельковые клетки и швермеры.
Стебельковая клетка (англ. stalked cell) играет роль вегетативной, или стволовой клетки (англ. stem cell). Она прикрепляется к субстрату или к другим клеткам при помощи стебелька. Стебелек (англ. stalk) представляет собой трубчатый вырост периплазматического компартмента, образованный ОМ. На его дистальном конце образуется адгезивное устройство — прикрепительный диск (англ. hold fast — захват). Таким образом, в цитологическом плане стебелек принципиально отличается от простеки гифомикробов (см. раздел 17.3.2), которая образована всеми слоями оболочки, наполнена цитоплазматическим содержимым и служит каналом, по которому сестринская хромосома транспортируется в концевую почку. Стебелек не содержит транспортных и цитоплазматических белков, но с помощью периплазматических связывающих белков обеспечивает доставку питательных субстратов, в частности фосфатов, к транспортерам, расположенным внутри СМ.
Швермер (от нем. Schwärmer — роящийся; англ. swarmer cell), снабженный жгутиком и фимбриями, представляет собой активную дифференцированную клетку. За счет свободного плавания, используя систему хемотаксиса, он играет роль агента пространственного распространения (см. раздел 17.5.1.1).
После репликации и расхождения дочерних хромосом (см. раздел 16.4-11 и рис. 186) на полюсе, противоположном стебельку, образуются хеморецепторы и жгутик. В экваториальной части материнской клетки собирается кольцо деления. В результате асимметричного деления возникает апикальная дочерняя клетка (т. е. швермер) и базальная дочерняя клетка (т. е. стебельковая клетка). Последняя инициирует новый раунд репликации, воспроизводит свою программу развития и т. д.
Швермер не способен к репликации; выполнив свою задачу, он завершает индивидуальную программу развития — дедифференцируется в стебельковую клетку. Жгутик сбрасывается, фимбрии втягиваются, а на их месте образуется стебелек с концевым прикрепительным диском. Размер стебелька определяется глобальным регулятором фосфорного метаболизма Pho (см. раздел 18.3.2.4).
В частности, стебелек имеет длину ~1 мкм при избытке фосфора и >30 мкм при фосфорном голодании. За счет образования стебелька увеличивается относительная площадь клеточной поверхности. Кроме того, он служит чем-то вроде телескопического устройства, которое выдвигает клетку в область с более активной диффузией питательных субстратов. Дифференциация швермеров является физиологически целесообразной реакцией на олиготрофные условия внешней среды. Таким способом снижается острота взаимной конкуренции за питательные субстраты и обеспечивается расселение популяции; неудивительно, что данной стадии отводится ~25% времени клеточного цикла.
Клеточный цикл С. crescentus состоит из последовательно сменяющих друг друга фаз, на фоне которых развертываются процессы развития:
— I (образование фимбрий —> подвижность и хемотаксис —> сбрасывание жгутика и втягивание фимбрий —> начало образования стебелька);
— С (инициация репликации —> завершение образования стебелька —> рост клетки —> образование жгутика —> терминация репликации);
— D (расхождение дочерних хромосом —> деление).
Координацию клеточного цикла с развитием обеспечивает анизотропное распределение регуляторных систем в материнской клетке, подготавливающейся к делению (рис. 224). Благодаря этому после асимметричного деления каждая из дочерних клеток получает отдельную программу для развития.
Рис. 224. Анизотропное распределение компонентов регуляторных систем в фазе диморфного клеточного цикла Caulobacter crescentus. Объяснение в тексте.
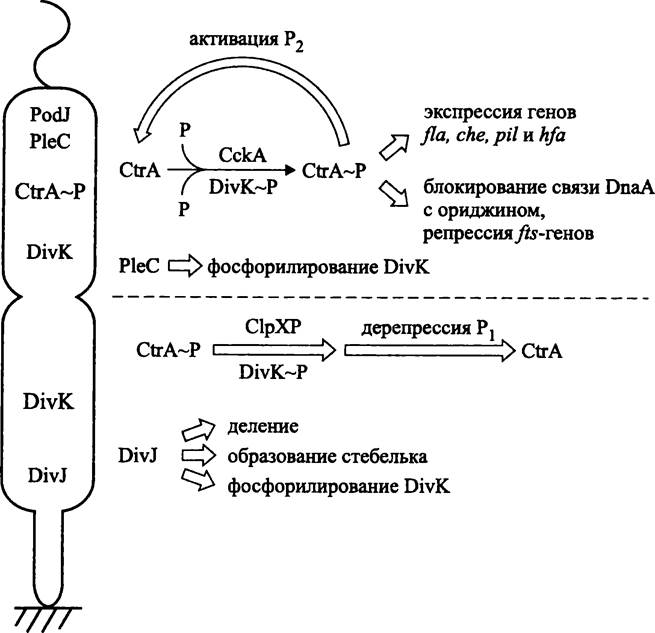
В клетке накануне деления (англ. predivisional cell) гистидинкиназы PleC и DivJ неравномерно распределяются на противоположных полюсах. Первая из них преимущественно локализуется на жгутиковом полюсе с помощью вспомогательного белка PodJ, вторая — на стебельковом полюсе. Третья гистидинкиназа, СскА приурочена к жгутиковому полюсу. Вопрос о том, каким образом эти белки в нужный момент клеточного цикла находят «свои» полюсы, еще не выяснен. В частности, за привлечение гистидинкиназы PleC к жгутиковому полюсу может отвечать белок PodJ (см. раздел 17.3.2).
Четвертая гистидинкиназа, DivK, равномерно распределяется в клетке накануне деления, но отсутствует в швермере.
Гистидинкиназа PleC участвует в регуляторном каскаде, или фосфореле (см. раздел 18.2). Она служит сенсором и фосфорилирует гистидинкиназу DivK, которая, в свою очередь, фосфорилирует регуляторный белок CtrA (см. ниже). Кроме того, она контролирует морфогенез швермера и его подвижность.
В ходе дедифференциации гистидинкиназа DivJ замещает гистидинкиназу PleC и фосфорилирует гистидинкиназу DivK, а также позитивно регулирует рост стебелька и клеточное деление.
Таким образом, взаимная изоляция гистидинкиназ PleC, DivJ и СскА (главного донора фосфорильной группы) в разной степени влияет на активность киназы DivK.
Причина того, что в швермере заблокирована инициация репликации и что он не способен делиться, связана с активностью глобального регулятора — белка CtrA (сокр. англ. cell cycletranscription regulator), который фосфорилируется гистидин- киназами DivK и СскА.
В стебельковой клетке белок CtrA отсутствует. Его активная фосфорилирован- ная форма начинает накапливаться только в клетке накануне деления и в высокой концентрации содержится в швермере. За счет кооперативного связывания белка CtrA~P с несколькими сайтами локуса Cori (см. раздел 16.4-2.1) белок DnaA вытесняется из праймосомы, что препятствует инициации репликации. Кроме того, белок CtrA~P репрессирует транскрипцию генов ftsAIQWZ, продукты которых образуют кольцо деления. В то же время белок Ctr А~Р активирует экспрессию генов жгутикового оперона fia, генов оперона хемотаксиса che, гена фимбрии pilА и генов прикрепительного диска hfABD (рис. 224).
Переход швермера к сидячему образу жизни связан с ускоренным синтезом сигнальных молекул цикло-ди-ГМФ с помощью гуанилатциклазы PleD (см. раздел
18.4.2).
Центральное событие при дедифференциации швермера — это протеолитическое разрушение белка CtrA~P под воздействием АТФ-зависимых протеаз ClpXP (сокр. англ. chymotrypsin-like protease). В качестве копротеазы выступает гистидинкиназа DivK~P. Протеолиз белка CtrA~P дерепрессирует инициацию репликации и транскрипцию fts-генов в образующейся стебельковой клетке (рис. 224).
Возобновление синтеза белка CtrA в стебельковой клетке накануне деления связано с тем, что его фосфорилированная форма, CtrA~P оказывает двоякое воздействие на промоторы собственного гена (ctrА). Белок CtrA~P репрессирует сильный upstream-промотор P1 и активирует слабый downstream-промотор Р2. Поэтому, когда белок CtrA~Pразрушается при дедифференциации швермера, промотор P1 дерепрессируется.
Таким образом, главным checkpoint’oм в клеточном цикле С. crescentus служит репликация ДНК, влияющая на изменение уровня фосфорилирования белка CtrA.
Установлено, что в ходе развития С. crescentus дифференциально экспрессируются 15% генов. После того, как все они будут аннотированы, сценарий регуляции клеточного цикла станет окончательно понятным.
17.1.5. Особенности клеточного цикла у архей
Мы уже не раз отмечали, что центральное место в клеточном цикле играет репликативная фаза. Ее специфика зависит, в частности, от того, сколько ориджинов одновременно существует в одной хромосоме, сколько репликационных вилок образуется в зависимости от времени генерации, и какова скорость элонгации, т. е. темп включения нуклеотидов врастушую цепь ДНК.
Археи из фил АI Crenarchaeota и АII Euryarchaeota сильно отличаются друг от друга по организации репликативного аппарата и, соответственно, по структуре клеточного цикла. Так, хромосомы кренархеотов содержат несколько ориджинов, а хромосомы эвриархеотов — только один (см. раздел 16.4.1.1). Если у кренархеотов, в частности Sulfolobum sрр., наблюдается пауза между репликацией и сегрегацией сестринских хромосом (аналог эукариотной фазы G2), то у эвриархеотов, например, Methanothermobacter thermautotrophicus, эти процессы накладываются друг на друга.
Эвриархеоты используют такой же, как бактерии, механизм репликации хромосомы (один ориджин; быстрая элонгация; см. раздел 16.4.1.1) и такой же FtsZ- зависимый механизм клеточного деления (см. раздел 17.4.2).
Кренархеоты, напротив, проявляют удивительное сходство с эукариотами (несколько ориджинов; медленная элонгация; длинная фаза G2). Так же, как у эукариотов, их хромосомы конденсируются и попарно объединяются на экваторе перед расхождением к полюсам делящейся клетки. Наконец, инициаторные белки Оrс1/Сdс6 Sulfolobus acidocaldariusдифференциально экспрессируются в ходе кле
точного цикла, по аналогии с эукариотными циклинами.