МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ III - А. В. ПИНЕВИЧ - 2009
ГЛАВА 18. РЕГУЛЯЦИЯ
18.2. Посттранскрипционная регуляция
Решающее значение для экспрессии генов имеет регуляция транскрипции, в особенности на стадии инициации (см. разделы 16.7.1.1 и 18.1.1).
С регуляцией транскрипции тесно связана посттранскрипционная регуляция, объектом которой служит наиболее вариабельный продукт транскрипции — мРНК.
Механизм контроля на данном регуляторном уровне заключается в том. чтобы заблокировать мРНК или поспособствовать ее деградации, а в качестве контролирующих факторов могут выступать либо регуляторные белки, либо регуляторные РНК.
18.2.1. Регуляторные белки
Регуляторные белки непосредственно связываются с мРНК, активируя или подавляя процесс трансляции. В качестве примеров приведем аконитазу, а также белки CrsA и RsmA.
Аконитаза. С помощью фермента аконитазы цитрат изомеризуется в изоцитрат; интермедиатом этой реакции служит cis-аконитат. Это единственный фермент цикла Кребса (см. II том учебника), содержащий редокс-лабильные [Fe4S4]- кластеры, что позволяет ему служить сенсором молекулярного кислорода.
Аконитаза Е. coli представлена двумя изоформами: АсnА и АсnВ. Первая из них образуется в стационарной фазе роста в условиях окислительного стресса (см. раздел 19.1.6), а вторая -при экспоненциальном росте. Хотя обе они теряют свой железосерный кластер при окислении кислородом, аконитаза АспА проявляет более
высокую устойчивость, чем аконитаза АспВ. Образующийся апо-АспВ связывается с мРНК ряда защитных белков, в частности с мРНК супероксиддисмутазы (sodA), и стимулирует ее трансляцию за счет повышения стабильности транскрипта.
Белки CsrA и RsmA. Эти взаимно гомологичные регуляторные белки являются частью регуляторных систем Csr и Rsm, под негативным контролем которых находятся гены первичного или вторичного метаболизма. Они связываются с мРНК- мишенями и подавляют их трансляцию.
Csr-регулон Е. coli (сокр. англ. carbon storage regulation) негативно контролирует ряд процессов первичного метаболизма. Белок CsrA связывается с мРНК, в результате чего репрессируется транспорт пептидов, глюконеогенез и метаболизм гликогена.
В свою очередь, Rsm-регулон (сокр. англ. regulator of secondary metabolism) участвует в негативном контроле вторичного метаболизма. Белок RsmA связывается с мРНК, вследствие чего подавляется образование некоторых вторичных метаболитов, в частности, ответственных за чувство кворума (см. раздел 18.4.2).
18.2.2. Регуляторные РНК
Регуляторные РНК относятся к гетерогенному семейству некодирующих РНК (англ. non-coding RNA). Иными словами, это не кодирущие мРНК. Из понятия «некодирующие РНК» принято исключать рРНК и тРНК, хотя они также не выполняют кодирующую функцию (см. раздел 16.3.1).
Некодирующие РНК подразделяются на антисмысловые РНК и малые РНК, причем те и другие могут выступать в роли посттранскрипционных регуляторов.
Антисмысловые РНК и малые РНК (общие сведения). Чтобы разъяснить содержание термина «антисмысловая» РНК, напомним, что «смысловой» РНК (англ, sense RNA) называется мРНК. Смысловая РНК также называется «кодирующей» РНК (англ. coding RNA), или «плюс» РНК (+РНК). Если не принимать во внимание повсеместную замену ДНК-ового тимина на РНК-овый урацил, то смысловая РНК имеет одинаковую нуклеотидную последовательность с нематричной цепью ДНК, т. е. они колинеарны. В свою очередь, антисмысловая РНК (англ. antisense RNA) имеет последовательность, антипараллельную последовательности смысловой РНК, т. е. они взаимно комплементарны. Антисмысловая РНК также называется некодирующей РНК (англ. non-coding RNA), или «минус» РНК (-РНК). Смысловая РНК и антисмысловая РНК транскрибируются с взаимно комплементарных цепей одной и той же молекулы ДНК с использованием противоположно ориентированных промоторов (см. раздел 16.7.1).
Малые РНК (англ. small RNA, sRNA; «малыми» они названы из-за своего сравнительно небольшого размера, 40-400 н., хотя ближе к верхней границе это уже достаточно крупные молекулы, так что данный термин не следует понимать буквально) представляют собой транскрипты иного рода. В то время как антисмысловые РНК считываются с нематричной, или отстающей цепи ДНК, гены малых РНК расположены на матричной, или ведущей цепи ДНК, т. е. они котранскрибируются с генами мРНК (рис. 255).
Антисмысловые РНК. Поскольку смысловая +РНК и антисмысловая -РНК взаимно комплементарны, они могут образовывать ± дуплекс, стабилизированный водородными связями между азотистыми основаниями (рис. 255).
Рис. 255. Образование антисмысловых РНК и малых РНК (sРНК) и их взаимодействие с мишенями РНК. А — антисмысловая РНК; Б — малая РНК.
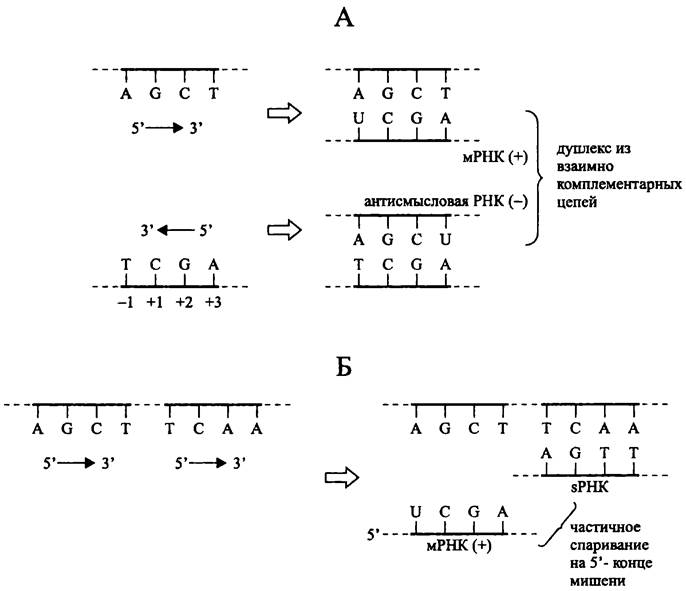
Мишенью для антисмысловой РНК обычно служит позиционно совпадающая с ней мРНК. Реже ген, кодирующий РНК-мишень, и локус, с которого транскрибируется антисмысловая РНК, находятся на взаимном удалении.
Образование дуплекса мРНК с антисмысловой РНК препятствует инициации трансляции, поскольку конкурентно блокируется связывание 3'-конца 16S рРНК с боксом Шайна-Дальгарно (см. ниже), который предшествует старт-кодону AUG.
В некоторых случаях антисмысловые РНК не только гибридизуются с РНК- мишенью, но и выступают в роли рибозимов (англ. ribozyme), т. е. катализируют ее ферментативное расщепление.
Известны также случаи антисмысловой регуляции не только инициации трансляции, но и репликации. Классическим примером служит регулирование копийности плазмиды ColE1, когда антисмысловая РНК I блокирует РНК II-праймер (см. раздел 16.7.4).
В широком плане, антисмысловые последовательности представляют собой природные или синтетические поли(дезокси)рибонуклеотиды, которые специфически распознают и блокируют смысловые последовательности нуклеиновых кислот. При этом следует иметь в виду, что ряд мишеней (например, участки ДНК, не являющиеся структурными генами, а также не-мРНК) не относится к числу кодирующих и, строго говоря, не попадает под определение смысловых последовательностей.
Антисмысловые механизмы широко используются в природной регуляции экспрессии генов. Они служат орудием экспериментальных исследований и основой для разработки терапевтических препаратов.
В отличие от регуляторов транскрипции факторы, регулирующие трансляцию, менее изучены. В этом отношении антисмысловые последовательности являются исключением.
Их эффект ярко проявляется на этапе инициации, тогда как элонгация блокируется только очень прочно связывающимися антисмысловыми последовательностями, что объясняется высокой процессивностью рибосомы.
Малые РНК. В настоящее время у энтеробактерий, в первую очередь у Е. coli, выявлено >70 малых РНК. Предполагается, что геномы этих бактерий содержат до 200-300 генов малых РНК, что составляет 5% числа структурных генов.
Чаще всего роль малых РНК неизвестна, однако примерно для 20 из них она все же установлена.
Малые РНК с транспортной и/или метаболической функцией. К этой группе относится 4,5S РНК, которая входит в состав РНК-белкового комплекса, участвующего в работе SRP-варианта генеральной секреторной Sec-системы (см. I том учебника).
Друг ая малая РНК размером 350-450 н. входит, в качестве каталитической субъединицы (рибозима), в состав рибонуклеопротеинового комплекса РНКазы Р — незаменимого фермента всех живых клеток, который обеспечивает созревание, т. е. посттранскрипционный процессинг 5'-конца тРНК.
Третья малая РНК, RyhB образует дуплекс с мРНК-мишенью, чему способствует шаперон для РНК — белок Hfq (см. ниже). РНК-мишень в составе такого дуплекса быстро разрушается под воздействием РНКазы Е — одного из ферментных компонентов деградосомы (см. I том учебника, а также раздел 16.7.5 настоящего тома).
Малые РНК-имитаторы. Они подменяют собой функционально важные сайты либо в ДНК, либо в РНК из другого класса.
Например, 6S РНК напоминает по структуре открытый промотор и ингибирует транскрипцию, действуя непосредственно на уровне голофермента РНК-полимеразы Еσ70. Она связывается с активным центром и блокирует его присоединение к промоторным участкам. В то время как транскрипция с σ70-зависимых промоторов подавляется, транскрипция с σS-зависимых промоторов, напротив, активируется, что способствует адаптации к условиям общего стресса (см. выше).
Другой пример — малые РНК CsrB и CsrC. Они служат антагонистами регуляторного белка CsrA, который связывается с боксом Шайна-Дальгарно в мРНК glgC, cstA и pgaА и блокирует их трансляцию (см. раздел 18.2.1). Малые РНК CsrB и CsrC «изолируют» белок CsrA, поскольку они содержат множественные повторы, гомологичные сайтам его узнавания в мРНК.
Регуляторные малые РНК. Они наиболее распространены и участвуют в посттранскрипционной регуляции, контролируя инициацию трансляции.
Регуляторные малые РНК содержат небольшие (около 20 н.) участки, гомологичные нетранслируемому 5'-концу мРНК и образуют с ним «несовершенные» дуплексы. В зависимости от положения сайта связывания с мишенью они подразделяются на две группы.
Представители первой группы образуют дуплекс в боксе Шайна-Дальгарно (часть лидерной последовательности на 5'-конце мРНК, имеющая консенсусную структуру AGGAGG) или непосредственно рядом с ним, что блокирует трансляцию и дестабилизирует транскрипт.
Представители второй группы образуют дуплекс с мишенью левее (upstream) бокса Шайна-Дальгарно, что приводит к изменению вторичной структуры мРНК и стимулирует связывание транскрипта с рибосомой.
Образованию дуплекса регуляторной малой РНК с мишенью способствует белок Hfq (сокр. англ. host factor for bactériophage Q|3 réplication), играющий роль гиаперона для РНК. Он гомологичен эукариотным Sm-белкам (сокр. англ. small ribonucleo- protein), которые вместе с малыми ядерными РНК (англ. small nuclear RNA, snRNA) образуют кор сплайсосомы — рибонуклеопротеинового комплекса, придающего пре- мРНК конформацию, необходимую для сплайсинга нитронов. Кроме того, он гомологичен эукариотным Lsm-белкам (сокр. англ. like Sm), которые входят в состав сплайсосомы совместно с Sm-белками и участвуют в декэппировании и деградации мРНК.
Белок Hfq широко, хотя и не универсально, представлен у бактерий (в частности, он отсутствует у представителей фил BIV Deinococcus- Thermus, ВХ Cyanobacteria, BXIV Actinobacteria и BXVI Chlamydiae). По аналогии с Sm-белками, гексагональные кольца белка Hfq связываются с AU-богатыми участками РНК.
У бактерий регуляторные малые РНК выступают в роли координаторов адаптационных процессов, обеспечивая ответ на изменившиеся условия внешней среды; их образование индуцируется в условиях стресса. Приведем наиболее интересные примеры.
Малые РНК MicF (93 н.) и MicC (109 н.). Они негативно регулируют синтез поринов OmpF/OmpC, связываясь с соответствующими мРНК, и, наряду с малыми РНК InvR, MicA, OmrA, OmrB, RseX и RybB участвуют в клеточном ответе при периплазматическом стрессе (см. раздел 19.2). У энтеробактерий, в частности Е. coli и Salmonella spp., такой ответ обеспечивается модулоном σЕ и связан с тонким контролем над составом поринов.
Напомним, что тримеры поринов общего назначения, или «осмопоринов» OmpF и ОmрС формируют в ОМ гидрофильные поры и участвуют в осмоадаптации, а также обеспечивают устойчивость к поступающим извне вредным для бактерий соединениям, например, желчным кислотам (см. I том учебника). OmpC-поры имеют меньший диаметр и доминируют при высоком осмотическом давлении, в частности при изобилии питательных субстратов. В противоположной ситуации, при низком осмотическом давлении, начинают доминировать OmpF-поры.
Дифференциальное образование поринов OmpF и ОmрС контролируется на посттранскрипционном уровне двухкомпонентной сигнальной системой. Роль сенсора, расположенного в СМ, выполняет белок EnvZ, который фосфорилирует регулятор OmpR. Белок OmpR~P подавляет транскрипцию гена малой РНК MicC и активирует транскрипцию гена малой РНК MicF. В свою очередь, эти малые РНК негативно контролируют трансляцию мРНК поринов ОmрС и OmpF.
Малая РНК OxyS (109 н). Г ен этой малой РНК входит в состав регуло- на OxyR. Ее синтез индуцируется при окислительном стрессе (см. раздел 19.1.6), и она играет роль негативного регулятора, образуя дуплекс с мРНК активатора транскрипции — белка FhlA. Вследствие этого подавляется образование FhlA-зависимых ферментов, содержащих металлические кофакторы. Поскольку при стрессе последние подвергаются неконтролируемому окислению, что опасно для клетки, значение такой адаптивной реакции очевидно.
Малая РНК DsrA (87 н.). Синтез этой малой РНК индуцируется при холодовом шоке (см. раздел 19.1.1). Она играет роль позитивного регулятора, образуя дуплекс с мРНК сигма-фактора σS (rpoS), что не до конца выясненным путем дает эффект активации трансляции.
Малые РНК, контролирующие патогенез. У грамположительной бактерии Staphylococcus aureus малая РНК III (514 н.) контролирует экспрессию факторов вирулентности. Ее ген входит в состав модулона Agr (сокр. англ. autoinducing growth regulator), отвечающего за образование адгезинов и гемолизинов, а также протеаз и других литических ферментов. Аналогичным образом, у грамотрицательной бактерии Pseudomonas aeruginosa малые РНК RsmY и RsmZ регулируют образование экзотоксинов.