МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ III - А. В. ПИНЕВИЧ - 2009
ГЛАВА 18. РЕГУЛЯЦИЯ
18.3. Регуляция метаболизма
Метаболизм (энергетический и конструктивный; генеральный и специализированный; эндогенный и основанный на использовании экзогенных субстратов) находится под контролем многих регуляторных систем, которые действуют как автономно, так и взаимосвязанно, т. е. в сети.
Адаптивно регулируя свой метаболизм, прокариоты растут и размножаются в соответствии с внешними трофическими ресурсами, причем не только в благоприятных условиях, но и при стрессах. В природной среде обитания физиологической нормой чаще всего является именно стресс, хотя большинство данных о регуляции метаболизма получено при лабораторных экспериментах в комфортном экологическом климате.
18.3.1. Регуляция энергетического метаболизма
Источник энергии, наряду со строительным материалом, необходим для поддержания информационных процессов и ведения домашнего хозяйства. Неудивительно, что системы, отвечающие за использование источника энергии, эффективно регулируются.
В отличие от конструктивного метаболизма, который, как правило, контролируют химические сигналы, энергетический метаболизм зависит от двух принципиально разных сигналов — светового при фототрофии и химического при хемотрофии.
18.3.1.1. Регуляция фототрофии
Живые организмы могут использовать свет по двум назначениям — как экзогенный источник энергии и как внешний сигнал, регулирующий метаболизм и/или поведение.
Энергетические аспекты фототрофии мы уже рассматривали во II томе учебника. Теперь же остановимся на фоторегуляции метаболизма, прежде всего на регуляции фототрофии, а роль света в контроле поведения обсудим отдельно в разделе 18.4.1.
У прокариотов описан ряд фоторецепторов, содержащих сенсорный и регуляторный модули. Сенсорный модуль регистрирует световой «климат» и передает сигнал регуляторному модулю, который обеспечивает адаптивный ответ.
Сенсорный модуль фоторецептора обладает антенными свойствами, т. е. интенсивно поглощает свет в определенной части спектра. Для этого в нем имеется специальный резонатор электромагнитного излучения, или хромофор.
Хромофоры. Хромофор связан с сенсорным модулем фоторецептора либо ковалентно, либо нековалентно, т. е. в качестве лиганда. В первом случае фоторецептор представляет собой окрашенный белок, или хромопротеин, во втором случае это пигментбелковый комплекс.
При поглощении света видимой (или соседней с ней) части спектра хромофоры изменяют свою конформацию, что обратимо влияет на структуру апопротеина и тем самым активирует фоторецептор. По непонятной причине природное разнообразие фоторецепторных хромофоров крайне ограниченно. К ним относятся:
— ретиналь, или полиизопреноид, входящий в состав ретинопротеинов (см. II том учебника и раздел 18.4.1.2 настоящего тома);
— биливердин, или ациклический тетрапиррол, входящий в состав бактериофи- тохромов (см. рис. 256);
— n-гидроксикоричная кислота, или мононенасыщенная жирная кислота с ароматическим кольцом, входящая в состав фотоактивного желтого белка PYP (см. раздел 18.4.1.2);
— ФМH, или нековалентно связанный флавиновый аденинмононуклеотид (см. II том учебника);
— ФАД, или нековалентно связанный флавиновый адениндинуклеотид (см. II том учебника).
Функциональная роль флавиновых фоторецепторов, которые имеются не только у фототрофов, но встречаются и у хемотрофных бактерий, например, В. subtilis, известна лишь в немногих случаях. В качестве примера назовем ФМН-содержащий сенсорный домен LOV (сокр. англ. light control of virulence; гистидинкиназа с сенсорным доменом LOV активирует проникновение в макрофаги патогенной бактерии Brucella abortus), а также ФАД-содержащие сенсорные домены BLUF (сокр. англ. blue-light flavoprotein) и CRY (сокр. англ. cryptochrome).
Рецепторные белки (общие сведения). Рецепторные белки используются регуляторными системами, с помощью которых живые организмы оценивают состояние окружающей среды и адаптивно изменяют характер своего метаболизма или развития в ответ на изменение ее физико-химических параметров. Прямое взаимодействие рецепторных белков с физико-химическими стимулами порождает сигнал, передаваемый исполнителю ответа.
Как правило, терминальные модули рецепторных белков функционально специализированы. N-концевой сенсорный модуль активируется под воздействием внешнего или внутреннего стимула, посредством конформационного изменения своей полипептидной цепи. С-концевой сигнальный модуль активируется сенсорным модулем и взаимодействует с сигнальной системой, состоящей из проводника сигнала и регулятора ответа.
Рецепторные белки прокариотов подразделяются на три большие группы:
— сенсорные гистидинкиназы, входящие в состав двухкомпонентных сигнальных систем (см. раздел 18.1.1.3);
— трансдукторы сигнала при хемотаксисе, также известные под названием «хеморецепторы», или «метилакцепторные белки хемотаксиса» (см. раздел 18.4.1.1);
— дигуанилатциклазы, или ферменты, которые синтезируют циклический динуклеотид цикло-ди-ГМФ, участвующий в контроле транскрипции (см. раздел 18.4.2).
Сенсорные модули всех трех групп рецепторных белков содержат консервативные сенсорные домены из нескольких десятков аминокислотных остатков. Эти домены, в свою очередь, связывают низкомолекулярные кофакторы, или простетические группы (от лат. prosthesis — приставка). Они непосредственно воспринимают стимул, и от них во многом зависит специфичность сенсорного домена.
К числу важнейших сенсорных доменов относятся PAS-домен, или домен Рег- Arnt-Sim (сокр. англ. period clock protein-aryl hydrocarbon receptor nuclear translocator protein-single-mindedprotein; «целеустремленные» SIM-гены дрозофилы контролируют формирование стволовой части центральной нервной системы, а их гомологи у млекопитающих детерминируют эмбриональное и постэмбриональное развитие).
В последнее время описаны новые сенсорные домены — Cache-домены (сокр. англ. channels and chemotactic receptors), ESENS-домены (сокр. англ. extracellular sensing) и CHASE-домены (сокр. англ, cyclases/histidine kinases associated sensing extracellular).
Сенсорные PAS-домены распространены исключительно широко и входят в состав рецепторных белков у бактерий и архей, а также у грибов, растений, насекомых и позвоночных. Они осуществляют контроль разнообразных функций, в том числе со сложным фенотипическим проявлением. Как видно из расшифровки акронима «Per-Arnt-Sim», PAS-домены содержатся в гистидинкиназах и серин/треонинкиназах, хеморецепторах и фоторецепторах, белках циркадных ритмов, белках ионных каналов, фосфодиэстеразах циклических динуклеотидов, регуляторах ответа на гипоксию, регуляторах эмбрионального развития и формирования центральной нервной системы и т. д.
Хотя сенсорные PAS-домены всегда находятся внутри клетки, они могут реагировать как на внутренние, так и на внешние стимулы (небольшие лиганды, редокс-потенциал, кислород, свет). Мониторинг этих стимулов сводится «к общему знаменателю» и косвенно свидетельствует о состоянии энергообеспечения живой клетки.
Размер PAS-домена составляет ~100 а. о., и их число в регуляторных белках прокариотов варьирует от 1 до 6 (у ядерных организмов PAS-домены обычно парные). Например, число PAS- доменов в белке KinA В. subtilis, который участвует в раннем контроле споруляции (см. раздел 17.5.2.2), равно трем.
PAS-домены выявлены более, чем в 200 белках, имеющихся у представителей всех трех стволов глобального эволюционного древа, причем их прототипом является PAS-домен фотоактивного желтого белка PYP пурпурных бактерий (см. раздел 18.4.1.2).
Большинство PAS-доменов у прокариотов входит в состав сенсорных гистидинкиназ. N-конце- вой модуль этих ферментов либо самостоятельно воспринимает стимул, либо активируется «вышестоящим» сенсором-рецептором. В составе С-концевого модуля гистидинкиназы имеется консервативный остаток His, который подвергается автофосфорилированию. Затем фосфорильная группа переносится на остаток Asp на N-конце регулятора ответа. В результате этого выходной домен регулятора ответа получает возможность взаимодействовать с ДНК (если это транскрипционный фактор) или с регуляторным белком двигательного аппарата (при таксисах).
Фоторецепторные белки. Разнообразие фоторецепторных белков сводится к узкому набору эволюционно консервативных типов (см. ниже).
В силу особенности строения сенсорных модулей фоторецепторных белков, в первую очередь их РАS-доменов, способных воспринимать разные сигналы, регуляторное воздействие света на фототрофный метаболизм часто сочетается с регуляторным воздействием молекулярного кислорода.
Регуляция биогенеза аппарата квази-фототрофии. Экстремально галофильный археот Halobacterium salinarium, находящийся на ярком свету в аэробных условиях, получает энергию за счет дыхания. Недостаток кислорода вызывает быстрый переход к квази-фототрофии, что основано на использовании бактериородопсина в качестве протонофорной системы (см. II том учебника). Бактериоопсин, или апопротеин бактериородопсина кодируется геном bop, который входит в общий оперон с генами brр (сокр. англ. bacterioopsin relatedprotein) и bat (сокр. англ. bacterioopsin activator). Свет индуцирует экспрессию всех трех генов, а ген bat дополнительно активируется при низком парциальном давлении кислорода.
Свет и кислород не только регулируют экспрессию генов bгр и bat, но и непосредственно влияют на активность продуктов этих генов, белков Вrр и Bat.
Первый ретинопротеиновый фоторецептор — Вrр под воздействием света активирует синтез хромофора, который присоединяется к бактериоопсину Вор, в результате чего образуется бактериородопсин.
Второй ретинопротеиновый фоторецептор — Bat способен интегрировать световой и редокс-сигналы и с помощью общего промотора регулировать активность генов, отвечающих за квази-фототрофию (в частности, он позитивно контролирует экспрессию генов bop, bat и brр). Белок Bat содержит N-концевой PAS-домен, играющий роль сенсора кислорода, центральный светочувствительный PAS-домен и С-концевой ДНК-связывающий домен (с характерной структурой НТН; см. раздел
18.1.1.1). Световой сигнал сильнее редокс-сигнала, и на ярком свету бактериородопсин образуется даже в аэробных условиях.
Регуляция биогенеза аноксигенного фотосинтетического аппарата. У факультативно фототрофных бактерий, в частности у несерных пурпурных бактерий Rhodobacter sphacroides и R. capsulatus, биогенез фотосинтетического аппарата позитивно контролируется светом и негативно контролируется кислородом. Позитивный контроль способствует ассимиляции энергии света, а негативный служит частью механизма, с помощью которого предотвращаются вредные последствия накопления активных форм кислорода (см. раздел 19.1.6).
За биогенез фотосинтетического аппарата отвечают два оперона. Первый из них, puf (сокр. англ. photosynthetic unit орегоn f) состоит из генов, кодирующих апопротеины реакционного центра и апопротеины кор-антенны LHI, а также из генов, отвечающих за сборку комплекса реакционный центр/кор-антенна. Второй оперон, рис содержит структурные и регуляторные гены периферической антенны LHII (см. II том учебника).
Анаэробные условия. На ярком свету в анаэробных условиях активируются гены фотосинтетического аппарата, хотя сигналом служит не свет как таковой, а восстановленное состояние электрон-транспортной цепи. Позитивный контроль осуществляет двухкомпонентная сигнальная система RegB/RegA (в случае R. capsulatus), или PrrA/PrrB (сокр. англ. photosynthetic response regulator; в случае R. sphaeroides). С помощью электрон-транспортной цепи происходит восстановление дисульфидных связей в димере белка-сенсора. Он переходит в активную мономерную форму, автофосфорилируется и трансфосфорилирует белок-регулятор, который активирует транскрипцию.
В анаэробных условиях или при относительно низком содержании кислорода свет синей части спектра (~450 нм), потенциально опасный для клетки, выступает в роли негативного сигнала (англ. blue light effect). В данном случае фоторецептором служит белок АррА. Он содержит N-концевой BLUF-домен, редокс-чувствительный центральный домен и С-концевой домен, обладающий дисульфидредуктазной активностью. Белок АррА, активированный синим светом, восстанавливает дисульфидную связь в димерах репрессора PpsR (см. ниже), переводя его в активную мономерную форму.
Аэробные условия. В аэробных условиях гены фотосинтетического аппарата репрессируются. В данном случае контроль осуществляют вышеупомянутые двух-
компонентные сигнальные системы RegB/RegA или PrrA/PrrB. При взаимодействии с кислородом между двумя субъединицами сенсора образуются дисульфидные связи. Димерная форма неспособна к автофосфорилированию и не трансфосфорилирует регулятор, в результате чего тот не может активировать транскрипцию.
Дополнительно используется однокомпонентный негативный регулятор CrtJ (сокр. англ. carotenoid; в случае R. capsulatus), или его гомолог PpsR (сокр. англ. photosynthetic pigmentsynthesis; в случае R. sphaeroides). Они оба содержат PAS- домены, играющие роль сенсора кислорода. Мишенью для этих белков служат гены оперона рис, в частности, отвечающие за биосинтез каротиноидов и бактериохлорофилла.
При ингибировании биогенеза фотосинтетического аппарата его размер в результате двух последовательно проходящих клеточных делений уменьшается на порядок (см. I том учебника). Развивающийся энергетический стресс вынуждает факультативных фототрофов перейти на хемотрофию, а облигатные фототрофы начинают тратить резервные вещества и, когда те подходят к концу, теряют жизнеспособность.
Фотоакклиматизация с помощью бактериофитохрома. У некоторых фототрофных бактерий экспрессия фотосинтетических генов контролируется светом красной части спектра (~650 нм). В данном случае в качестве (фоторецептора используется бактериофитохром.
Бактериофитохром содержит два N-концевых домена, которые совместно связывают тетрапиррольный хромофор биливердин. Первый домен, GAF (сокр. англ. cGMP-phosphodiesterases, adenylate cyclases and FhlA; глобальный регулятор FhlA представляет собой транскрипционный фактор, активирующий формиат-гидрогенлиазную систему), принадлежит к суперсемейству PAS-доменов. Второй домен относится к семейству PHY (сокр. англ. phytochrome). С-концевой домен обладает гистидинкиназной активностью.
Под воздействием красного или «дальнего» красного света биливердин транс/цис-изомеризуется из формы Рr, которая имеет максимум поглощения в красном свете (сокр. англ. phytochrome, red-absorbing), в форму Pfr, максимум поглощения которой лежит в дальней красной области (сокр. англ. phytochrome, farred absorbing) (рис. 256).
Рис. 256. Хромофор бактериофитохрома (биливердин) и его обратимая изомеризация из трансформы (Рr) в цис-форму (Рr) под воздействием «дальнего» красного (fr) и красного (r) света.
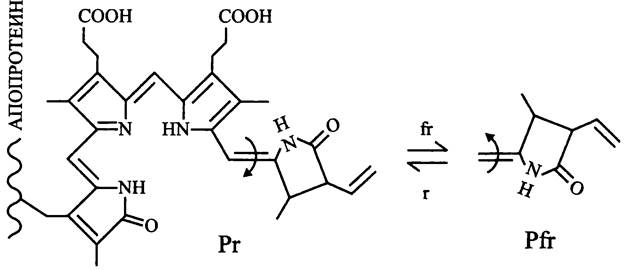
Изменяя количественное соотношение двух форм бактериофитохрома, пурпурная бактерия Rhodopseudomonas palustris осуществляет мониторинг качественного состава света и адаптивно изменяет состав своего антенного комплекса, т. е. фото- акклиматизируется.
Другим примером фотоакклиматизации с помощью бактериофитохрома служит комплементарная хроматическая адаптация (англ. complementary chromatic adaptation, ССА), происходящая у некоторых цианобактерий. Этот феномен заключается в том, что на зеленом свету (~550 нм) преимущественно синтезируется поглощающий именно этот свет красный фикобилипротеин-фикоэритрин, а на красном свету (~650 нм) — преимущественно поглощающий именно этот свет синий фикобилипро- теин-фикоцианин. В данном случае бактериофитохром RcaE (сокр. англ. receptor of chromatic adaptation) содержит сенсорный GAF-домен, который реагирует на зеленый и синий свет, а также
С-концевой гистидинкиназный домен. Красный свет стимулирует автокиназиую активность сенсора RcaE, а зеленый свет ее подавляет. В результате белок RcaE совместно с вторичным передатчиком RcaF и регулятором RcaC образуют фосфореле, которое контролирует синтез фикобилипротеинов.
18.3.1.2. Регуляция хемотрофии
Системы, контролирующие использование энергии окисления химических субстратов, разнообразны и многочисленны. Мы избирательно остановимся только на примере (ан)аэробного дыхания.
Выбор и использование терминального акцептора электронов для дыхательной цепи являются ключевыми моментами в биоэнергетической адаптации хемотрофов (см. II том учебника). Несмотря на негативные последствия контакта живых систем с молекулярным кислородом, терминальные кислородредуктазы наиболее выгодны в биологическом плане из-за максимальной эффективности ассимиляции энергии с помощью аэробной дыхательной цепи (см. раздел 19.1.6).
Хотя концентрация кислорода в атмосферном воздухе высока и относительно постоянна, его присутствие в отдельных глобальных и локальных нишах ограничивается рядом физико-химических и биотических факторов. В частности, это диффузионные барьеры и растворимость кислорода (зависящая от температуры и ионной силы среды), а также взаимная конкуренция аэробов за этот терминальный акцептор электронов. Поэтому неудивительно, что обратимый переход от аэробного метаболизма к анаэробному метаболизму, и, прежде всего, к анаэробному дыханию, является важным элементом экологической адаптации прокариотов и находится под контролем регуляторных систем. При этом стимулом служит либо сам молекулярный кислород, либо альтернативные терминальные акцепторы, особенно нитрат и нитрит.
Регуляторные системы, реагирующие на кислород или его заменители, могут быть как одно компонентным и, так и двухкомпонентными, причем анаэробное дыхание может регулироваться как негативно, так и позитивно.
Мастер-регулятор FNR. Ключевую роль в биоэнергетической адаптации факультативно анаэробных бактерий, в частности Е. coli, играет однокомпонентная сигнальная система — транскрипционный фактор FNR (сокр. англ. fumarate and nitrate regulation), влияющий на активность >100 генов.
FNR негативно контролирует экспрессию генов кислородредуктазного участка дыхательной цепи и одновременно с этим запускает транскрипцию генов, кодирующих «анаэробные» терминальные редуктазы (прежде всего, фумаратредуктазу и нитратредуктазу), а также ферменты анаэробного метаболизма, что позволяет бактериям адаптироваться к анаэробным и микроаэробным нишам.
Активная форма белка FNR представляет собой гомодимер 2 x 30 кДа. Отдельная субъединица содержит:
— N-концевой домен (служит сенсором молекулярного кислорода);
— С-концевой домен (обеспечивает связывание с ДНК);
— срединный домен (активирует РНК-полимеразу и участвует в димеризации).
Для образования гомодимера необходим молекулярный мостик, роль которогоиграет низкопотенциальный [Fе4S4]-кластер (см. II том учебника). В аэробных условиях он окисляется молекулярным кислородом в [Fе2S2]-кластер, неспособный обеспечить димеризацию. В микроазробных или анаэробных условиях [Fе2S2]-кластер восстанавливается в [Fе4S4]-кластер, субъединицы димеризуются, и регенерируется активная форма FNR, которая обладает сродством к специфическим участкам ДНК, или «FNR-боксам». FNR-боксы, ограниченные инвертированными повторами TTGAT... АТСАА, расположены по соседству с FNR-активируемыми промоторами. Запуск транскрипции генов анаэробного метаболизма обеспечивается не только ДНК-белковым, но и белок-белковым взаимодействием между срединным доменом белка FNR и сигма-фактором σ70.
FNR может быть не только активатором, но и репрессором. Во втором случае FNR-боксы находятся слишком близко от промоторов «анаэробных» генов, в результате чего FNRаллостерически подавляет РНК-полимеразу. На этом фоне конститутивно экспрессируются гены оперона ndh, кодирующие субъединицы «аэробной» НАДН-дегидрогеназы (см. II том учебника).
Регуляторные системы NarX/NarL и NarQ/NarP. Факультативно анаэробные бактерии, в частности Е. coli, обладают двухкомпонентными сигнальными системами NarX/NarL и NarQ/NarP, которые регулируют транскрипцию в зависимости от присутствия в окружающей среде анионов нитрата. С их помощью кислородное дыхание переключается на нитратное.
Транскрипционные регуляторы из семейства Nar (сокр. англ. nitrate reductase) влияют на экспрессию до 100 генов 12 оперонов, в том числе оперонов мембранной нитратредуктазы (narGHIJ), периплазматической нитратредуктазы (nарАВС), мембранной нитритредуктазы (nrfAH), периплазматической нитритредуктазы (nirST), формиатдегидрогеназы (fdhABC) и фумаратредуктазы (frdABCD).
Обе двухкомпонентные сигнальные системы состоят из взаимно гомологичных сенсоров (NarX и NarQ) и регуляторов (NarL и NarP). Интегральные белки NarX и NarQ реагируют на присутствие в периплазме, соответственно, анионов нитрата и нитрита.
Структура белков NаrХ и NаrQ обычна для сенсоров (см. раздел 18.1.1.3).
На С-конце расположен большой цитоплазматический домен из 420 а. о., а на N-конце — два трансмембранных субдомена по 60 а. о. Между трансмембранными субдоменами находится пери- плазматический субдомен (120 а. о.), в котором имеется «Р-бокс» (сокр. англ. periplasmic), изменяющий свою конформацию при связывании с анионами нитрата или нитрита.
Сигнал от периплазматического субдомена передается через один из двух трансмембранных субдоменов цитоплазматическому домену, который играет роль сенсорной гистидинкиназы и авто- фосфорилируется по остаткам His-370 или His-399.
Сенсоры NarX~P и NarQ~P, в свою очередь, фосфорилируют по остаткам Asp-59 цитозольные регуляторы NarL и NarP. Последние изменяют свою конформацию и вступают во взаимодействие с регуляторными участками оперонов-мишеней, а также непосредственно с РНК-полимеразой. Обратную связь обеспечивает конститутивная протеинфосфатаза, субстратом которой служат фосфорилированные белки NarX~P и NarQ~P. Ele активность повышается при отсутствии анионов нитрата и нитрита.
Регуляторная система АrсВ/АrсА. Двухкомпонентная сигнальная система АrсВ/АrсА используется наряду с системами FNR, NarX/NarL и NarQ/NarP. Она дополнительно активирует экспрессию >30 оперонов при росте Е. coli в анаэробных или микроаэробных условиях; прежде всего, мульти- и моноцистронных оперонов альтернативных терминальных редуктаз — фумаратредуктазы (frdABCD), мембранной нитратредуктазы (narGHIJ), кислородредуктазы bd (cytbd) и кислородредуктазы о (суо). Одновременно с этим она репрессирует моноцистронные опероны цикла Кребса — оперон аконитазы (асn), оперон сукцинатдегидрогеназы (sdh) и оперон цитратсинтазы (gltA).
Регуляторная система АrсВ/АrсА представлена сенсорной протеинкиназой АrсВ, связанной с СМ, и цитоплазматическим регулятором АrсА (рис. 257).
Рис. 257. Регуляторная система аэробного метаболизма АrсВ/АrсА. Объяснение в тексте.
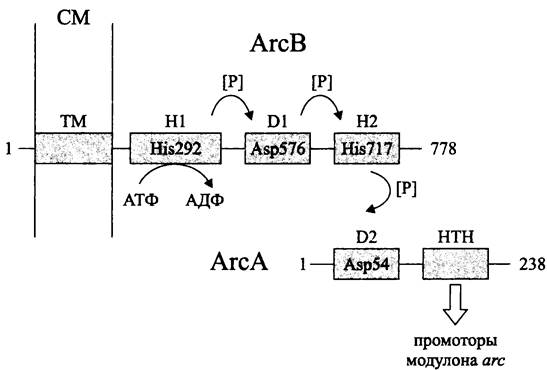
Белок АrсВ состоит из трансмембранного модуля ТМ и трех цитоплазматических модулей — H1 (первичного передатчика; англ. primary transmitter), D1 (первичного приемника; англ. receiver) и Н2 (вторичного передатчика; англ. secondary transmitter). Таким образом, белок АrсВ принадлежит к субсемейству «гибридных» сенсорных киназ (см. раздел 18.1.1.3).
Модуль Н1, содержащий PAS-домен, автофосфорилируется по остатку His-292. Затем фосфорильная группа переносится на остаток Asp-576 в модуле D1, а от него — на остаток His-717 в модуле Н2. Далее сигнал поступает на регулятор ответа АrсА; его модуль D2 (вторичный приемник; англ. secondary receiver) фосфорилируется по остатку Asp-54.
С-терминальный НТН-домен активированного регулятора АrсА взаимодействует с первичными мишенями — промоторами модулона arc.
Автофосфорилирование протеинкиназы АrсВ происходит в микроаэробных или анаэробных условиях. Важно отметить, что этот сенсор не напрямую воспринимает
кислород, а реагирует на редокс-состояние хинонного пула дыхательной цепи (см. II том учебника). В анаэробных условиях, когда этот пул восстановлен, восстанавливает дисульфидные связи между субъединицами белка АrсВ, переводя его в мономерную форму, неспособную к автофосфорилированию.
18.3.2. Регуляция конструктивного метаболизма
Эффективность конструктивного метаболизма зависит от баланса катаболических и анаболических реакций. Первые из них имеют ведущее значение для гетеротрофов, поскольку снабжают клетку не только строительным материалом, который используется в анаболических процессах, но и энергией. У автотрофов, напротив, анаболизм — на первом месте, а катаболизм вторичен и в основном служит для обновления клеточных структур, а также для мобилизации запасных веществ.
В анаболических процессах в первую очередь используются соединения углерода и азота (в случае диазотрофии — молекулярный азот). Здесь необходим полный комплект биогенных элементов, причем общий уровень метаболизма зависит от наименее доступного из них. В свою очередь, голодание, например, по сере, делает бессмысленным биосинтез аминокислот, поскольку образование цистеина и метионина заблокировано.
Как и другие регуляторные системы, контроль метаболизма следует принципам осознанной необходимости и разумной достаточности. Бактерии оценивают трофический статус окружающей среды и дают на него адаптационный ответ.
Для коррекции метаболических систем в соответствии с полученной информацией бактерии используют регуляторную сеть. Она координированно управляет отдельными ветвями метаболизма, в частности углеродной и азотной ветвью (см. ниже).
18.3.2.1. Регуляция синтеза рРНК
Синтез рРНК является ключевым метаболическим процессом. От него зависит образование каркаса рибосомы и, как следствие, эффективность трансляции — в том числе, эффективность трансляции мРНК, в которых закодированы ферментативные белки.
Уровень транскрипции rrn-генов соответствует насущной потребности в синтезе белка независимо от причины ее изменения (ингибиторы трансляции; сдвиг в составе питательной среды; голодание, особенно при строгом ответе; см. раздел 18.1.4). При быстром и умеренном росте потребность в синтезе белка особенно велика, а поскольку промоторы rrn-оперонов являются одними из наиболее сильных промоторов, они обеспечивают >50% валового объема транскрипции (см. раздел 16.7.1.1).
Для регуляции инициации транскрипции rrn-оперонов и элонгации рРНК используется ряд механизмов, изученных главным образом на примере Е. coli.
Напомним, что у этой бактерии имеются семь rrn-оперонов (см. раздел 16.3.1.2). Каждый из них содержит по два отдельных промотора, rrnР1 и rrnР2 с соответствующими терминаторами Т1 и Т2. В клетках, растущих с высокой или умеренной скоростью, транскрипция при участии главной РНК-полимеразы осуществляется в основном с сильных промоторов rmР1; более слабые промоторы rm Р2 реагируют на те же самые регуляторные воздействия, однако не столь активно.
В промоторах rrn Р1 существует регуляторный UP-элемент, расположенный левее консенсусного блока -35 (рис. 258). Взаимодействие этой AT-богатой последовательности с С-концевым доменом α-субъединицы РНК-полимеразы повышает транскрипцию на порядок (см. раздел 16.7.1.1). Кроме того, левее UP-элемента в регуляторной области содержатся 3-5 сайтов для связывания с ДНК-изгибающим белком Fis (напомним, что этот белок, в числе прочих, используется при сайтспецифичной рекомбинации; см. раздел 16.6.1.2). Димеры белка Fis взаимодействуют с С-концевым доменом α-субъединицы; это способствует рекрутированию РНК-полимеразы в область промотора и дополнительно повышает уровень транскрипции. Функциональным антагонистом белка Fis является ДНК-связывающий белок H-NS, который подавляет активность промоторов rrn Р1 в стационарной фазе роста; предполагается, что он фиксирует РНК-полимеразу в стабильной петле ДНК.
Рис. 258. Оперон рРНК. Р1 и Р2 — промоторы; Т1 и Т2 — терминаторы; ITS — внутренний транскрибируемый спейсер; Fis сайты для связывания ДНК-изгибающего белка Fis; UP — регуляторный UP-элемент.
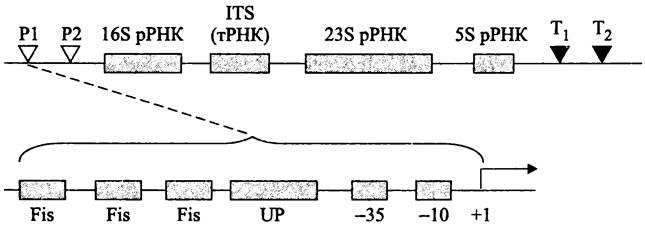
Оба ДНК-изгибающих белка, Fis и H-NS участвуют в контроле базового метаболизма рРНК. При медленном росте, а также в стационарной фазе белка Fis очень мало; напротив, белок H-NS накапливается именно в стационарной фазе. Однако, когда условия роста резко изменяются, к регуляции экспрессии rrn-оперонов привлекаются другие системы. В этих условиях за контроль промоторов rrn Р1 отвечают два типа регуляторных молекул — алармон (p)ppGpp и «инициирующие» нуклеозидтрифосфаты (англ. initiating nucleosidetriphosphate; iNTP).
Медиатор строгого ответа, (p)ppGpp накапливается в неблагоприятных условиях, в частности при голодании. Он понижает сродство РНК-полимеразы к промоторам rrn Р1 и сокращает время жизни открытого комплекса, в результате чего скорость роста резко падает (см. раздел 18.1.4).
«Инициирующий» транскрипцию нуклеозидтрифосфат — это АТФ для промоторов rrn Р1 в оперонах rmABCEGH и ГТФ для промоторов rrn Р1 в опероне rrnD. В отличие от остальных промоторов, для активности промоторов rrn Р1 требуется максимально высокая концентрация iNTP. Предполагается, что экспрессию rrn- генов непосредственно регулирует изменение концентрации инициирующих субстратов, которые продлевают время жизни открытого комплекса. В свою очередь, эти субстраты являются индикаторами внутриклеточного трофического статуса и косвенно свидетельствуют о трофических условиях окружающей среды.
При быстром или умеренном росте (р)ррGрр играет роль позитивного или негативного регулятора, в зависимости от улучшения или ухудшения трофической обстановки. В свою очередь, при выходе из стационарной фазы iNТР позитивно регулируют активность промоторов rrn Р1. Наконец, в стационарной фазе уменьшение концентрации iNTP или повышение концентрации (р)ррGрр действует на транскрипцию rrn-генов подавляюще.
18.3.2.2. Регуляция углеродного метаболизма
Когда в питательной среде одновременно присутствуют два или несколько углеводов, бактерия вначале использует один из них, а другие оставляет «на потом». Причина такой избирательности питания связана, в первую очередь, с регуляцией на уровне инициации транскрипции, которая осуществляется с помощью нескольких систем. Важнейшей из них является система репрессии углеродным катаболитом, которую довольно неудачно называют «катаболитной репрессией».
Катаболитная репрессия. Катаболитная репрессия, или репрессия углеродным катаболитом (англ. carbon catabolite repression, CCR) выражается в том, что присутствующий в питательной среде катаболизируемый субстрат, или катаболит препятствует использованию других катаболизируемых субстратов. Под катаболитом в узком смысле слова подразумевается предпочтительный источник углерода. Точнее сказать, если бактерия сталкивается с набором источников углерода, она выбирает тот из них, который используется наиболее эффективно. Еще точнее: когда в питательной среде содержится субстрат, обеспечивающий максимальную скорость роста, подавляется выработка ферментов, специфичных в отношении альтернативных субстратов.
Чаще всего катаболитом является глюкоза, а классическим примером катаболитной репрессии служит феномен глюкозо-лактозной диауксии Е. coli (англ. diauxie; от греч. duo — два и аихе — рост), когда рост на смеси глюкозы с лактозой происходит в два этапа, поскольку лактозный оперон активируется только после полного использования глюкозы. Следует отметить, что в случае адаптации к специфической нише вместо глюкозы предпочтительным может стать другой углевод, та же лактоза для Streptococcus thermophilus.
Феномен катаболитной репрессии, первоначально названный «глюкозным» эффектом, был открыт Динертом (F. Dienert) в 1900 г. на примере ингибирования глюкозой утилизации сопутствующих источников углерода. Детали этого явления долго оставались скрытыми, и лишь в 1968 г. Агнес Ульман (A. Ullmann) и Жак Моно обнаружили, что ингибирующий эффект глюкозы можно купировать с помощью 3',5'-цикло-АМФ (см. рис. 260). Год спустя Жаке (М. Jaquet) и Кипе (A. Kepes) установили, что глюкоза подавляет экспрессию генов на уровне инициации транскрипции.
Хотя феномен катаболитной репрессии внешне однообразен, за ним скрываются разные механизмы. Один механизм действует путем изменения активности транскрипционных факторов, другой — путем уменьшения концентрации индукторов (см. ниже).
В обоих механизмах используются компоненты фосфотрансферазной системы транспорта углеводов, которая дополнительно выполняет регуляторную роль (рис. 259).
Рис. 259. Регуляция углеродного метаболиза с помощью фосфотрансферазной транспортной системы. Объяснение в тексте.
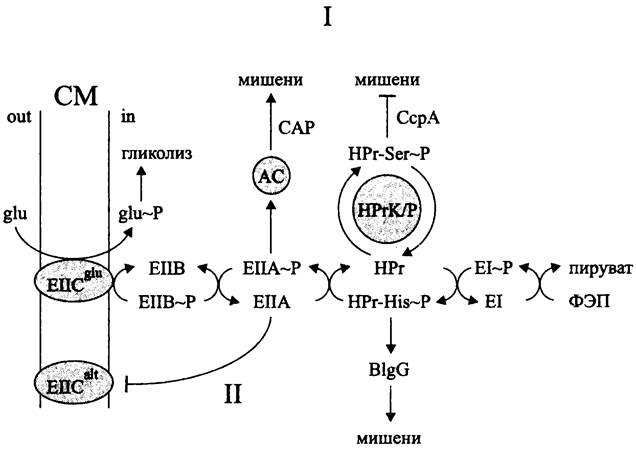
Напомним, что бактерии импортируют углеводы либо в фосфорилированном, либо в нефосфорилированном виде (см. II том учебника). Транспорт, сопряженный с фосфорилированием, или перенос (фосфатной) группы осуществляется при помощи фосфоэнолпируваг-фосфотрансферазной системы (англ. phosphoenolpyruvate: sugarphosphotranspherase system, PTS). Она состоит из трех основных компонентов (рис. 259):
— «фермента II» (англ. enzyme II. ЕII), или пермеазы, специфичной по отношению к тому или иному углеводу;
— белка НРг (сокр. англ. histidine-containing protein, НРг), который неизбирательно участвует в фосфорилировании любого углевода, транспортируемого с помощью данной системы;
— «фермента I» (англ. enzyme I, EI), который фосфорилирует белок НРr за счет фосфоэнол- пирувата.
Субстратспецифичные пермеазы (Е. coli имеет 20 таких систем, В. sub tills — 9; Lactococcus lactis — 8; Streptococcus pneumoniae — 9 и т. д.) состоят из 1-4 модулей (EIIABCD), из которых, по крайней мере, один интегрирован в СМ.Например, в случае Е. coli пермеаза глюкозы содержит два мембранных модуля EIICBglc и растворимый модуль ElIAglc.
Фосфорильная группа переносится по цепи: фосфоэнолпируват —> EI —> НРг v ЕIIА —> ЕIIВ —> ЕIIС/углевод. Таким образом, фосфорилирование углевода происходит сопряженно с его транслокацией в цитоплазму, т. е. он вступает в метаболизм уже в активированном виде.
Фосфотрансферазная система PTS представляет собой уникальный гибрид фосфореле (см. раздел 18.1.1.3) с аппаратом для активного импорта углеводов. В данном случае роль стимула выполняет интермедиат гликолиза — фосфоэнолпируват; сенсором служат компоненты фосфотрансферазной системы; регулятором- транскрипционные факторы.
Разные бактерии используют разные глобальные регуляторы в сочетании с системой PTS, причем у энтеробактерий регуляция носит позитивный, а у Firmicutes — негативный характер.
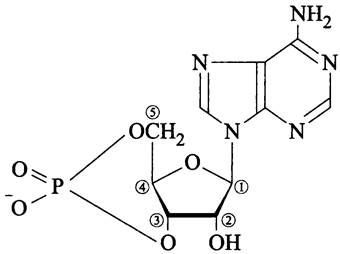
Рис. 260. 3',5'-цикло-АМФ (аденозин-3',5'- циклофосфат).
Стратегия энтеробактерий. Энтеробактерии, в частности Е. coli, в качестве PTS-ассоциированных транскрипционных факторов используют белки-активаторы катаболитных генов (сокр. англ. catabolite gene activator protein, CAP), которые принадлежат к семейству глобальных белков-активаторов транскрипции CRP (см. раздел 16.7.1.1).
Центральную роль в катаболитной репрессии в данном случае играет фосфо- трансфераза EIIAglc. Соотношение двух ее форм, нефосфорилированной и фосфорилированной (EIIAglc/EIIAglc ~Р), отражает трофический статус клетки, а фосфатная группа служит сигналом, который активирует гены-мишени.
В репрессирующих условиях (в присутствии глюкозы) фосфотрансферазная система PTS передает фосфорильные группы этому субстрату, и поэтому EIIAglc существует в основном в нефосфорилированной форме. В данном случае предпочтительно используемый углевод подавляет поглощение других углеводов, которые могли бы индуцировать опероны их собственного катаболизма. Такой вариант катаболитной репрессии называется недопущением, индуктора (англ. inducer exclusion). Нефосфорилированная форма EIIAglr связывается с пермеазами не-PTS типа, например, с пермеазами лактозы, мальтозы, мелибиозы или раффинозы и аллостерически блокирует их, в результате чего предотвращается образование соответствующего индуктора, в частности аллолактозы (см. раздел 16.3.1.2 и рис. 167). Поскольку в клетке индуктора и так недоставало, соответствующие опероны экспрессируются очень слабо или вообще выключаются.
В дерепрессирующих условиях (без глюкозы) EIIAglc существует в основном в фосфорилированной форме. В этом случае EIIAglc ~Р непосредственно стимулирует аденилатциклазу (англ, adenylate cyclase, СуаА). Активированная аденилатциклаза, в свою очередь, косвенно активирует контролируемые катаболитом гены-мишени за счет накопления аллостерического эффектора — 3',5'-цикло-АМФ (рис. 260), образующего комплекс с транскрипционным фактором САР.
Стратегия грамполоснсительных бактерий. Firmicutes, т. е. грамгюложительные бактерии с низким содержанием GC-nap, в частности В. subtüis и В. megаterium, используют в качестве транскрипционного фактора негативный регулятор — белок катаболитного контроля (сокр. англ. catabolite control protein, СсрА).
Центральную роль в катаболитной репрессии в данном случае играет функциональный эквивалент EIIAglc — фосфотрансфераза НРг. Она содержит два сайта фосфорилирования (His-15 и Ser-46). Фосфорилирование по сайту His-15 осуществляется с помощью фермента EI. В свою очередь, фосфорилирование по сайту Ser- 46 происходит, с помощью, отсутствующей у энтеробактерий АТФ-зависимой протеинкиназы/фосфатазы НРгК/Р (сокр. англ. histidine-containing protein kinase/phos- phatase).
Что определяет соотношение двух фосфорилированных форм фосфотрансферазы (HPr-His~P и HPr-Ser~P)?
Фосфорилирование НРr за счет фосфоэнолпирувата с помощью EI дает форму HPr-His~P, которая используется PTS-системой. По мере импорта глюкозы и накопления фосфорилированных интермедиатов гликолиза, прежде всего фруктозо-1,6- бисфосфата, активируется протеинкиназная активность НРгК/Р, в результате чего образуется HPr-Ser~P. Однако HPr-Ser~P не является субстратом для фермента EI и не участвует в импорте глюкозы, поэтому концентрация интермедиатов гликолиза снижается. В результате увеличения концентрации неорганического фосфата стимулируется фосфатазная активность НРгК/Р, и образуется субстрат для EI — дефосфорилированная форма белка НРг.
Белок HPr-Ser~P выполняет роль корепрессора для глобального транскрипционного фактора СсрА, в комплексе с которым он связывается с операторными сайтами сrе (сокр. англ. catabolite responsive element). В результате этого катаболитная репрессия распространяется на многочисленные гены и опероны: ars (гены ацетил- СоА-синтазы); bglPH (гены гидролиза и транспорта β-гликозидов); gnt (гены использования глюконата); hut (гены использования гистидина); lev (гены транспорта фруктозы и деградации левана); mbgA (гены β-галактозидазы); xyl (гены использования ксилозы) и т. д.
У бацилл катаболитных оперонов несколько, в частности опероны утилизации β-гликозидов контролируются белками-антитерминаторами (см. раздел 16.7.1.3). Они относятся к семейству BglG (сокр. англ. beta glycoside utilization) и содержат так называемые PRD-домены (сокр. англ. PTS regulation domain), которые непосредственно определяют их активность. Белок HPr-His~P может фосфорилировать не только фермент ЕIIАglс, но и эти домены. Если PRD-домены не фосфорилируются, а это происходит при транспорте глюкозы с помощью PTS-системы, опероны утилизации β- гликозидов не индуцируются.
В заключение отметим, что система CCR обладает плейотропным регуляторным действием. Помимо контроля углеродного метаболизма, она участвует в выборе промоторов, азотном метаболизме, биогенезе жгутика, хемотаксисе, приобретении состояния компетентности и т. д. В целом под контролем САР-белков находится >100 генов (в том числе, их собственный ген), а под контролем белка СсрА ~300 генов.
Система CCR изучена только у энтеробактерий и Firmicutes, причем в основном на двух модельных объектах — Е. coli и В. subtilis. О механизме CCR у других бактерий, а также о прочих механизмах регуляции углеродного метаболизма почти ничего не известно.
Дополнительные системы регуляции углеродного метаболизма. Помимо PTS-зависимой CCR, к числу плейотропных факторов, регулирующих углеродный метаболизм энтеробактерий и грамположительных бактерий с низким содержанием GC-nap, относятся белок Сrа (сокр. англ. catabolite repressor activator) и МIс (сокр. англ. maltose control). Первый из них служит репрессором PTS-системы для фруктозы, а также активатором генов глюконеогенеза и цикла Кребса, причем
его активность зависит от двух интермедиатов гликолиза: фруктозо-1-фосфата и фруктозо-1,6-бисфосфата. В свою очередь, белок Мlс регулирует экспрессию генов PTS-систем для глюкозы и маннозы, а также гена-активатора мальтозного регулона — malT.
Наконец, у грамположительных бактерий с высоким содержанием GC-nap, в частности S. coelicolor, у которых отсутствует PTS-зависимая CCR, контроль углеродного метаболизма осуществляется с помощью глюкокиназы GlkA. Механизм регуляторного действия в данном случае не установлен.
18.3.2.3. Регуляция азотного метаболизма
Генетические и биохимические механизмы, лежащие в основе реr уляции азотного метаболизма, изучены в основном на примере энтеробактерий, прежде всего Е. coli
При азотном дефиците основным источником неорганического связанного азота становится катион аммония. При низкой концентрации NH+4центральную роль в его ассимиляции играет глутаминсинтетаза (англ. glutamine synthetase, GS), которая катализирует АТФ-зависимое амидирование L-глутамата в L-глутамин (см. II том учебника). При азотном голодании активность гена glnА, кодирующего этот фермент, резко возрастает.
Транскрипция гена glnА осуществляется с тандема промоторов gln Ap1 и glnAp2. Когда азот в избытке, ген glnA экспрессируется на базовом уровне с промотора glnApl при помощи главной РНК-полимеразы Еσ70 (см. раздел 16.7.1.1). Дефицит азота приводит к тому, что транскрипция гена glnA с промотора glnApl репрессируется регуляторным белком NtrC (см. ниже). Одновременно с этим белок NtrC активирует транскрипцию гена glnA с промотора glnAp2 при помощи голофермента РНК-полимеразы, содержащего альтернативный сигма-фактор σ54 (см. раздел 18.1.1.1).
Центры регуляторных сайтов, с которыми связывается белок NtrC, находятся слишком далеко от промоторов гена glnA (координаты -140 и -108). Чтобы NtrC смог вступить во взаимодействие с рекрутированной РНК-полимеразой, необходим изгиб ДНК. Обычно в таких случаях регуляторная область ведет себя как энхансер, изгибающий ДНК с помощью белка IHF (см. раздел 16.7.1.1). В данном же случае ДНК в регуляторной области изначально образует изгиб со структурой СС- СТТТТ и центром в положении -73.
Белок NtrC имеет трехдоменную структуру, типичную для σ54-зависимых регуляторов ответа — N-концевой домен-приемник размером ~120 а. о. с консервативным остатком Asp-54, центральный домен размером ~240 а. о. для рекрутирования РНК-полимеразы и С-концевой домен размером ~60 а. о. для связывания с энхансерной ДНК, содержащий структурный мотив НТН. Центральный домен обладает АТФазной активностью, и энергия гидролиза АТФ используется для перехода закрытого комплекса RPc в открытый комплекс RPo (см. раздел 16.7.1.1).
Ген glnA служит главной мишенью для сигнальной системы NtrB/NtrC (сокр. англ. nitrogen regulation).
Система NtrB/NtrC (рис. 261). Эта двухкомпонентная сигнальная система локализуется в цитоплазме. Белок NtrB играет роль сенсора, а белок NtrC — роль глобального регулятора.
Глобальная система контроля азотного метаболизма состоит из четырех ферментов:
— уридилтрансферазы/деуридилазы (англ. uridyltransferase/urydyl-removing enzyme, UT/UR);
Рис. 261. Регуляция азотного метаболизма с помощью двухкомпонентной сигнальной системы NtrВ/NtrС. Объяснение в тексте.
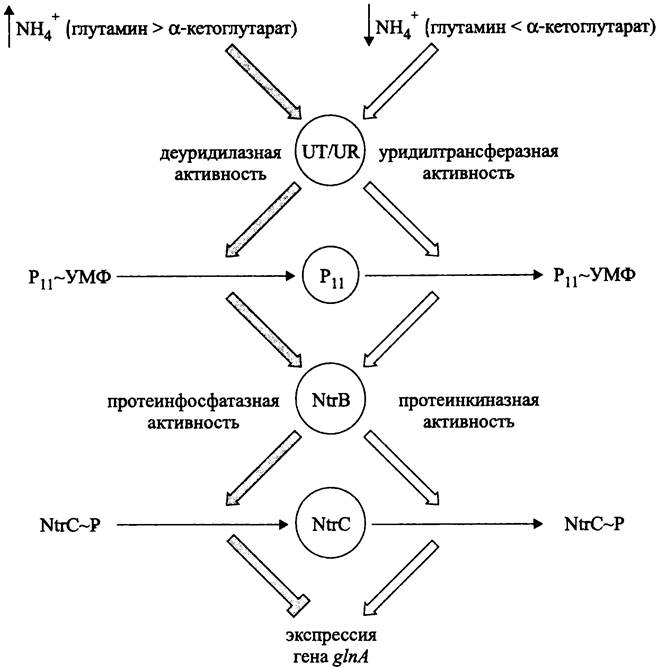
— белка РII;
— протеинкиназы/протеинфосфатазы NtrВ (= СlnL, или NRII);
— транскрипционного фактора NtrС (= СlnС, или NRI).
Какая из двух активностей UТ/UR станет главной, зависит от первичного стимула — соотношения концентраций глутамина и α-кетоглутарата. Индикатором доступности связанного азота служит внутриклеточный баланс между глутамином и α-кетоглутаратом. При избытке возрастает относительное содержание глутамина, а при дефиците преимущественно накапливается α-кетоглутарат.
Глутамин и α-кетоглутарат служат аллостерическими регуляторами бифункционального белка UТ/UR (102 кДа; ген glnD), причем уридилтрансферазная активность стимулируется α-кетоглутаратом и ингибируется глутамином.
При избытке связанного азота (↑NН+4), когда содержание глутамина по отношению к α-кетоглутарату высоко, преобладает деуридилазная активность. При дефиците связанного азота (↓NН+4) преобладает уридилтрансферазная активность.
Субстратом реакций (де)уридилирования служит тримерный белок РII (12,4 кДа; ген glnB). При переносе УМФ от УТФ на остаток Туr-51 он переходит в модифицированную уридилированную форму (РII + УТФ —> РII ~ УМФ + ФФH). После отщепления уридила он возвращается в немодифицированную деуридилированную форму (РII ~ УМФ —> РII + УМФ).
Белок РII является вторичным стимулом. В уридилированной форме он подает знак о дефиците азота, а в деуридилированной форме служит индикатором избытка азота. От него зависит, какая из двух активностей белка NtrB — протеинфосфатазная или протеинкиназная — станет доминирующей.
Деуридилированная форма белка РII связывается с димером сенсорного белка NtrB (36 кДа) и активирует его протеинфосфатазную активность, что приводит к дефосфорилированию димера регуляторного белка NtrC (55 кДа):
NtrC ~ Р —> NtrC + Фн.
В свою очередь, уридилирование препятствует связыванию белка РII с сенсором NtrB. Поэтому после автофосфорилирования по остатку His-139 сенсор трансфосфорилирует регулятор NtrC по остатку Asp-54:
NtrB + АТФ —> NtrB ~ Р + АДФ,
NtrB ~ Р + NtrC —> NtrB + NtrC ~ Р.
Дефосфорилированная форма белка NtrC функционально не активна и не оказывает влияние на базовую экспрессию гена glnA, тогда как фосфорилированная форма служит активатором транскрипции; с ее помощью экспрессия гена glnA значительно усиливается.
Ген glnA входит в состав общего оперона с генами glnL (кодирует сенсор NtrB), glnG (кодирует регулятор NtrC). Таким образом, активируя транскрипцию гена glnA, регулятор NtrC индуцирует и свой собственный синтез, т. е. в данном случае действует петля позитивной обратной связи.
Помимо генов glnA, glnL и glnG под контролем глобальной сигнальной системы NtrB/NtrC находятся гены, отвечающие за транспорт глутамина (glnHPQ), аргинина (argТ) и гистидина (hisJQMP); гены ассимиляции нитрата и нитрита (nas- FEDCBA); ген регуляции диазотрофии у Klebsiella pneumoniae (nifLA), а также ряд других генов азотного метаболизма.
Другие системы контроля азотного метаболизма. Контроль азотного метаболизма охарактеризован на примере системы NtrB/NtrC энтеробактерий, а также на примере Ntr-подобных систем других протеобактерий.
Известен еще ряд регуляторных систем, отвечающих за метаболизм азота, но они менее изучены. Приведем основные примеры.
Белок Nac. У энтеробактерии К. aerogenes гены гистидазы (kut), глутаматдегидрогеназы (gdh), глутаматсинтазы (gltBD), пролиноксидазы (put) и уреазы (иге) находятся под контролем продукта гена nас (сокр. англ, nitrogen assimilation control). Тем не менее, регуляторный белок Nac (32 кДа) не входит в состав сигнальной системы, реагирующей на содержание доступного азота — экспрессия гена пас контролируется системой NtrB/NtrC и происходит при участии альтернативного сигма- фактора σ54. Таким образом, белок Nac синтезируется только при азотном голодании и служит дополнительным активатором генов hut, put и urе, а также подавляет экспрессию генов gdh и gltBD.
Белок GlnR. Фирмикуты, в частности В. subtilis, не обладают системой NtrB/NtrC. В данном случае регуляция гена glnA, входящего в состав оперона glnRA, осуществляется иначе, чем «классическим» Ntr-зависимым способом. При избытке связанного азота экспрессия этого оперона негативно регулируется белком- репрессором GlnR (135 а. о.) в ответ на стимул неустановленной природы.
К числу ферментов, гены которых дерепрессируются при азотном голодании, относятся y-аминобутиратпермеаза, аспарагиназа, аспартаза, глутаминсинтетаза и уреаза. За исключением глутаминсинтетазы, они не контролируются белком GlnR, т. е. у фирмикутов должна существовать еще какая-то система регуляции азотного метаболизма, возможно, Ntr-тнпа.
Белок NtcA. У цианобактерий гены, отвечающие за транспорт и восстановление нитрата, ассимиляцию аммония, дифференциацию гетероцист и диазотрофию, находятся под контролем регуляторного белка NtcA (см. раздел 17.5.1.2). Этот глобальный регулятор транскрипции гомологичен белкам семейства CRP (см. раздел
16.7.1.1) и играет такую же роль, как белки NtrC у других прокариотов. Пока еще не ясно, на какой стимул он непосредственно реагирует или с каким сенсором взаимодействует.
Контрольная взаимосвязь между системами углеродного и азотного метаболизма. Мы уже говорили о том, что углеродная и азотная ветви метаболизма взаимосвязаны. В частности, поглощенные аминокислоты служат источником и углерода, и азота. Соответственно, их катаболизм находится под двойным контролем сигнальных систем, отвечающих за метаболизм углерода и азота.
Углеродный метаболизм регулируется не только «углеродными», но и «азотными» сигналами, а также сигналами о наличии других элементов питания. В ответ на это азотный метаболизм зависит от природы источника углерода и его доступности.
Центральную роль во взаимодействии углеродной и азотной ветвей метаболизма выполняют два проводника сигнала — белок РII и фосфотрансферазная система PTS.
Белок РII, а также его функциональные аналоги GlnB и GlnK, ковалентно модифицируются под воздействием сенсора для уровня глутамина, белка UT/UR. Низкое содержание глутамина вызывет уридилирование белка РII, а высокое — его деуридилирование (см. рис. 261). В зависимости от (де)уридилирования, белок РII взаимодействует с пермеазой Amt (сокр. англ. ammonium transport), с регулятором глутаминсинтетаты GlnE и с протеинкиназой/протеинфосфатазой NtrB. В итоге этого взаимодействия азотный метаболизм контролируется на транспортном, метаболическом и генетическом уровнях. «Вмешательство» углеродной ветви метаболизма связано с тем, что а-кетоглутарат служит сигналом-антагонистом для глутамина.
Роль фосфотрансферазной системы PTS связана с тем, что в присутствии глюкозы происходит катаболитная репрессия, экзогенный глутамин не поглощается, и высок уровень экспрессии гена glnA. В свою очередь, в дерепрессирующих условиях усиливается поглощение глутамина, что приводит к деуридилированию белка РII, инактивации белка NtrC и подавлению экспрессии гена glnA.
Связующими звеньями между азотным и углеродным метаболизмом являются α-кетоглутарат и глутамат, причем последний служит универсальным донором аминогруппы при биосинтезе аминокислот и нуклеотидов. Напомним, что α- кетоглутарат — это ключевой интермедиат цикла Кребса, подверженного множественной регуляции (см. II том учебника). В частности, ген citb (кодирует аконитазу) репрессируется любыми источниками азота, если только они преобразуются в α-кетоглутарат и аммоний.
18.3.2.4. Регуляция фосфорного метаболизма
Ортофосфат входит в состав цитозольных биотрансформаторов (см. II том учебника). Из него образуются полифосфаты; он также является структурным компонентом (поли)нуклеотидов, фосфолипидов в составе СМ и фосфопротеинов. Кроме того, у грамотрицательных бактерий ортофосфат в виде фосфорильной группы содержится в липополисахаридах в составе ОМ, а у грамположительных бактерий - в тейхоевых кислотах и специфических соединениях липофильной стенки у представителей группы «миколата»: липо(арабино)маннанах, миколил-арабиногалактанах и т. д. (см. I том учебника).
Важным фактором, лимитирующим фосфорное питание, является растворимость ортофосфатов. Она зависит от типа противоиона и значения pH; в частности, фосфаты кальция выпадают в осадок при рН>7.
При внутриклеточной концентрации ортофосфата <0,1 мМ наступает фосфорное голодание. В ответ на него экспрессируются гены, продукты которых стимулируют поступление этого аниона из окружающей среды.
Как и во многих других случаях, модельным объектом для изучения регуляции фосфорного метаболизма служит Е. coli. При фосфорном голодании в ОМ появляется специализированный фосфопорин PhoE (см. I том учебника), образующий канал для облегченной диффузии ортофосфата. Одновременно с этим в периплазматическом компартменте начинает действовать щелочная фосфатаза (продукт гена phoA), которая вьпцепляет ортофосфат из малых органических эфиров. Далее ортофосфат связывается с индуцибельным белком PstS (сокр. англ, phosphate-specific transport), сродство которого к субстрату на два порядка выше, чем у конститутивного транспортера Pit (сокр. англ. phosphate inorganictransport). Наконец, растворимый переносчик PstS презентирует ортофосфат индуцибельной пермеазе PstАВС. Она входит в состав СМ и принадлежит к суперсемейству ABC-транспортеров (см. II том учебника); с ее помощью за счет гидролиза АТФ ортофосфат транслоцируется в цитоплазму.
Экспрессия генов фосфопорина PhoE и компонентов Pst-системы позитивно регулируется двухкомпонентной сигнальной системой PhoR/PhoB, действующей по «традиционной» схеме (см. рис. 251). Сенсором служит белок PhoR, заякоренный в СМ. При активации ортофосфатом он автофосфорилируется, а затем трансфосфо- рилирует растворимый регулятор PhoB.
Белок PhoB~P связывается с «Pho-боксами» генов-мишеней в рho-регулоне (phoA, phoE. phoRB, phoU и pstSCAB) и активирует их транскрипцию.
Когда фосфор находится в избытке, сенсор PhoR, содержащий PAS-домен, выступает в качестве протеинфосфатазы и дефосфорилирует регулятор PhoB. Роль кофосфатазы выполняет белок PhoU, ген которого входит в общий оперон с pst- генами.
У грамположительных бактерий, в частности В. subtilis, аналогом системы PhoR/PhoB служит система PhoP/PhoR (следует обратить внимание на то, что в данном случае регулятор обозначается как PhoR).
18.3.2.5. Регуляция железного метаболизма
Геминовое или негеминовое железо входит в состав большинства систем энергетического метаболизма, а также в состав многих ферментов конструктивного метаболизма — достаточно вспомнить электрон-транспортные цепи или нитрогеназу (см. II том учебника).
Специфика железного питания выражается в том, что при плотности популяций 108 • 1012 клеток • л-1 и рН>7 (когда железо существует в форме Fe3+, имеющей растворимость <10-18М, т. е. 6 • 106 ион • л-1), бактериальная клетка, которой требуются 105-106 катионов железа, не может рассчитывать даже на один катион. Чтобы преодолеть огромный разрыв между внутренним и внешним пулами железа, бактерии прибегают к разным компенсаторным стратегиям. К ним относятся: (1) адаптация к абиотической среде с низкими значениями pH, где хорошо растворяется Fe2+ (>10-1М при pH <7); (2) подкисление окружающей среды в ходе метаболизма; (3) внеклеточное восстановление плохо растворимого Fe3+ в хорошо растворимый Fe2+; (4) секреция хелаторов железа. Естественно, что при этом используются регуляторные системы.
Однако в данном случае на регуляцию накладывается особый отпечаток: главной целью служит не собственно железный метаболизм, а поддержание железного гомеостаза. Нарушение железного гомеостаза происходит в диаметрально противоположных ситуациях — при железном голодании и при увеличении внутриклеточного пула свободного железа.
Железное голодание приводит к дефициту (не)геминового железа, что угнетает метаболические процессы (см. II том учебника), и тогда главным путем физиологической адаптации становится биогенез альтернативных метаболических систем. Некоторые из них вообще не содержат железа. В свою очередь, избыточное накопление железа способствует окислительному стрессу (см. раздел 19.1.6); при этом с нарушением железного гомеостаза можно бороться тремя способами: заблокировать импорт железа; хелатировать железо, проникшее в клетку; иммобилизовать железо в составе запасающих белков или биоминеральных включений.
Железный гомеостаз контролируется на уровне транскрипции с помощью однокомпонентных сигнальных систем Fur и DtxR.
Белки Fur. У бактерий широко распространены глобальные регуляторы из семейства Fur (сокр. англ. ferric uptake regulator). Они контролируют поглощение и запасание железа, его оптимальную внутриклеточную концентрацию и использование в метаболизме. При инактивации гена fur нарушается баланс между поступлением и утилизацией железа; в цитоплазме увеличивается содержание свободного железа, что приводит к окислительному стрессу.
Поддерживать железный гомеостаз — не единственная функция белков Fur. Они выступают в качестве плейотропных регуляторов и контролируют экспрессию нескольких десятков генов (>90 в случае Е. coli), которые так или иначе связаны с метаболизмом железа. Кроме того, под негативным контролем белков Fur находится ряд генов, не имеющих отношения к метаболизму железа. Это гены генерального метаболизма, в том числе гены гликолиза, гены цикла Кребса и дыхательные гены, а также гены биосинтеза аминокислот и пуриновых оснований. Что касается генов специализированного метаболизма, то белок Fur репрессирует гены биосинтеза хелаторов железа (сидерофоров), а также гены некоторых токсинов и других факторов вирулентности. Наконец, он репрессирует ряд «экологических» генов, продукты которых участвуют в хемотаксисе и окислительном стрессе, например, ген sodA.
Белок Fur накапливается в относительно высоком количестве (5 • 103 копий на клетку в экспоненциальной фазе роста и до 104 в стационарной фазе). В активном состоянии он представляет собой гомодимер (2 x 17 кДа). С-концевые домены, содержащие остатки His, связывают катионы Fe2+ и обеспечивают димеризацию, а N-концевые домены взаимодействуют с ДНК. За счет образования комплекса с железом сродство белка Fur к специфическим сайтам ДНК увеличивается на три порядка.
Комплекс Fur/Fe2+ подавляет транскрипцию (рис. 262). Он взаимодействует с участками ДНК размером 11-19 п. н., или «железными боксами» (англ, iron box), которые перекрываются с позициями -35 и -10 в промоторах репрессируемых генов. Иногда железные боксы расположены рядом друг с другом и даже взаимно перекрываются. Это позволяет им взаимодействовать одновременно с несколькими комплексами Fur/Fe2+, которые имеют свойство «полимеризоваться» вдоль двойной спирали ДНК, выходя за пределы железных боксов и граничащих с ними сайтов.
Рис. 262. Схема действия глобального регулятора Fur.
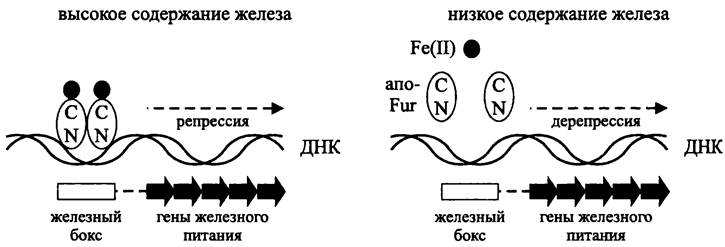
При железном голодании катионы Fe2+ высвобождаются из комплекса Fur/Fe2+. Инактивированный белок Fur диссоциирует от ДНК, в результате чего индуцируется транскрипция.
Белок Fur не обязательно только подавляет транскрипцию. Он также может быть индуктором транскрипции генов без участия железных боксов. Тогда регуляция носит непрямой характер. Например, в случае Е. coli он способствует транскрипции генов ферригина и бактериоферритина, блокируя транскрипцию антисмысловых РНК. Иными словами, он выступает в роли репрессора по отношению к другому репрессору.
Единственный ген, который непосредственно индуцируется путем взаимодействия с белком Fur — это ген pfr патогенной бактерии Helicobacter pylori (кодирует ферритин). В данном случае при голодании по железу апопротеин Fur связывается с промотором и блокирует его, а при избытке железа диссоциирует от промотора, активируя транскрипцию. Поскольку с молекулой ДНК взаимодействует белок Fur без лиганда, узнаваемая нуклеотидная последовательность отличается по структуре от железных боксов. В свою очередь, при достаточном количестве железа образуется комплекс Fur/Fe2+, который связывается с железным боксом и дерепрессирует ген pfr.
Белки DtxR. Глобальные регуляторы из семейства DtxR (сокр. англ. diphtheria toxin regulator) широко распространены у грамположительных бактерий с высоким содержанием GC-nap. В частности, белок DtxR регулирует поглощение железа и биосинтез экзотоксина Corynebacterium diphtheriae.
Хотя DtxR-белки слабо гомологичны или не гомологичны Fur-белкам, они тоже играют роль железозависимых репрессоров. В димерной форме они взаимодействуют с палиндромами размером 19 п.н., которые расположены в области гена tox. Подобно белкам Fur, белки DtxR содержат сенсорный домен с двумя сайтами для связывания катиона Fe2+ (заодно он отвечает за димеризацию) и N-концевой ДНК- связывающий домен со структурным мотивом НТН.
Отдельным представителем семейства DtxR-белков является белок IdeR — глобальный регулятор Mycobacterium tuberculosis. Он имеет гомодимерную структуру (2 x 115 кДа) и содержит два сайта для связывания Fe2+ или других двухвалентных катионов, например Со2+, Mg2+, Мn2+, Ni2+ и Zn2+. При образовании комплекса с металлами в N-концевом домене белка IdeR происходят конформационные изменения, в результате чего он приобретает способность взаимодействовать с ДНК.
Участками ДНК для связывания белков IdeR, как и белков Fur, служат железные боксы (рис. 263).
Рис. 263. Схема действия глобального регулятора IdeR.
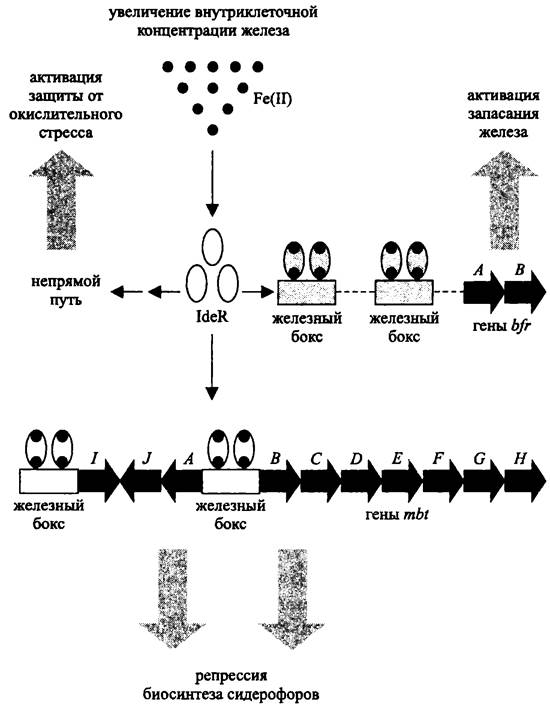
В то время как Fur-белки преимущественно играют роль негативных регуляторов, влияние белков IdeR может быть и негативным, и позитивным. Если в области промотора находится только один железный бокс, белок IdeR проявляет себя как репрессор, например, по отношению к генам mbt, кодирующим сидерофоры из группы микобактииа (см. II том учебника). Если же в области промотора расположен тандем железных боксов, тогда белок IdeR выполняет функцию активатора; он взаимодействует с РНК-полимеразой и облегчает инициацию транскрипции, в частности, в случае генов bfr, которые кодируют сидерофоры из группы бактериоферритина.
Как и у представителей семейства Fur, функция белков DtxR не ограничивается регуляцией генов, отвечающих за транспорт и запасание железа. В частности, белок IdeR регулирует ряд генов генерального метаболизма, окислительного стресса и вирулентности. Поскольку одна и та же бактерия может синтезировать и белок Fur, и белок DtxR, механизм регуляции метаболизма железа усложняется.
Железное голодание. Основным модельным объектом для изучения железного голодания служат цианобактерии.
Одноклеточные штаммы цианобактерий — одни из важнейших первичных продуцентов в Мировом океане (см. I том учебника). Их развитие находится под контролем ряда абиотических факторов. Вопреки очевидности, критичными являются вовсе не свет и температура, поскольку эуфотическая зона доходит до глубины ~250 м, причем пояс интенсивного развития пикоцианобактерий простирается до 40-й широты в обоих полушариях, а минеральные элементы, особенно железо.
При ограничении доступа к минеральным элементам у цианобактерий активируется экспрессия протеинкиназы NblS (сокр. англ. nutrient bleaching), которая контролирует фотоакклиматизацию и, в частности, служит триггером деградации фикобилисом на ярком свету. Кроме того, NblS запускает экспрессию белка HLIP (сокр. англ. high light inducedprotein). Последний адаптивно образуется у тривиальных цианобактерий, а также у цианобактерий-прохлорофитов (у которых, по определению, присутствуют один или несколько вспомогательных хлорофиллов).
Главным фактором экологического стресса, у цианобактерий служит железо. До конца 1980-х гг. недооценивалась ключевая роль этого микроэлемента для первичной продукции в открытой акватории и зоне апвеллинга. По современным представлениям, присутствие железа в экстремально низких концентрациях (<1 нМ) лимитирует первичную продукцию в тех областях Мирового океана, которые относительно богаты другими минеральными элементами. Эта закономерность распространяется и на озерные экосистемы, для мониторинга которых используется метод люминесцентного зондирования — ген люциферазы Vibrio harveyi гибридизуют с промоторами генов железного стресса isiAB (см. ниже), находящимися под контролем глобального регулятора из семейства белков Pur.
В состав «минимального» фотосинтетического аппарата цианобактерий (ФСI/ФСII/цитохром bf-комплекс/фикобилисома: см. II том учебника) входят ~25 атомов железа. Поэтому большинство этих облигатных фототрофов так чувствительно к железному голоданию. В данном случае синдром железного стресса включает в себя:
— уменьшение удельного содержания хлорофилла и деградацию фикобилисом;
— активацию систем импорта железа (Fut и Feo);
— частичное замещение Fe-протеинов функционально аналогичными белками, не содержащими железа (например, взамен ферредоксина синтезируется флаводоксин; см. ниже);
— биогенез специфических светособирающих систем, адаптированных к условиям железного стресса (в частности, антенн на основе белка IsiА; см. ниже).
Большинство генов, которые индуцируются при железном голодании, содержит в своих промоторных участках железные боксы.
Флаводоксин. При железном голодании у цианобактерий деградирует апопротеин Fe/S-белка ферредоксина I и начинает синтезироваться флавопрогеин — флаводоксин. Они выполняют одинаковую задачу, участвуя в переносе электронов от ФСI к НАДФ с помощью ферредоксин/флаводоксин: НАДФ-оксидоредуктазы. Флаводоксин представляет собой кислый белок (Мг ~18 кДа; ген isiB); простетической группой служит ФМН (см. II том учебника). Ген isiB входит в состав дицистронного оперона isiAB. Промоторный участок гена isiАсодержит железный бокс, что характерно для генов, которые индуцируются при железном голодании; в этом плане цианобактерии не отличаются от хемогетеротрофных бактерий.
Белок IsiA. При дефиците свободного железа активируется транскрипция генов isiА и isiB. Однако уровень дицистронной транскрипции генов isiAB увеличивается лишь на порядок, а уровень моноцистронной транскрипции гена isiА — на целых два порядка. Хотя продукт гена isiA синтезируется при железном стрессе, общим индуктором оперона isiA служит окислительный стресс. В свою очередь, окислительный стресс вызывается разными причинами: мутационными нарушениями в структуре фотосинтетического аппарата; голоданием по железу; осмотическим стрессом (воздействием минеральных солей в высоких концентрациях) и т. д. Белок IsiA гомологичен белку СР43 (субъединице PsbC внутренней антенны ФСII), поэтому его также обозначают как СР43'. Подобно белку СР43, он состоит из 6 интегральных спиралей, которые совместно связывают 12 молекул хлорофилла а. Основное различие между белком СР43 и белком IsiA заключается в том, что у последнего нет большой гидрофильной петли размером ~100 а.о. Белок IsiA образует хлорофилл α-белковый комплекс, 18 молекул которого окружают кольцом тример ФСI. По оптическим свойствам суперкомплекс IsiA/ФCI (![]() = 675 нм) больше похож на ФСII (
= 675 нм) больше похож на ФСII (![]() = 674 нм), чем на ФСI (
= 674 нм), чем на ФСI (![]() = 679 нм).
= 679 нм).
Интересно, что 18-мерное кольцо белка IsiA напоминает мультимеры антенных комплексов LHI и LHII, окружающие реакционный центр пурпурных бактерий (см. II том учебника). Аналогичные кольца из моно- и тримерных антенных комплексов (Lhca1- 4 и Lhcbl-3) образуются в хлоропластах вокруг ФСI и ФСII. Однако упомянутые типы суперкомплексов не гомологичны друг другу.
Штаммы с геном isiA представлены во всех Субсекциях цианобактерий (см. I том учебника). Роль белка IsiA до конца не выяснена. Скорее всего, образуемая им антенна компенсирует уменьшение размера антенны ФС1 (при железном стрессе количество тримеров ФСI снижается на 60-80%), а также деградацию фикобилисом. Белок IsiA, с которым связаны до 50% хлорофилла, дополнительно служит аварийным клапаном, рассеивающим избыточную энергию, которая не утилизируется голодающими клетками.
Другие адаптационные системы. Мы уже говорили о том, что при дефиците железа в результате активации экспрессии гена isiA образуется суперкомплекс ФСI/IsiА. Наряду с этим синтезируется белок ldiА (35 к Да). Экспрессия гена idiA находится под позитивным контролем белка IdiB. Предполагается, что белок IdiA защищает ФСII, главным образом, при окислительном стрессе. При голодании по железу одновременно с усилением экспрессии гена idiA повышается экспрессия гена dpsА, находящегося под контролем глобального регулятора OxyR (см. раздел 19.1.6.2). Голодание по железу, помимо повышения уровня экспрессии генов isiA В стимулирует экспрессию генов fur, idiA, irpA и mарА. Но если мы знаем, что белки Fur, LsiAB и IdiA обеспечивают железный гомеостаз, то роль белков IrрА и МарА остается не ясной.
18.3.3. Регуляция вторичного метаболизма
Продуктами вторичного (= специализированного) метаболизма являются вторичные (= специализированные) метаболиты. Это низкомолекулярные соединения нестандартной структуры, которые не используются в качестве материала для роста и размножения клеток, а в основном играют роль экзогенных регуляторов (см. II том учебника). Некоторые экзогенные регуляторы обладают побочным антибиотическим действием.
В большинстве случаев вторичные метаболиты-регуляторы поступают в окружающую среду. По достижении сверхкритической концентрации они начинают воздействовать на своего продуцента извне, вызывая чувство кворума с тем или иным адаптивным ответом, т. е. они ведут себя как автоиндукторы. Одной из форм адаптивного ответа служит клеточная дифференциация.
В разделе 17.5.2.1 уже упоминались автоиндуктор y-бутиролактон (А-фактор), стимулирующий рост воздушного мицелия у актинобактерии Streptomyces griseus (см. рис. 238); олигопептидные автоиндукторы, контролирующие споруляцию у мик- собактерии Мухососсив хаntus, а также автоиндуктор стигмолон, вызывающий образование сложных плодовых тел у миксобактерии Stigmatella aurantica (см. рис. 239). Более подробно бактериальные автоиндукторы будут рассмотрены в разделе 18.4.2.
У грамотрицательных и грамположительных бактерий регуляторное воздействие автоиндукторов на образование вторичных метаболитов, в том числе, на свой собственный синтез осуществляется разными способами (рис. 264).
Рис. 264. Регуляция образования вторичных метаболитов при помощи автоиндукторов у грамотрицательных (А) и грамположительных (Б) бактерий. Объяснение в тексте.
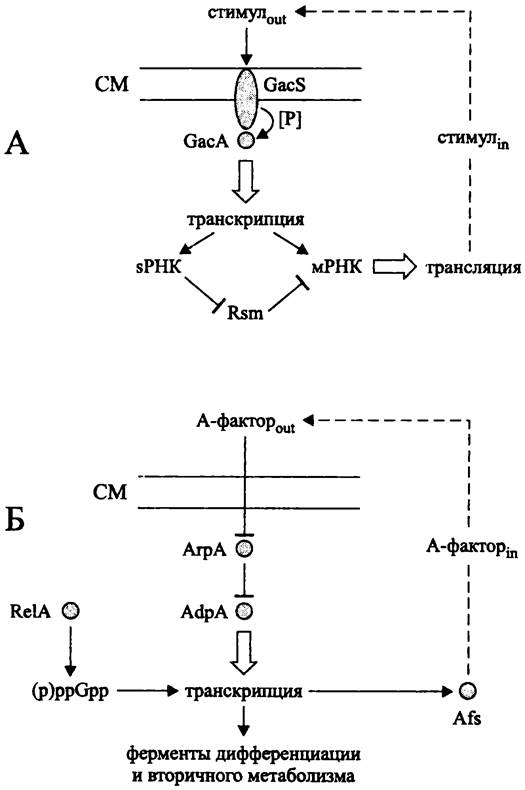
Грамотрицательные бактерии (рис. 264, А). Вторичные метаболиты грамотрицательных бактерий изучены в основном у представителей класса «Gammaproteobacteria», в частности у псевдомонад. К их числу относятся:
— автоиндукторы;
— факторы вирулентности;
— цитотоксины;
— факторы биоконтроля, т. e. антибиотики, защищающие растение (партнера по симбиозу) от грибов и нематод;
— поверхностно-активные вещества и т. д.
Экзогенный стимул воспринимается двухкомпонентной сигнальной системой. Она состоит из мембранного сенсора GacS (сокр. англ. global activation of antibiotic synthesis), который после связывания сигнального экзопродукта активируется путем автофосфорилирования, и растворимого регулятора GacA. Белок GacS содержит несколько фосфотрансферазных доменов и, таким образом, представляет собой гибридную сенсорную киназу (см. раздел 18.1.1.3). Белок GacA, активированный сенсорной киназой GacS, связывается с консенсусным Gac-боксом TGTAAGNeCTTACА, лежащим левее промоторов генов-мишеней.
Продуктом транскрипции GacA-активируемых генов служат мРНК, а также регуляторные sPHK размером 100 -500 н. (см. раздел 18.2.2).
Синтез мРНК и sPHK усиливается при достижении кворума, т. е. при увеличении плотности бактериальной популяции, когда концентрация автоиндуктора достигает критического порогового уровня.
У белка GacA существует функциональный антагонист — посттранскрипционный регулятор, в данном случае РНК-связывающий белок из семейства Rsm/Csr (сокр. англ. repressor ofsecondary metabolism/carbon storage regulator), который блокирует мРНК. В свою очередь, антагонистом белка Rsm является sPHK, которая имеет к нему высокое сродство и путем его изоляции (англ. protein sequestration) не дает ему репрессировать трансляцию. Таким образом, позитивный контроль синтеза вторичных метаболитов усиливается петлей негативной связи.
Грамположительные бактерии (рис. 264, Б). Богатейшим источником вторичных метаболитов являются стрептомицеты, в частности S. griseus. При поверхностном культивировании биосинтез этих соединений начинается после образования воздушных гиф, а при глубинном культивировании — после перехода к стационарной фазе. Как правило, гены вторичного метаболизма образуют оперон размером 1-100 т. п. н., находящийся под контролем регуляторного гена.
Сигналом для биосинтеза вторичного метаболита служит замедление или прекращение роста. При этом с помощью синтетазы RelA образуется алармон (p)ppGpp (см. раздел 18.1.4), который активирует транскрипцию генов биосинтеза вторичных метаболитов. Параллельно с ним действует белковый активатор транскрипции - AdpA (сокр. англ. arial gyphaederepressor protein).
При накоплении (p)ppGpp с помощью синтетазы AfsA начинает вырабатываться экзопродукт — автоиндуктор 2-изокапроил-3R-гидроксиметил-y-бутиролактон, или A-фактор, выявленный в середине 1960-х гг. в результате пионерских исследований А. С. Хохлова (см. рис. 238). Когда концентрация A-фактора достигает критического уровня, т. е. наступает чувство кворума, он связывается с цитоплазматическим рецептором — репрессором транскрипции АгрА (сокр. англ. arial gyphae repressor protein). Это приводит к освобождению промотора гена adpA и началу синтеза активатора транскрипции AdpA.
От белка AdpA зависит плейотропная активация морфогенетических и метаболических процессов, в частности, биосинтез автоиндуктора 7-бутиролактона и антибиотика стрептомицина. В первую очередь, AdpA активирует ген альтернативного сигма-фактора ECF (σadsA), который, в свою очередь, обеспечивает транскрипцию генов, ответственных за образование воздушного мицелия. Кроме того, AdpA активирует ген amfR (его продукт влияет на синтез пептидного морфогена AmfS), а также другие «морфогенетические» гены — ген эндопептидазы SGMP II и гены внеклеточных протеаз SprABDT.