МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ III - А. В. ПИНЕВИЧ - 2009
ГЛАВА 21. МИКРОБНЫЕ КУЛЬТУРЫ И БИОТЕХНОЛОГИЯ
A quoi Candide répond: Cela est bien dit, mais il faut cultiver notre jardin.
(На что Кандид отвечал: Хорошо сказано, но — нужно взращивать свой сад).
F.-M. Arouet (de Voltaire). Candide, ou l’Optimisme (Geneva, 1759).
Понятие о микробной культуре относится к числу базовых не только для фундаментальной микробиологии, но и для ее практического приложения — биотехнологии.
21.1. Микробные культуры
В самом общем случае микробной культурой (англ. microbial culture; от лат. cultura — взращивание) называется система, состоящая, из микроорганизма вместе с частью окружающей среды и находящаяся в замкнутом пространстве под наблюдением.
Такое определение культуры охватывает множество особей, несколько клеток или единственную клетку (например, в препарате типа висящей капли). Тем не менее, под культурой обычно имеется в виду популяция микроорганизмов совместно с культуральной средой (англ. culture medium), которые находятся в закрытом или открытом сосуде — культиваторе (англ. cultivator).
Таким образом, в отличие от «диких» микроорганизмов в природной среде обитания, культура — это микроорганизмы, помещенные в резервацию, а культивирование — это методический прием, используемый в целях поддержания или сохранения культуры. Иными словами, стратегия культивирования заключается в принудительном уменьшении числа степеней свободы микроорганизма, который на то или иное время удерживается в культиваторе.
Классификация культур может иметь разную основу, в зависимости от их состава, физиологического состояния и метода поддержания.
Чистые и смешанные культуры. Для характеристики популяционного состава культур их подразделяют на чистые (англ, pure culture), или аксеничные (англ. axenic culture; от греч. а — не и xenos — чужой; «без посторонних») и смешанные, или ксеничные (англ. xenic culture; от греч. xenos — чужой; «с посторонним(и)»).
В первом случае в культуре присутствует микроорганизм одного вида, а во втором случае — микроорганизмы двух или более видов (современное определение вида у прокариотов дано в I томе учебника). В свою очередь, в зависимости от числа посторонних видов, ксеничные культуры подразделяются на моноксеничные и мультиксеничные.
Развивающиеся и покоящиеся культуры. В соответствии со способностью культуры изменяться во времени различают развивающиеся культуры (англ. developing culture) и покоящиеся культуры (англ. dormant culture). Крайний вариант покоящейся культуры — это культура, клетки которой находятся в состоянии анабиоза. Прекращение развития особи или популяции провоцируется стрессом (см. главу 19), и иногда этому предшествует клеточная дифференциация (см. раздел 17.5.2).
Напомним, что термином развитие культуры (англ. culture development) обозначается совокупность роста культуры (англ. culture growth), т. е. увеличения ее биомассы, и размножения культуры (англ. culture multiplication), т. е. увеличения ее численности.
Периодические и непрерывные культуры. В зависимости от того, представляет ли культура замкнутую или открытую систему, различают периодические культуры и непрерывные культуры.
Периодическая культура (англ. batch culture; от batch — одноразовый замес) представляет собой замкнутую систему. По мере использования пищевых ресурсов и накопления побочных продуктов метаболизма исходная питательная среда становится культуральной средой.
Периодическая культура с подкормкой (англ. fed-batch culture) представляет собой квази-открытую систему. Время от времени в культиватор, восполняя убыль, вносят порции питательного субстрата или смесь субстратов, но излишки культуры не отбирают.
Непрерывная, или проточная культура (англ. continuous culture; free-flow culture) представляет собой открытую систему. В культиватор порциями или непрекращающимся потоком поступает свежая питательная среда; при этом излишки культуры удаляют из культиватора.
В случае аксеничной культуры каждый акт культивирования начинается с внесения в стерильную питательную среду (англ. nutritional medium) аксеничного посевного материала, или инокулума (англ. inoculum; от лат. in-oculatio — прививка). Такая процедура еще называется пересевом (англ. reinoculation).
В свою очередь, ксеничные культуры могут пересеваться либо на стерильную, либо на нестерильную среду; во втором случае степень мультиксеничности может повышаться.
21.1.1. Закономерности периодической культуры
Одно из самых впечатляющих свойств бактерий — это их способность быстро размножаться при достаточном количестве ресурсов, необходимых для получения энергии, конструктивного субстрата и донора электронов. При этом физиологические свойства бактерий и фракционный состав бактериальной клетки неразрывно связаны со скоростью роста, а она, в свою очередь, зависит от внешних условий, в частности от состава питательной среды.
Поскольку все сказанное относится не только к природным нишам, но и к лаборатории, неудивительно, что круг феноменов, связанных с кинетикой роста культур, привлек внимание исследователей еще на заре экспериментальной бактериологии.
Первая количественная оценка роста бактерий была дана в середине 1890-х гг. Мюллером (М. Müller) на примере Salmonella typhi, а также Уордом (Н. М. Ward) на примере Bacillus sp. Спустя два десятилетия, в 1918 г. известный американский бактериолог Роберт (Боб) Бьюкенен (R. Е. Buchanan) установил качественные закономерности, которым подчиняется развитие периодической культуры гетеротрофных бактерий, и выделил основные фазы кривой периодического роста (рис. 283). Позже выяснилось, что эти закономерности распространяются на периодические культуры бактерий с другими типами метаболизма, а также на периодические культуры архей.
Кривая периодического роста отражает общую ситуацию в автоэкологии, когда численность популяции лимитируется трофическими ресурсами, накоплением побочных продуктов жизнедеятельности и плотностью заселения ниши. Понятно, что потенциально неограниченное экспоненциальное размножение бактерий, когда каждое последующее удвоение числа клеток происходит за один и тот же промежуток времени, не может продолжаться в замкнутой системе до бесконечности. Рано или поздно какой-нибудь субстрат будет исчерпан (точнее сказать, его концентрация снизится до порогового уровня), что приведет к более или менее резкой остановке роста.
Периодическая культура инициируется при внесении посевного материала в свежую питательную среду и проходит три основные фазы: лаг-фазу (от англ. lag — запаздывание), экспоненциальную фазу и стационарную фазу (рис. 283). Помимо них разные авторы выделяют несколько дополнительных фаз, число которых варьирует от трех до пяти, хотя это не меняет сути дела.
Рис. 283. Кривая периодического роста бактериальной культуры (по Бьюкенену). 1 — начальная стационарная фаза; 2 — лаг-фаза, или фаза положительного ускорения роста; 3 — логарифмическая фаза; 4 — фаза замедления роста; 5 — максимальная стационарная фаза; 6 — фаза ускоренной смерти; 7 — фаза логарифмической смерти.
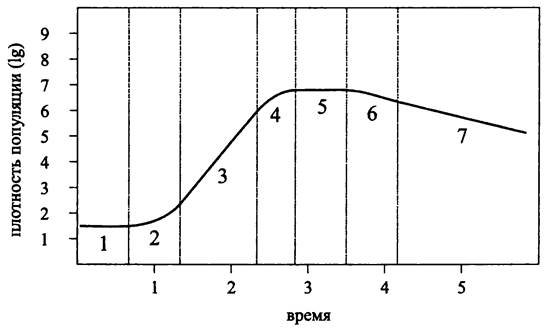
Отдельные фазы кривой периодического роста в разное время вызывали то больший, то меньший интерес. Так, в 1930-е гг. в первую очередь изучалась лаг-фаза. После того, как Моно в 1942 г. предложил свое классическое уравнение (см. ниже), и особенно в 1950-1970-е гг., после исследований Копенгагенской школы (см. раздел 17.3) в центре внимания оказалась экспоненциальная фаза. Наконец, в конце 1990-х гг. благодаря успехам в изучении генетических детерминант регуляторных систем злободневной темой стала стационарная фаза.
Показатели, характеризующие кинетику роста периодической культуры и его интенсивность. Поведение периодической культуры оценивается рядом количественных параметров (продолжительность лаг-фазы, время генерации, скорость роста, урожай и др.).
В частности, если бактерии размножаются бинарным делением с постоянным темпом, число клеток увеличивается экспоненциально, т. е. в геометрической прогрессии:
N(t2) = N(t1) • 2n,
где N(t1) — число клеток в момент времени t1; N(t2) — число клеток в момент времени n — сколько раз удвоилось число клеток за время ∆t, т. е. t2 - t1.
Отсюда n = ~3,32 • [lgN(t2) - lgN(t1)]. Это не что иное, как число клеточных поколений, появившихся на свет в единицу времени, или число генераций (от лат. geneгatio — поколение) за единицу времени. В свою очередь, время генерации (tG), т. е. время, за которое число клеток удваивается, равно:
tG = ∆t/n.
Скорость роста (V), т. е. изменение числа клеток в единицу времени, является величиной, обратной времени генерации, что составляет:
V = 1/tG = n/∆t = ~ 3,32 • [lgN(t2) - lgN(t1)]/∆t.
Если продифференцировать это выражение, мы получим удельную скорость роста (μ), т. е. моментальное увеличение числа клеток, отнесенное к уже имеющемуся числу:
μ = dN/dt • 1/N.
Во всех приведенных формулах, которые справедливы только в отношении экспоненциально растущей культуры, число клеток можно заменить тем или иным параметром, отражающим биомассу. В частности, время удвоения биомассы (tD) обратно удельной скорости роста:
tD = k/μ,
где к — пересчетный коэффициент, связывающий численность популяции с ее биомассой.
Для оценки интенсивности роста культуры используется такой показатель, как урожай (англ. yield; Y). Он отражает максимальный выход клеток или биомассы на единицу объема при конкретных условиях культивирования.
Наконец, следует упомянуть ряд «коэффициентов полезного действия», отражающих общую эффективность метаболических процессов в периодической культуре, в частности:
— экономический коэффициент, или соотношение между урожаем и количеством израсходованного субстрата (Yc=Y/S);
— молярный коэффициент субстрата, или соотношение между количеством молей ассимилированного углерода и количеством молей израсходованного субстрата
(YS=MC/MS);
— молярный коэффициент АТФ, или соотношение между урожаем и количеством молей синтезированного АТФ (YАТФ=Y/МАТФ).
Рост культуры и концентрация субстрата (уравнение Моно). Эмпирическое уравнение, выведенное Жаком Моно и названное в его честь, описывало экспоненциальный рост культур Е. coli и В. subtilis в условиях лимитирования источником углерода, в частности глюкозой, лактозой и маннозой. Позднее оказалось, что оно распространяется на другие случаи лимитирования субстратом, в частности источником азота, т. е. имеет общий характер.
Согласно уравнению Моно, удельная скорость роста связана с концентрацией лимитирующего экзогенного субстрата гиперболической зависимостью:
μ = (μmах • S)/(KS+ S),
где μ — удельная скорость роста при концентрации лимитирующего субстрата, равной S; μmах — максимальная скорость роста, не лимитированного субстратом; KS — константа Моно, или константа насыщения, численно равная такой концентрации субстрата, при которой μ = 1/2μmах (рис. 284). Для разных субстратов величина Ks варьирует в пределах 10 — 10-3 мг • л-1; например, для глюкозы в случае Е. coli она составляет ~1 мг • л-1.
Рис. 284. Зависимость между удельной скоростью роста бактерий и концентрацией лимитирующего субстрата. μ — удельная скорость роста; S — концентрация лимитирующего субстрата; Smin — минимальная концентрация лимитирующего субстрата; КS — константа Моно.
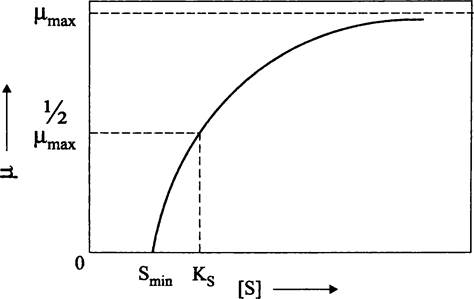
Легко заметить, что уравнение Моно «копирует» известное из биохимии кинетическое уравнение Михаэлиса-Ментен для начальной скорости ферментативной реакции (V0), которое описывает гиперболическую зависимость в системе координат [V0]— [S] (где [S] — исходная концентрация субстрата). Напомним, что данная зависимость объясняется образованием промежуточного фермент-субстратного комплекса на основе их взаимного сродства.
Как видно на рис. 284, при избытке субстрата μ = μmax. Однако, в отличие от ферментативной реакции, протекающей в соответствии с уравнением Михаэлиса-Ментен, кривая выходит не из точки пересечения координатных осей, а смещена вправо по оси абсцисс. Дело в том, что бактерия, прежде чем приступить к росту и размножению, должна использовать минимально необходимое количество субстрата (Smjn) для сохранения структурной целостности клетки, в частности, получить т. н. энергию поддержания (англ. maintenance energy).
Бактерий не напрасно образно называют «живыми катализаторами». Величина KS в уравнении Моно отражает сродство их транспортных систем к экзогенному органическому субстрату, и оно различается у разных видов. Соответственно, по способности расти при низкой концентрации субстрата бактерий условно подразделяют на медленно растущих олиготрофов и быстро растущих копиотрофов.
Олиготрофы (от греч. oligos — малый по числу и trophe — питаюсь; «сидящий на бедной диете») имеют высокую KSи низкую μmax, а копиотрофы (от лат. copia — изобилие и греч. trophe — питаюсь; «сидящий на богатой диете») низкую KS и высокую μmax. Первые получают преимущество в среде с низкой концентрацией субстратов, а вторые — в среде с высокой концентрацией субстратов.
Начальная стационарная фаза (англ. initial stationary phase; рис. 283, 1). После пересева на свежую питательную среду, прежде чем приступить к экспоненциальному размножению, бактерии должны к ней адаптироваться. Продолжительность этой фазы зависит от природы организма, состава питательной среды, размера инокулума и условий, в которых он находился до пересева. Перенос на свежую среду, даже если в ней предварительно созданы комфортные условия (оптимальные pH, температура, аэрация, освещенность и т. д.) всегда связан со стрессом. С целью преодоления его последствий активируется транскрипция многочисленных регулонов и оперонов, и в культуральную среду выделяются автоиндукторы (см. разделы 18.1.2 и 18.4.2). Перенос на среду более богатого состава обозначается как трофический взлет (англ. nutritional shift up), что, как правило, связано с адаптивным синтезом ферментов. В свою очередь, перенос на более бедную среду называется трофическим падением (англ. nutritional shift down) и, соответственно, связан с адаптивной репрессией синтеза ферментов.
Лаг-фаза, или фаза положительного ускорения роста (англ. lag phase; phase of positive growth acceleration; рис. 283, 2). В течение лаг-фазы скорость размножения и, соответственно, удельная скорость роста возрастают от минимальной величины до максимальной. При этом рост носит несбалансированный характер и преимущественно связан с увеличением числа копий хромосомы, а также количества транслирующих рибосом.
Экспоненциальная фаза, или фаза логарифмического роста (англ. exponential phase; logarithmic growth phase; рис. 283, 3). В этой фазе культура находится в квазистационарном состоянии, что выражается: (1) в постоянном времени генерации; (2) в сбалансированном росте (англ. balanced growth; steady-state growth), когда состав клетки, а также ее размер постоянны от поколения к поколению.
Для удобства изображения кривая роста строится в полулогарифмическом масштабе, в результате чего экспоненциальная фаза имеет вид отрезка прямой (см. рис. 283, 3).
Основные свойства клеток в экспоненциально растущей культуре, впервые описанные и интерпретированные в 1950-х гг. представителями Копенгагенской школы, мы уже рассматривали в разделе 17.3.
Решающее воздействие на свойства растущей клетки и, соответственно, на свойства экспоненциально растущей популяции оказывает состав питательной среды. На более богатой среде при прочих равных условиях бактерии имеют больший размер, содержат больше ДНК и чаще делятся.
Питательные среды. По своему химическому составу питательные среды, используемые для выращивания бактерий, в первую очередь подразделяются на природные и искусственные, или синтетические (англ. synthetic medium).
Первые из них, например, растительные соки, непостоянны по составу и характеризуются сложным набором компонентов.
Синтетические среды имеют строго определенный набор компонентов (при этом весьма существенной может оказаться степень очистки реактивов). Их обычно комбинируют таким образом, чтобы удовлетворить пищевые потребности бактерий, и чтобы каждый незаменимый элемент был представлен одним «тематическим» соединением (источник углерода, источник азота и т. д.).
Если синтетическая среда содержит несколько веществ, имеющих одинаковое функциональное значение, они могут использоваться одновременно (например, Rhizobium trifoliiсовместно утилизирует арабинозу, глюконат и маннитол) или друг за другом. Во втором случае присутствие двух источников углерода вызывает феномен катаболитной репрессии, внешне выраженный в двухфазном экспоненциальном росте, или диауксии (см. раздел 18.3.2.2).
Классификацию питательных сред можно расширить с учетом биологических свойств тех бактерий, которые предполагается на них выращивать. Например, предложенные С. Н. Виноградским элективные среды являются основным орудием экспериментальной экологии бактерий. Они создают более или менее избирательные условия для развития специфически адаптированных бактерий, что лежит в основе получения накопительных культур (англ. enrichment culture), а затем чистых культур.
В свою очередь, в медицинской микробиологии со времен Роберта Коха используются т. н. универсальные среды (например, мясопептонный бульон), на которых растут разнообразные копиотрофы, что способствует их быстрому и, насколько возможно, широкому выявлению.
Следует иметь в виду, что гетеротрофные бактерии в ходе своего роста никогда не ограничиваются односторонним удалением субстратов из питательной среды и их полным окислением (до СО2). Обычно они экспортируют побочные продукты метаболизма и секретируют белки. Кроме того, в культуральную среду поступает материал, образующийся при обновлении или лизисе клеточных структур. Некоторые из этих веществ пассивно накапливаются в культуральной среде (что, в частности, вызывает стресс с переходом в стационарную фазу), тогда как другие, например, ацетат, могут реутилизироваться.
В экспоненциальной фазе культуральная среда все время изменяется. При этом из-за невозможности обеспечить равные условия для всей популяции какая-то часть клеток переходит в состояние стресса и даже отмирает. Иными словами, сбалансированный рост — это довольно условное понятие.
При развитии бактерий в определенной среде происходит изменение их популяционного состава. В частности, в результате спонтанного мутирования появляются фитинг-мутанты (см. раздел 16.6.1.1, которые растут с повышенной скоростью и постепенно вытесняют клетки дикого типа.
Максимальная стационарная фаза (англ. maximum stationary phase; рис. 283, 5). Прекращение экспоненциального роста и переход к максимальной стационарной фазе, или фазе голодания, вызвано истощением питательного субстрата. Этот переход соответствует фазе замедления роста (англ. phase of growth deceleration; рис. 283, 4), продолжительность которой зависит как от природы субстрата, так и от плотности популяции. Для разбавленных культур она измеряется часами, а для концентрированных культур долями секунды.
Скорость роста в фазе его замедления является функцией уменьшающейся концентрации экзогенного субстрата в соответствии с уравнением Моно. Далее в течение некоторого времени рост осуществляется за счет эндогенных субстратов (например, резервных полиглюкозидов; см. I том учебника). Затем наступает максималь-
ная стационарная фаза, или фаза голодания, когда из-за отсутствия питательного субстрата численность клеток остается постоянной либо в отсутствии размножения, либо в результате того, что размножение одной субпопуляции компенсируется отмиранием другой.
Фаза ускоренной смерти (англ. phase of accelerated death; рис. 283, 6) и фаза логарифмической смерти (англ. logarithmic death phase; рис. 283, 7).
В этих фазах численность популяции уменьшается, что соответствует «отрицательному» росту. Причиной, приводящей к смерти клеток, может быть внешнее травмирующее воздействие, в частности, экстремальное закисление среды, или эндогенные процессы — старение клеток (см. раздел 17.2.1) и апоптоз (см. раздел 17.2.2).
Диализные культуры. Накопление побочных продуктов метаболизма, например, ацетата, является одним из важнейших факторов, лимитирующих рост культур и вызывающих переход к фазе смерти. Частично устранить их влияние позволяет метод диализного культивирования (англ. dialysis culture). При нем культура помещается в мешок из диализной мембраны, омываемый буферным раствором. Благодаря удалению низкомолекулярных соединений плотность популяции можно увеличить в 30 раз по сравнению с той, которая достигается другими методами культивирования (до 100 г сухого веса • л-1; ~ 5 • 1011 клеток • мл-1).
21.1.2. Закономерности непрерывной культуры
Непрерывная культура принципиально отличается от периодической. Если в первом случае рост ограничен стартовыми субстратами и финальной плотностью популяции, то во втором случае он происходит как угодно долго — при условии, что восполняется убыль субстрата и устраняется прибыль популяции.
Метод непрерывного культивирования имеет два основных преимущества перед методом периодического культивирования. Во-первых, он позволяет неограниченно долго поддерживать культуру в квазистационарном состоянии в широком диапазоне параметров питательной среды; во-вторых, он позволяет активно вмешиваться в процессы роста.
Непрерывное культивирование может осуществляться в одном из двух режимов: в режиме хемостатирования или в режиме турбидостатирования.
Хемостатирование. При использовании хемостата (англ. chemostat; от греч. chemeja — химия и stasis — неподвижность; в данном случае — поддержание квазистационарного состояния путем контроля химического состава питательной среды) плотность популяции стабилизируется путем ограниченного снабжения бактерий тем или иным питательным субстратом. Бактерии размножаются экспоненциально, но не с максимально возможной скоростью. Является ли их рост сбалансированным, неизвестно.
За счет притока в культиватор свежей питательной среды популяция непрерывно разбавляется. Одновременно с этим за счет оттока культуральной среды часть популяции покидает культиватор; оставшаяся часть экспоненциально размножается до квазистационарного уровня, который зависит от концентрации лимитирующего питательного субстрата.
Оптимальный массообмен, или гомогенное распределение молекул и клеток в постоянном объеме культуральной среды обеспечиваются перемешиванием и аэрацией (как правило, по методу непрерывного культивирования выращиваются аэробы или факультативные анаэробы).
Скорость притока в культиватор свежей питательной среды называется скоростью разбавления (англ. dilution rate; D). Она вычисляется по формуле:
D = F/V,
где D — скорость разбавления (ч-1); F — скорость притока свежей питательной среды (л • ч-1); V — объем культиватора; л).
Иными словами, скорость разбавления D — это количество объемов питательной среды, прошедших через культиватор за один час. Величина, обратная D, называется временем удерживания (англ. retention time); она соответствует среднему времени пребывания особи в культиваторе.
При хемостатировании культура находится в квазистационарном состоянии, т. е. популяция микроорганизмов имеет относительно постоянную плотность. Это достигается за счет динамического баланса между двумя противоположно направленными процессами — размножением популяции и ее вымыванием из культиватора. При μ > D плотность популяции возрастает, а при μ<D убывает. Динамический баланс достигается при μ = D.
Напомним, что удельная скорость роста μ = dN/dt • 1/N, т. е. dN/dt = Nμi. В свою очередь, скорость разбавления D = -dN/dt • 1/N, т. е. -dN/dt = ND.
Итоговая скорость изменения плотности популяции равна алгебраической сумме прироста популяции Nμ и убыли популяции ND:
dN/dt = Nμ - ND
или
dN/dt = N(μ - D).
Скорость разбавления контролирует экспериментатор, а скорость роста лимитируется каким- нибудь физико-химическим фактором, обычно источником углерода или азота. Если скорость разбавления D меньше μmax, то через некоторое время после пересева в хемостате установятся, а затем будут автоматически поддерживаться постоянная скорость роста, постоянная плотность популяции и постоянная концентрация лимитирующего субстрата.
Поскольку (см. выше) μ = (μmах • S)/(KS+S), для квазистационарного состояния μ =D мы имеем:
D = (μmах • S)/(КS + S),
или
S = (КS • D)/(μmах - D).
Таким образом, мы получили зависимость между концентрацией лимитирующего субстрата S и скоростью разбавления D (которая совместно с удельной скоростью роста μ определяет плотность популяции 1М). В широком интервале скоростей разбавления и концентраций лимитирующего субстрата плотность популяции изменяется не очень сильно (рис. 285), т. е. хемостат работает в относительно устойчивом режиме, оправдывая свое название.
Рис. 285. Зависимось плотности популяции бактерий в хемостате от концентрации лимитирующего субстрата и от скорости разбавления. N — плотность популяции; D — скорость разбавления; S — концентрация лимитирующего субстрата.
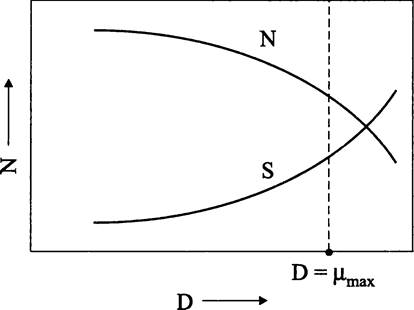
Турбидостатирование. При использовании турбидостата (англ. turbidostat; от лат. turbidus — мутный и греч. stasis — неподвижность; в данном случае — поддержание квазистационарного состояния путем контроля мутности культуры) все питательные субстраты находятся в избытке, и культура размножается с максимальной скоростью. Питомцы Копенгагенской школы (Маалойе, Кьельдгард и Шехтер) назвали рост такой культуры неограниченным (англ. unrestricted growth), подчеркивая, что по своему характеру он является примером сбалансированного роста.
На первый взгляд, турбидостат отличается от хемостата тем, что плотность популяции контролируется не в результате эндогенного баланса между скоростью роста и скоростью разбавления, а путем механического отслеживания мутности культуры. Однако на самом деле все решает постоянная и максимальная скорость роста: когда плотность популяции выходит за рамки, заданные экспериментатором, она корректируется устройством, которое соответствующим образом изменяет скорость разбавления. Иными словами, в хемостате скорость разбавления задается экспериментатором, а в турбидостате она контролируется петлей обратной связи.
То, что в тубридостате бактерии не лимитированы питательным субстратом, позволяет в оптимальном и контролируемом режиме накапливать биомассу, а также изучать их физиолого-биохимические свойства при максимальной интенсивности метаболических процессов.