МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ III - А. В. ПИНЕВИЧ - 2009
ГЛАВА 21. МИКРОБНЫЕ КУЛЬТУРЫ И БИОТЕХНОЛОГИЯ
21.2. Биотехнология
Термин «биотехнология» (от греч. bios — жизнь, technites — ремесленник и logos, в данном случае — дело) при буквальном прочтении означает «использование живых организмов в качестве орудия промышленного производства». Однако сразу нужно оговорить, что речь идет не о человеке и не о животных, которых он эксплуатирует. Кроме того, к сфере биотехнологии не относятся медицинское протезирование, использование стволов растений для изготовления орудий труда или при строительстве, а также поставленное на индустриальную основу сельское хозяйство, в частности, те его отрасли, где выращиваются генетически модифицированные растения.
Если исходить из реальной практики употребления этого термина, то биотехнологией называется эксплуатация ферментативной активности микроорганизмов или клеточных культур для производства целевых продуктов, которые по той или иной причине невозможно или нерентабельно получать искусственньм путем.
В мировой литературе всякий биотехнологический процесс, от получения вина до очистки сточных вод, принято называть ферментацией (англ. fermentation). Однако, говоря «ферментация», мы имеем в виду не ферментативный характер процесса, а отдаем дань традиции. Дело в том, что классические микробные технологии изначально были основаны на брожениях, в первую очередь, на спиртовом брожении (лат. fermentum — брожение). Следует напомнить, что только в отечественной литературе используется архаичный термин «фермент». Его международный эквивалент — «энзим», но даже он семантически восходит к спиртовому брожению (франц. en zymo- tique — «из бродила»; от греч. zyme — закваска, кислое тесто).
В отличие от неорганических катализаторов ферменты, в том числе «биотехнологические» ферменты, функционируют в физиологических условиях и проявляют три уровня специфичности:
— субстратную специфичность (по отношению к определенному классу химических соединений);
— хиральную специфичность (по отношению к одному из двух энантиомеров, правому или левому);
— сайт-специфичность (по отношению к определенному сайту в молекуле субстрата).
Ферменты действуют в качестве орудий биотехнологии либо in situ, т. е. в составе растущих, покоящихся или зафиксированных клеток, либо вне клетки — в результате их секреции продуцентом или после их препаративного выделения.
Ферменты синтезируются в ходе промышленного культивирования. Следует подчеркнуть, что между ним и лабораторным культивированием не существует принципиальных отличий. В обоих случаях в основе культивирования лежат три «кита»:
— культура, в производстве продуцент;
— культуральная среда, в производстве сырье;
— культиватор, в производстве ферментер.
21.2.1. Продуценты
В приведенном определении биотехнологии в качестве основных продуцентов упоминаются микроорганизмы. Они имеют разное строение, разные метаболические свойства и относятся к разным таксономическим группам. Одни из них — прокариоты, другие — протисты, дрожжи или плесневые грибы (табл. 35).
В настоящее время к традиционным продуцентам добавился широкий круг нетрадиционных субъектов биотехнологии, обладающих широкими, еще мало востребованными возможностями. Остановимся на некоторых из них.
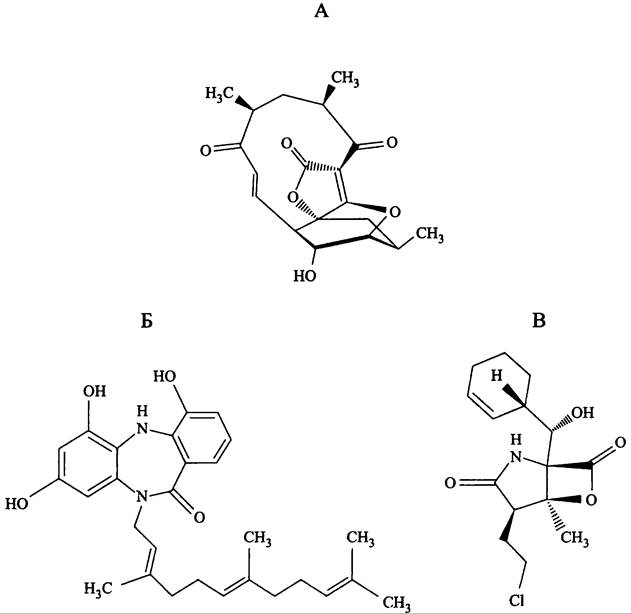
Морские актинобактерии. Из всех продуцентов важнейшими являются актинобактерии, которые синтезируют ~50% биологически активных вторичных метаболитов. Абсолютное чемпионство принадлежит роду Streptomyces. С тех пор, как Зелман Ваксман (S. A. Waksman, Нобелевская премия по физиологии и медицине, 1952 г.) в 1942 г. выделил стрептотрицин, скрининг новых антибиотиков у стрептомицетов ведется на планомерной основе. Общее их число экспоненциально увеличивалось, пока к 2000 г. не достигло ~3 тыс и вышло на плато; кроме того, участились случаи повторного выявления уже известных антибиотиков. Поскольку все, на что способны в плане синтеза антибиотиков почвенные актинобактерии, уже известно, ведутся поиски новых продуцентов в других нишах, в частности в мировом Океане. В настоящее время среди актинобактерий, колонизирующих морские органические агрегаты (морской снег; см. I том учебника), выявлены представители родов Aeromicrobium, Dietzia, Marinophilus, Micromonospora, Rhodococcus, Salinibacterium, Salinispora, Solwaraspora, Streptomyces, Verracosispora и Williamsia. Некоторые из них образуют новые перспективные антибактериальные и антиопухолевые антибиотики, в частности абиссомицин С, диазепиномицин и салиноспорамид А (рис. 286).
Рис. 286. Примеры новых антибиотиков, образуемых морскими актинобактериями. А — абиссомицин С (Verrucosispora sp.); Б — диазепиномицин (Micromonospora sp.); В — салиноспорамид А (Salinispora tropica).
Экстремофилъные археи. В настоящее время описано свыше 3 тыс ферментов, и многие из них либо используются в биотехнологии, либо служат ее целевыми продуктами. Мировой рынок микробных ферментов оценивается ~5 млрд. евро в год; в основном это ферменты бактериального и грибного происхождения. В связи с тем, что большинство из них плохо переносит жесткие физико-химические условия, особую актуальность приобрел скрининг эстремофилов (алкалифилов, ацидофилов, галофилов, психрофилов, пьезофилов и термофилов; см. главу 19) в качестве источника ферментов, устойчивых к экстремальным воздействиям.
Богатым ресурсом ферментов, осуществляющих катализ в экстремальных условиях, являются археи. Ферменты экстремофильных архей стабильны при высокой температуре, высокой ионной силе, экстремальных значениях pH и высоком давлении, а также устойчивы к тяжелым металлам и органическим растворителям.
Особо ценны «термофильные» ферменты, которые обеспечивают высокую скорость реакции, устойчивы к термической денатурации и протеолитическому расщеплению, а также не подвержены микробному заражению. В качестве примеров можно назвать амилолитические ферменты α- амилазу Рyrococcus sрр. и глюкоамилазу Рicrophilus sрр., целлюлолитический фермент β-амилазу Sulfolobus sрр., расщепляющую гемицеллюлозу ксиланазу Pyrodictium abyssii, эндохитиназу Thermococcus chitonophagus, сериновую протеазу Тhermococcus stetteri, эстеразу Аeropyrum pernix и т. д.
Исключительную ценность для молекулярно-биологических исследований с использованием РСR-реакции приобрели редко ошибающиеся ДНК-полимеразы Руrососсиs kodakaraensisи Тhег- mососсus littoralis, а также комбинация ДНК-полимеразы и пирофосфатазы (ТhermoSequenase) из Thermoplasma acidophilum, применяемая при высокоточном секвенировании ДНК.
Продуценты этанола. Этанол и продукт его ферментативного окисления, ацетальдегид служит ценным сырьем для химической промышленности, а первый также является альтернативным энергоносителем. Наряду с химическим синтезом из этилена (2 млн. т • год-1) этанол получают биотехнологическим способом из растительных соков или гидролизатов крахмала и древесины (5 млн. т • год-1). Помимо традиционного продуцента, дрожжей рода Saccharomyces, промышленный интерес представляют, по крайней мере, три новых продуцента — анаэробная мезофильная бактерия Zymomonas mobilis, анаэробная термофильная бактерия Clostridium thermocellum и анаэробная экстремально термофильная бактерия С. thermohydrosulfuricum.
Z. mobilis катаболизирует глюкозу по пути Энтнера-Дудорова (см. II том учебника). Эта бактерия имеет перед дрожжами то преимущество, что она образует этанол с более высокой скоростью и выходом, близким к теоретическому. В свою очередь, преимущество С. thermocellum и С. thermohydrosulfuricum состоит в том, что: (1) при высокой температуре по ходу культивирования можно отгонять летучую азеотропную смесь, содержащую этанол; (2) не нужно охлаждать биореактор; (3) в качестве субстрата можно использовать не дорогие сахара, а дешевые полисахариды.
21.2.2. Сырье и ферментеры
Продуцент служит «рабочей лошадкой» биотехнологии, а условия для реализации его ферментативной активности создаются благодаря использованию сырья и ферментеров.
Сырье. Сырье играет роль субстрата; ферменты продуцента воздействуют на этот субстрат. При этом продуцент может использовать одну из трех стратегий.
Первая стратегия. Продуцент развивается на многокомпонентном биологическом субстрате, изменяя его биохимический состав и консистенцию. Биомасса продуцента совместно с трансформированным субстратом образуют нераздельный целевой продукт, характерным примером которого служит йогурт.
Вторая стратегия. Продуцент приводится во временный контакт с субстратом для того, чтобы изменить его биохимический состав. Если речь идет об индивидуальном соединении и конкретном изменении его молекулярной структуры, это называется микробной трансформацией, или биоконверсией (англ. bioconversion). Характерный пример — трансформация гидрокортизона в преднизолон (см. табл. 35).
Третья стратегия. Продуцент растет на специально подобранной питательной среде с минимально необходимым набором субстратов. В данном случае це-
левым продуктом являются клетки продуцента или их эндогенные компоненты, а также внеклеточные полимеры или низкомолекулярные соединения, накапливающиеся в культуральной среде. В качестве характерного примера можно привести антибиотики.
Основным сырьем для биотехнологии служит углеродсодержащий субстрат. Когда используются первая и третья стратегии, речь идет об источнике углерода.
Источники углерода в первую очередь подразделяются на неорганические и органические (см. II том учебника).
Среди неорганических источников углерода реальное промышленное значение имеют диоксид углерода, метан и метанол. Их используют производственные штаммы фотосинтезирующих или хемосинтезирующих бактерий, в частности Spiralina spp., At. ferrooxidans (см. раздел 21.2.3) и М. methylotrophus (см. табл. 35).
Гораздо шире применяются органические источники углерода. Они, в свою очередь, подразделяются на невозобновляемые и возобновляемые, а также на полимерные и неполимерные.
Невозобновляемые источники углерода — это продукты автотрофного биосинтеза, захороненные в далекие геологические эпохи в виде нефти или природного газа. В частности, это н-алканы, или жидкие парафины с числом атомов углерода 16-18. Они могут использоваться для получения кормовой биомассы дрожжей рода Candida.
Возобновляемые источники углерода — это цельная биомасса или отдельные арматурные, или запасные полимеры растений (в первую очередь, целлюлоза и крахмал), продукты ферментативной или химической деполимеризации этих полимеров, а также сахароза — основной углеродный компонент растительного сока свекловичных культур и сахарного тростника. Поскольку лишь немногие промышленные продуценты обладают собственными целлюлазами, гемицеллюлазами, пектиназами и амилазами, огромное значение имеют штаммы микроорганизмов, служащие источником соответствующих ферментов.
Наряду с природными углеводами, в том числе глюкозой и лактозой, в качестве источника углерода широко применяются синтетический этанол или синтетическая уксусная кислота.
В качестве источника азота могут использоваться белки, мочевина или минеральные соли; источником других макро- и микроэлементов также служат минеральные соли. Помимо основных субстратов, которыми довольствуются прототрофы (см. раздел 16.6.1.1), часто вводятся питательные добавки, содержащие витамины и другие факторы роста — дрожжевой автолизат, кукурузный экстракт, пептон, молочная сыворотка и т. д.
В зависимости от консистенции субстрата ферментация подразделяется на жидкостнофазную (англ. liquid-substrate fermentation) и твердофазную (англ. solid-substrate fermentation).
Большинство современных ферментаций связано с использованием «погруженного» субстрата, который растворен в воде, находится в коллоидном состоянии или образует суспензию разной степени дисперсности. В отличие от этого при твердофазной ферментации на поверхности субстрата не видно влаги, хотя он содержит связанную воду (в частности, лигноцеллюлозный комплекс несет ~75% абсорбированной воды). Такие субстраты характеризуются низкой активностью воды, что вызывает у бактерий (для которых требуется aw ≥ 0,91) состояние стресса, несовместимое с возможностью их практического использования.
Дрожжи и плесневые грибы характеризуются большей толерантностью к низкой активности воды (соответственно, aw ≥0,88 и ≥0,62), что позволяет широко использовать их для получения целевых продуктов из увлажненной растительной и животной биомассы.
По сравнению с жидкостнофазной ферментаций твердофазная ферментация имеет как преимущества, так и недостатки. К преимуществам относятся: (1) высокая концентрация экзоферментов: (2) высокая концентрация продуктов реакции и возможность их извлечения небольшим объемом экстрагирующего агента; (3) изменение консистенции субстрата; (4) обогащение субстрата биомассой продуцента и его экзопродуктами. Недостатками твердофазной ферментации являются: (1) трудность обеспечения массообмена; (2) необходимость большого количества инокулума, который невозможно гомогенно распределить в толще субстрата; (3) затрудненное снабжение кислородом и плохой отвод тепла. Несмотря на перечисленные недостатки, метод твердофазной ферментации широко применяется в производстве традиционных продуктов питания как на Западе (хлеб, сыр, салями и т. д.), так и на Востоке (темпе, соевый соус, натто и т. д.).
Ферментеры. Для производственной ферментации необходим посевной материал. Он выращивается на том же производстве или поступает со специализированных предприятий в виде стартовой культуры, или закваски.
С целью получения посевного материала, а также в центральном производственном процессе — главной ферментации, используются ферментеры.
В зависимости от размера ферментера он может служить как для производственных, так и для исследовательских нужд, либо выполняет исключительно производственные функции.
Как правило, ферментер представляет собой цилиндрический сосуд с соотношением высоты и диаметра 3:1, снабженный: (1) датчиками и/или приспособлениями для отбора образцов, а также устройствами для термостатирования, перемешивания и пеногашения; (2) защищенными от микробной контаминации входами для питательной среды, посевного материала и буферных растворов; (3) выходами для удаления культуры.
Не останавливаясь на конструктивных особенностях ферментеров, отметим, что они подразделяются на: лабораторные (объем ~ 10 л); полупроизводственные (англ. pilot plant; объем ~ 103 л) и производственные ферментеры для главной ферментации (объем ~ 104 и более).
Ступенчатый переход от культивирования в меньшем ферментере к культивированию в большем ферментере называется масштабированием (англ. scale up); объемный коэффициент масштабирования находится в пределах одного-двух порядков.
В зависимости от конструкции ферментера, а также в зависимости от задач, решаемых с его помощью, он может работать как в режиме периодического, так и в режиме непрерывного культивирования.
При использовании ферментеров, работающих в режиме непрерывного культивирования, во многих случаях важно, чтобы продуцент не загрязнял целевой продукт (если, конечно, он сам не является целевым продуктом). Для этого продуцент удерживается в ферментере (или сразу же после выхода из него), что осуществляется с помощью иммобилизации.
Иммобилизация — это прикрепление продуцента или препарата фермента к носителю или их заключение внутри носителя. Прикрепление происходит либо путем адсорбции, либо посредством ионных, гидрофобных или ковалентных связей. Иногда адсорбция сопровождается пришиванием продуцента или фермента к носителю при помощи бивалентного химического реагента (например, глутарового альдегида). Для заключения внутрь носителя используются микрокапсулы, волокнистый материал или полимерный гель. Ярким примером промышленного использования иммобилизации является аэробная очистка сточных вод с помощью активного ила (англ, activated sludge).
Аэробная очистка сточных вод. Благодаря данной технологии, впервые примененной в Манчестере в 1913 г., ежегодно регенерируются ~10 млрд, м3 сточных вод, т. е. это самый крупнотоннажный целевой продукт на Земле.
Сбор и очистка сточных вод являются серьезнейшей проблемой в современных крупнонаселенных и промышленных районах.
Сточные воды различаются по составу и подразделяются на: (1) муниципальные; (2) промышленные и (3) сельскохозяйственные. Они представляют собой сложную смесь твердых частиц, коллоидов и растворенных веществ. Конечная цель очистки — устранить эти загрязнения, в том числе патогенные микроорганизмы и токсичные вещества, чтобы сделать воду безопасной для человека и окружающей среды (куда она возвращается).
Процесс очистки сточных вод состоит из трех основных стадий (рис. 287).
Рис. 287. Схема установки для аэробной очистки сточных вод. I — первичный отстойник; II — аэротенк; III — вторичный отстойник; А — подача сточных вод в первичный отстойник; Б — удаление нерастворимых загрязнений; В — декантация очищенного раствора; Г — удаление избытка активного ила; Д — возвращение активного ила в аэротенк.
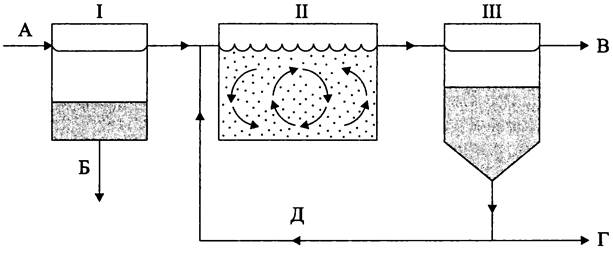
На первой стадии, в первичном отстойнике (англ. primary separating tank) сточные воды путем седиментации, фильтрации и флотации освобождаются от наиболее легко удаляемых нерастворимых загрязнений.
На второй стадии, в аэротенке (англ. aeration tank) первично очищенные сточные воды, содержащие коллоиды и растворенные вещества, главным образом органического происхождения, смешиваются с флоккулами, или хлопьями активного ила (англ. floe; от лат. flocculus — клочок, пушинка) и активно аэрируются. В результате адсорбции и биологического окисления загрязнений они минерализируются и превращаются в СО2, NH3, H2S, N2, Н2 и т. д., а масса активного ила увеличивается.
На третьей стадии, во вторичном отстойнике (англ. secondary separating tank) активный ил спонтанно оседает. Очищенный раствор декантируется и подвергается доочистке путем фильтрации, адсорбции, электродиализа, озонирования, облучения ультрафиолетовым светом, хлорирования и т. д.
Довольно неудачным термином «активный ил» обозначается флоккулированная (англ. flocculate — выпадать хлопьями), т. е. хлопьевидная смешанная культура микроорганизмов, в первую очередь бактерий и протистов. Она имеет очень высокую плотность популяции и благодаря интенсивной подаче воздуха в аэротенк поддерживается в состоянии густой суспензии.
Флоккулы размером ~ 1 мм имеют зернистую структуру и образуются в результате спонтанной иммобилизации клеток внутри смешанной микроколонии. Живые компоненты флоккулы используют загрязнения в качестве питательной среды. Сначала они их адсорбируют, а потом метаболизируют в качестве источника энергии и конструктивного субстрата для собственного роста и размножения. Время удерживания (см. выше) флоккулы в аэротенке составляет несколько часов, и этого достаточно для удаления большей части загрязнений.
После седиментации флоккул во вторичном отстойнике активный ил возвращается в аэротенк, а его избыток удаляется из системы (рис. 287).
Таким образом, активный ил должен обладать двумя основными качествами: (1) способностью адсорбировать и окислять загрязнения; (2) способностью спонтанно седиментировать. Оба эти качества флоккулы определяются видовым составом ее микробиоты, для которой сточные воды играют роль элективной среды.
Путем амплификации генов рРНК, их клонирования и анализа полученных библиотек клонов установлено, что большинство микробиоты во флоккуле принадлежит к числу некультивируемых и виртуальных представителей класса «Betaproteobacteria». В то же время среди культивируемых форм преимущественно выявляются: Pseudomonas spp. (класс«Gammaproteobacteria»): Achromobacter spp., Ralstonia spp. и Zoogloea spp. (класс «Betaproteobacteria»); Bacillus spp. (фила BXIII Firmicutes)-, Micrococcus spp. (фила BXIV Actinobacteria) и Flavobacterium spp. (фила BXX Bacteroidetes). При высоком содержании в сточных водах липидов во флоккулах преимущественно накапливаются Mycobacterium spp., Nocardia spp. и Pseudomonas spp., a аммонийного азота — нитрификаторы Nitrosomonas spp. и Nitrobacter spp.
Несмотря на постоянные риски, связанные с перегрузкой, инактивацией или гибелью активного ила в случае залповых сбросов токсичных веществ, биологическая очистка предпочитается ее техногенной альтернативе.
Анаэробная очистка богатых органикой, в том числе, твердых отходов. Для биологической очистки муниципальных отходов и отходов сельскохозяйственных ферм требуется продолжительный контакт с активным илом, обладающим высокой гидролитической активностью. В данном случае процесс осуществляется в больших закрытых контейнерах — метантенках (англ. anaerobic digestor) без перемешивания и доступа воздуха. Органика разрушается анаэробным деструктивным сообществом, в состав которого входят гидролитики, ацидогенные бактерии, ацетогенные бактерии и метаногенные археи (см. I том учебника).
Конечный продукт анаэробной очистки — не вода, а минеральные соединения, биогаз (смесь 70% метана и 30% СО2) и анаэробный активный ил. Биогаз, выход которого составляет 200-300 л • кг-1 переработанного органического вещества, используется в качестве альтернативного энергоносителя, а анаэробный активный ил, содержащий витамины (в частности, витамин В12) и микроэлементы, идет на приготовление биоудобрений или комбикормов.
21.2.3. Продукты биотехнологии
Основные группы целевых продуктов, с примерами и соответствующими продуцентами, приводятся в таблице 35.
Биотехнология, как и любое производство, подчиняется экономической целесообразности, и выбор метода, в конечном счете, зависит от рентабельности. Некоторые целевые продукты, например, натуральный йогурт, получают исключительно с помощью молочнокислых бактерий. Другие, например, уксусную кислоту, можно получить как путем неполного окисления этанола с помощью уксуснокислых бактерий или путем автотрофного биосинтеза с помощью ацетогенных бактерий, так и путем химического синтеза (см. II том учебника).
Как видно в табл. 35, спектр целевых продуктов биотехнологии чрезвычайно широк — от индивидуально используемых традиционных продуктов питания до продуктов ремедиации, представляющих собой коллективное достояние. В качестве иллюстрации биотехнологического процесса рассмотрим получение меди методом микробного выщелачивания. На первый взгляд, мы имеем дело с экзотическим случаем. Однако здесь присутствуют все аспекты культивирования, а с точки зрения рентабельности это яркий пример того, как биологический процесс служит альтернативой техногенному процессу.
Гидрометаллургия. Классическая пирометаллургия (от греч. ругов —огонь) основана на огненной выплавке металлов. При использовании этой технологии земная поверхность загромождается шлаками, а воздух загрязняется пылью и вредными газами; кроме того, обработка труднодоступных, частично выработанных или бедных руд нерентабельна. Альтернативным методом, лишенным негативных свойств пирометаллургии, является биотехнологический процесс гидрометаллургии (от греч. idor — вода).
Таблица 35. Классификация целевых продуктов
Группа целевых продуктов |
Пример (с продуцентом) |
Традиционные продукты питания и алкогольные напитки |
Трансформированная растительная биомасса (хлеб; S. cerevisiae) или ферментированное молоко (йогурт; Lactobacillusbulgaricus); ферментированные растительные соки (вино; S. cerevisiae) и гидролизаты крахмала (сакэ; Aspergillusoryzae) |
Микробная биомасса |
Белок одноклеточных (Methylophilus methylotrophus); биоинсектициды (В. thuringiensis) |
Липиды |
Каротиноиды (β-каротин; Dunaliella salina); биопластмассы (полиоксиалканоаты; Ralstonia eutropha); поверхностно-активные вещества (рамнолипид; Pseudomonas aeruginosa) |
Неферментативные биополимеры |
Полисахариды (целлюлоза; Gluconacetobacter oxydons) |
Ферменты |
Ксилозоизомераза (В. coagulons) |
Коферменты |
Витамин B12(Propionibacterium shermanii) |
Метаболические интермедиаты или их производные |
Органические кислоты (янтарная кислота; Е. coli) |
Первичные метаболиты |
Аминокислоты (лизин; Corynebacterium glutamicum); нуклеотиды (инозинмонофосфат; Brevibacterium. аm- moniagenes) |
Вторичные метаболиты |
Антибиотики (стрептомицин; S. griseus) |
Продукты биоконверсии (локального структурного превращения) субстрата |
Трансформированные стероиды (гидрокортизон —> преднизолон; Mycobacterium globiforme) |
Продукты гидрометаллургии |
Медь (Acidithiobacillus ferrooxidans) |
Альтернативные энергоносители |
Биогаз (анаэробное деструктивное сообщество, в т. ч. Methanobacterium thermoautotrophicum); топливный этанол (Zymomonas mobilis) |
Продукты ремедиации |
Сточные воды после аэробной очистки (активный ил; в т. ч. Zoogloea ramigera); десульфурированный уголь (Rhodococcus erythropolis)\ почва и вода, очищенные от галоорганических соединений (Pseudomonas spp.) |
Гидрометаллургия, или биологическая горная промышленность (англ. biomining) основана на двух процессах:
— на микробном выщелачивании (англ. bioleaching; acid mine drainage, AMD), или биохимическом взаимодействии бактерий с минералами, в результате которого атомы металла из узлов кристаллической решетки переходят в раствор в ионной форме; одним из примеров служит получение меди из сернистых руд;
— на биологическом окислении (англ. biooxidation), когда бактерии разрушают минерал, однако металл остается в элементной форме; уникальным примером служит извлечение примеси золота из арсенопирита.
Биореакторы для выщелачивания металлов действуют в Австралии, Бразилии, Гане, Испании, России, США, Чили и ЮАР. Столь широкое распространение данной технологии обусловлено рядом факторов. Во-первых, рудные месторождения, где добыча металлов производится физикохимическими методами, истощаются. Во-вторых, микробное выщелачивание дешево и низкоэнергоемко. В-третьих, микробное выщелачивание позволяет полностью извлечь металл из отходов традиционных горнодобывающих систем.
Продуценты. Микробное выщелачивание могут осуществлять хемосинтезирующие железо- или серобактерии Acidithiobacillus caldus, At. ferrooxidans, At. thiooxidans, Leptospirillumferrooxidans и Sulfobacillus spp., а также археи Acidianus spp., Рerroplasma sрр., Мetallosphaera sрр, и Sulfolobus sрр. Они ферментативным путем окисляют атомы серы в узлах кристаллической решетки до серной кислоты. Образовавшаяся серная кислота растворяет минерал и превращает атомы железа в катионы Fе2+, а атомы меди — в катионы Сu2+. Помимо этого, продуцент ферментативным путем окисляет катион Fе2+ в катион Fе3+. Катион Fе3+ окисляет атомы меди в катионы Сu2+, что приводит к регенерации катиона Fе2+ и т. д.
Природные штаммы Аt. ferrooxidans, Аt. thiooxidans и L. ferrooxidans накапливаются в промышленных установках спонтанно. Эти хемолитоавтотрофы адаптированы к высокой кислотности среды, т. е. условия, в которых происходит выщелачивание металлов, являются для них элективными. Однако они медленно окисляют рудный минерал, что увеличивает продолжительность обработки руды. Альтернативой являются мутанты, адаптированные к росту на конкретном минерале. В случае бактерий, геном которых секвенирован (например, Аt. ferrooxidans), методами генной инженерии можно получить производственные штаммы с заданными характеристиками.
При выборе продуцента учитываются тип минерала и экологические особенности продуцента.
Самым распространенным сырьем служат сернистые руды, которые подразделяются на кислоторастворимые и не растворимые в кислоте. К группе кислоторастворимых минералов относятся галенит РbS, сфалерит ZnS и халькопирит СuFeS2. Они растворяются под влиянием протонов и/или катионов Fе3+. Не содержащие железа медные, свинцовые или цинковые руды перерабатываются бактериями, которые окисляют серу, но не обладают Fе-оксидазной активностью (например, Аt. caldus или Аt. thiooxidans). К группе не растворимых в кислоте руд относятся пирит FеS2 — один из наиболее распространенных в природе минералов железа, а также вольфрамит WS2 и молибденит МоS2. Окислительным агентом служат катионы Fе3+, т. е. в данном случае требуются штаммы, обладающие Fе-оксидазной активностью. Чаще всего это At. ferrooxidans и L. ferrooxidans, которые получают энергию за счет реакции: Fе2+ —> Fе3+ + е-). Наряду с железом эти бактерии окисляют серу до серной кислоты, т. е. они могут быть использованы и для окисления кислоторастворимых руд. Разрушению руды способствует прикрепление бактерий к минеральным частицам. Клетки Аt. ferrooxidans и L. ferrooxidans выделяют кислые полисахариды и активно делятся в их толще, образуя биопленку.
При подборе продуцента учитываются температура, pH и концентрация тяжелых металлов. Большинство продуцентов (в частности, штаммы Аt. ferrooxidans, Аt. thiooxidans и L. ferrooxidans), имеет topt 20°-35°С, т. е. принадлежит к мезофилам, что соответствует условиям выщелачивания под открытым небом. Использование этого температурного диапазона в биореакторе малоэффективно, поскольку не обеспечивается достаточно высокая скорость реакции. Подбор умеренно термофильных штаммов данных бактерий позволил бы проводить процесс при 40°-50°С. Наряду с этим разрабатывается технология с использованйем Аt. caldus и Sulfobacillus sрр., что дает возможность поднять температуру до 75°-78°С. Наилучшая перспектива — использовать архей, которые окисляют сернистые железные руды, в частности термофила Sulfolobus metallicus (topt 68°С) и экстремального термофила Metallosphaera sedula (topt 80°-85°С). Вторым критерием успеха служит способность продуцента развиваться при накоплении серной кислоты в ходе разрушения руды. Хотя все упомянутые бактерии и археи являются облигатными ацидофилами, их реакция на высокую кислотность среды существенно различается. Например, для Аt. ferrooxidansоптимальное значение pH составляет 1,8-2,0. В то же время L. ferrooxidans более устойчив к кислоте и развивается даже при pH 0,7. Наконец, продуцент должен развиваться при высокой концентрации тяжелых металлов, а также в присутствии других токсичных компонентов руды, которые переходят в раствор одновременно с целевым продуктом.
Технология выщелачивания меди. В настоящее время медь занимает ведущее место среди целевых продуктов гидрометаллургии. По данным открытой мировой статистики, в установках микробного выщелачивания ежегодно обрабатываются >30 млн. т медной руды. Сырьем служат борнит Сu5FeS4, ковеллит СuS, кубанит СuFе2S3, халькопирит СuFеS2, халькоцит Сu2S и энаргит Сu3AsS4. Чаще всего используются бедные руды с содержанием меди <0,4%, а также отвалы, остающиеся после физико-химической переработки богатых руд и содержащие немного меди.
Из халькопирита медь выщелачивается согласно эмпирическому уравнению реакции:
4CuFeSo2+ 17O2 + 2H2SO4—> 4CuSO4+ 2Fe2(SO4)3 + 2Н2O.
Образующиеся катионы Fe3+ окисляют минерал, ускоряя процесс выщелачивания.
Другим минералом меди, который подвергается бактериальному выщелачиванию, является халькоцит Cu2S. Предварительно он превращается в ковеллит CuS:
Cu2S + 1/2O2 + H2SO4 —> CuS + CuSO4 + H2O.
Ковеллит окисляется дальше:
CuS + 2O2 —> CuSO4.
Для выщелачивания меди, как правило, используются не чистые культуры бактерий, а смешанные природные популяции. Чаще всего из промышленных установок можно выделить железоокисляющих бактерий At. ferrooxidans и L. ferrooxidans. При разрушении медно-серных минералов в качестве промежуточного продукта образуется элементная сера, обволакивающая частицы руды и затрудняющая доступ к ним; поэтому при выщелачивании меди большое значение имеют бактерии, окисляющие элементную серу, в частности At. thiooxidans.
Выщелачивание меди следует ирригационному принципу, когда через груду руды пропускается рабочий раствор. В результате жизнедеятельности продуцента он обогащается катионами Сu2+. При этом, в соответствии со спецификой пространственной организации процесса, используются три метода:
— выщелачивание отвалов (англ. dump leaching);
— кучное выщелачивание (англ. heap leaching);
— выщелачивание in situ.
Самым простым в технологическом плане является выщелачивание отвалов. Из экономии их удобно размещать вблизи шахты, откуда руду доставляют на конвейере. Выбираются площадки с естественным уклоном, что дает возможность самотеком собирать обогащенный металлом раствор. Отвалу придают форму усеченного конуса высотой до 200 м (диаметр основания 250 м, вершины 80 м); он обычно содержит 3 • 104-5 • 104 т руды.
Для выщелачивания отвалов используют рабочий раствор, подкисленный серной кислотой до pH 1,5-3,0. Его разбрызгивают по поверхности или подают через вертикальные трубы. Серная кислота, молекулярный кислород и диоксид углерода, содержащиеся в рабочем растворе, обеспечивают элективные условия для продуцента, разрушающего минерал. Чтобы усилить аэрацию, отвал снабжают пневматической системой, через которую поступает воздух. Просочившийся сквозь отвал раствор, содержащий 0,75-2,2 г • л-1 меди, собирают и после извлечения металла используют повторно.
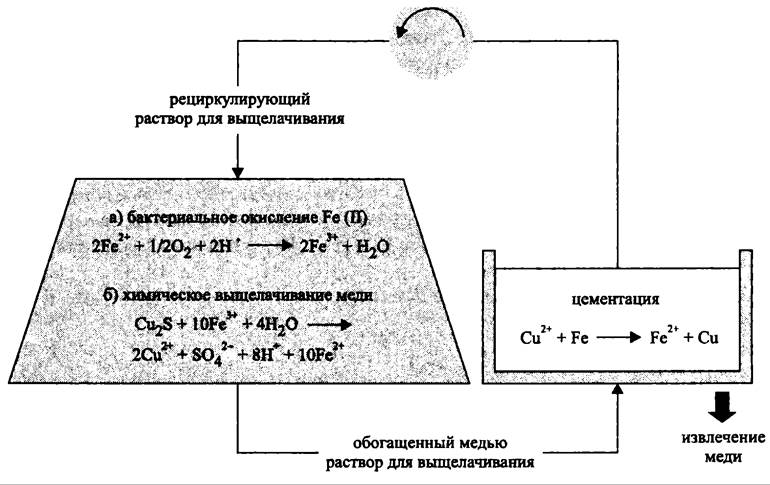
Кучное выщелачивание в общих чертах сходно с выщелачиванием отвалов, однако оно сложнее в технологическом отношении (рис. 288). В данном методе руду измельчают, увлажняют серной кислотой и загружают во вращающиеся барабаны, где образуются частицы стандартного размера. Из подготовленного таким образом субстрата делают насыпь высотой 2-10 м на полиэтиленовой подложке, чтобы раствор не просачивался в грунт или материнскую породу. По трубам поступает рабочий раствор, к которому добавляют (NH4)2SO4 и КН2РO4, стимулирующие рост бактерий. Для аэрации насыпь может быть снабжена воздуховодными трубами. Благодаря технологическим особенностям кучного выщелачивания срок полного извлечения меди из руды составляет несколько лет, как и при выщелачивании отвалов, а в отдельных случаях несколько месяцев.
Рис. 288. Схема установки для кучного выщелачивания меди. Объяснение в тексте.
Выщелачивание in situ производится под землей, в толще рудного тела. В зависимости от глубины залегания и расположения по отношению к уровню грунтовых вод выделяют три типа руд, залегающих: (1) выше уровня грунтовых вод; (2) ниже уровня грунтовых вод, но еще доступных для разработки шахтным способом; (3) слишком глубоко под водоносным слоем, разработка которых экономически не выгодна.
Способ добычи меди из сульфидных руд типов (1) и (2) зависит от того, сколько они содержат металла. При относительно высоком содержании меди руду, как правило, добывают шахтным методом с последующим кучным выщелачиванием или выщелачиванием отвалов. Напротив, для бедных руд больше подходит способ выщелачивания in situ — при этом породу измельчают с помощью подземного взрыва, затем закачивают в нее рабочий раствор и спустя некоторое время через скважины извлекают отработанный раствор, обогащенный медью.
Заметим, что медь можно выщелачивать in situ как биологическим, так и химическим путем. Во втором случае решающее значение имеет подбор окислительного реагента.
Для окончательного извлечения меди используют два метода: (1) вытеснение железом и (2) экстракция растворителями.
В основе первого метода лежит химическая реакция вытеснения меди металлическим железом. Для этого в отработанный раствор помещают щетки из железного скрапа (англ. scrape— металлолом), на которых протекает обменная реакция:
Cu2+ + Fe —> Сu + Fe2+.
Чистота полученной таким способом порошковой, или «цементной» меди составляет ~85%. Для дальнейшей очистки металл смешивают с флотационным составом, после чего собирают и отправляют на переплавку.
При экстракции растворителями к отработанному раствору добавляют органический растворитель, поглощающий катионы меди. После разделения фаз вносят серную кислоту, и образовавшийся медный купорос подвергают электролизу; металлическая медь, выделяющаяся на катоде, имеет чистоту 99,9%.
* * *
Работа с микробными культурами и практическое использование культивирования в биотехнологии являются альфой и омегой биологии прокариотов.
В нынешний век биоинформатики, когда цитогенетику, онтогенез, регуляцию, автоэкологию и синэкологию (см. главы 16-20) можно успешно изучать, не отходя от компьютера, все-таки сохраняют свое значение два основополагающих метода микробиологии — световая микроскопия и культивирование.
Постоянная зависимость профессионального микробиолога от этих методов определяет специфическое и довольно обособленное положение, которое микробиология занимала и занимает среди других биологических наук.
Без использования микроскопии и без культивирования человек никогда не узнал бы о существовании прокариотов, не получил бы сведений об их строении, свойствах и разнообразии, а также не научился бы решать практические вопросы биотехнологии и медицинской микробиологии.