Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Третичная структура белка
Стабильность пространственной структуры белка
Третичной структурой называют распределение в пространстве всех атомов белковой молекулы. При этом не учитывают взаимодействия этой глобулы с соседними глобулами или субъединицами. Часто понятие третичной структуры сужают, концентрируя внимание на наиболее устойчивом ее элементе — свойственном данному белку способе укладки полипептидной цепи в пространстве. Характерно, что для больших групп эволюционно родственных белков, подчас очень значительно отличающихся по первичной структуре и, значит, по распределению всех атомов в пространстве, способ укладки полипептидной цепи остается в главных чертах неизменным. Это показывает, что допускаемое упрощение оправданно, так как отражает существенные черты третичной структуры.
Известное сходство приведенного определения третичной структуры с понятием вторичной структуры лишь внешнее, поскольку вторичная структура характеризует относительно небольшой участок белка и определяется локальными нековалентными взаимодействиями, тогда как третичная структура зависит от всей суммы взаимодействий — ковалентных и нековалентных — в белковой глобуле.
Третичная структура — основа функциональности белка, которая требует точной пространственной организации больших ансамблей, построенных из множества аминокислотных остатков и их боковых групп. Такие ансамбли формируют активные центры ферментов, зоны связывания других биологических молекул, эффекторные центры белков и т.д. поэтому нарушение третичной структуры белка (денатурация) неизменно приводит к утрате им способности функционировать.
Стабильность третичной структуры зависит от системы нековалентных взаимодействий внутри белковой глобулы. Некоторые белки дополнительно стабилизируются ковалентными — дисульфидными — связями; однако немало белков, в том числе достаточно стабильных, вовсе их лишены.
Среди нековалентных взаимодействий, реализующихся при образовании пространственной структуры белка, наибольшую точность в фиксировании межатомных расстояний и углов обеспечивают водородные связи. Им, как известно, принадлежит решающая роль в формировании вторичной структуры, в особенности периодических ее элементов: а-спиралей и ß-структур. В дополнение к этому водородные связи соединяют между собой и с главной цепью множество функциональных групп боковых цепей аминокислотных остатков, например

Существенно, что внутри белковой глобулы реализуется не менее 90% возможных водородных связей.
Система водородных связей наряду с другими нековалентными взаимодействиями — ван-дер-ваальсовыми связями и электростатическими контактами — чрезвычайно важна для стабилизации компактной нативной белковой глобулы. Действительно, изменение свободной энергии и, значит, константа К равновесия пептидная цепь ↔ белковая глобула в первом приближении определяется уравнением
![]()
(Подчеркнем, что ролью воды, окружающей белок, мы пока пренебрегаем, рассматривая белковую молекулу как бы находящейся в вакууме, на это и указывают индексы «цепь».)
В этом выражении величина ∆Нцепь отрицательна, что отражает вклад нековалентных взаимодействий, устанавливающихся внутри белковой глобулы. Для стабилизации глобулы эта величина должна компенсировать энтропийный член — T∆Sцепь, который положителен, так как свертывание неупорядоченного клубка — неструктурированной полипептидной цепи — в глобулу упорядочивает структуру и влечет за собой убыль энтропии пептидной цепи, а следовательно, ∆S отрицательна. Если такая компенсация достигнута, то К окажется равной единице и, значит, доли нативных и денатурированных молекул белка станут равными. Для того чтобы равновесие отчетливо сдвинулось в сторону образования: компактной структуры, понадобится существенное превышение значения ∆Нцепь над величиной Т∆Sцепь.
Соотношение же этих двух величин зависит прежде всего от числа нековалентных связей, устанавливающихся при свертывании полипептидной цепи в глобулу, а значит, от длины пептидной цепи. Этим объясняется обсуждавшаяся уже граница между пептидами и белками. В то же время видно, что с ростом температуры Т член T∆S рано или поздно превысит по абсолютной величине ∆Н и пространственная структура утратит стабильность — произойдет тепловая денатурация белка.
Реальная картина, однако, существенно зависит от учета взаимодействия белка с растворителем, обычно с водой. Действительно, вода способна образовывать водородные связи как с пептидными группировками, так и с функциональными группами белка, конкурируя с формированием внутримолекулярных связей.
Если сравнить развернутое, денатурированное состояние белка со свернутым, нативным, то окажется, что при упаковке внутрь глобулы полярной группы:
1) последняя дает водородную связь с какой-либо другой полярной группой белка;
2) разрываются водородные связи, которые обе эти группы — донор и акцептор — в развернутой цепи имели с водой;
3) устанавливаются водородные связи «освободившихся» молекул воды с другими ее молекулами.
Рассмотрим, например, поведение двух полярных групп — гидроксила серина и амидной группы аспарагина, образующих внутримолекулярную водородную связь при свертывании цепи в компактную структуру

В целом никакого выигрыша в числе водородных связей при свертывании глобулы произойти не может, так как одновременно утрачиваются водородные связи цепь — вода. Важно, чтобы неизбежный проигрыш — снижение числа водородных связей в результате того, что при свертывании какие-то полярные группы, погрузившись в глобулу, не найдут партнера и не смогут образовывать водородной связи, — не оказался слишком значительным (этим-то и диктуется необходимость образовать максимально высокое их число внутри глобулы: как уже отмечалось, не менее 90%) Понятно, что столь высокая степень насыщения глобулы водородными связями не может быть реализована хаотически. Гораздо эффективнее в этом смысле регулярные элементы вторичной структуры.
При свертывании глобулы убывает энтропия пептидной цепи, но одновременно происходит возрастание энтропии растворителя — воды. Последнее играет решающую роль в стабилизации третичной структуры белка, что объясняется следующими соображениями.
Как известно, вода представляет собой весьма необычный, в высокой мере структурированный растворитель. Каждая ее молекула способна участвовать в образовании четырех водородных связей с другими молекулами воды. В результате в воде сосуществуют, находятся в динамическом равновесии со свободными молекулами относительно протяженные квазикристаллические льдоподобные структуры. Полярные соединения, в том числе полярные группы белка, относительно легко включаются в такие структуры, устанавливая водородные связи с окружающей белок водой.
Сложнее обстоит дело при взаимодействии с водой неполярных боковых цепей белка. На модельных соединениях — простейших углеводородах — показано, что они могут в небольшой степени растворяться в воде. При этом их молекулы, неспособные устанавливать водородные связи, включаются в своеобразные «пустоты» в динамической структуре воды — полости, ячейки. Последние образованы молекулами воды, связанными между собой водородными связями (рис. 6.1).
По существу, это напоминает так называемые соединения включения. Возникновение таких ячеек означает упорядочение, выключение из хаотического движения значительного числа молекул воды, т.е. уменьшение энтропии растворителя — воды. Уменьшение энтропии, которое оказывается тем большим, чем больше поверхность раздела неполярные группировки — вода, ограничивает растворение углеводородов в воде: термодинамически выгодным оказывается расслоение системы, образование двух фаз — водной и углеводородной.
Нечто аналогичное сопровождает и растворение в воде пептидной цепи, несущей неполярные боковые группы. Каждая из таких групп оказывается в ячейке, окруженной структурированными молекулами воды, что приводит к уменьшению энтропии системы. «Отслаивание» углеводородных радикалов в этом случае, понятно, невозможно: они нанизаны на скелет полипептидной цепи. Поэтому реализуется другой процесс — свертывание глобулы, при котором значительная часть (не менее половины) гидрофобных боковых цепей оказывается скрытой от контакта с окружающей белок водой. При этом нередко наблюдается образование своеобразных внутримолекулярных «капель» из гидрофобных боковых цепей аминокислот, «гидрофобных ядер» более или менее сложной формы. Иногда такие ядра вытянуты, напоминая полумесяц, иногда распадаются на два-три самостоятельных небольших ядра. Важно, что уменьшение поверхности соприкосновения гидрофобных групп с водой приводит к установлению между ними так называемых гидрофобных контактов. Заметим, что сближение неполярных групп влечет за собой установление ван-дер-ваальсовых контактов между ними, в определенной мере также стабилизирующих белковую глобулу. Однако вклад этих весьма слабых взаимодействий в энергетику процесса свертывания белка невелик, тогда как роль гидрофобных контактов, иными словами, роль изменения энтропии растворителя при свертывании белка, очень значительна.
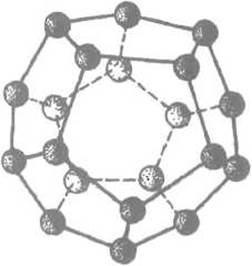
Рис. 6.1. Додекаэдр, образованный молекулами воды, соединенными водородными связями.
Внутри додекаэдра образуется полость диаметром около 5 А, в которой может быть размещено гидрофобное, т.е. не дающее водородных связей с водой, соединение. Формирование додекаэдра или аналогичных правильных структур с более крупными полостями требует упорядочения расположения молекул воды, тем большего, чем больше поверхность разместившегося в полости соединения. Это приводит к понижению энтропии системы и делает выгодным объединение гидрофобных элементов белка в ядро
Термодинамика свертывания белковой глобулы характеризуется тем, что факторы, способствующие образованию компактной нативной структуры, и факторы, действующие в противоположном направлении, почти сбалансированы. Изменение свободной энергии при свертывании белка, содержащего примерно 100 аминокислотных остатков, составляет около 10 ккал/моль, или всего лишь 0,1 ккал в расчете на один аминокислотный остаток. Для сравнения укажем, что энергия водородной связи составляет около 3 ккал.
Еще важнее, что эта удивительно небольшая величина оказывается разностью двух достаточно крупных, но сбалансированных величин. Последнее приводит к тому, что белковая глобула может утрачивать стабильность, разворачиваться уже при относительно небольшом изменении указанных величин. Например, утрата только одной водородной связи при замене в лизоциме фага Т4 треонина изолейцином снижала температуру денатурации белка на 11°. Существенно, что дестабилизация третичной структуры белка может быть вызвана не только воздействием на белок, но и изменением структуры растворителя — воды.
Известно несколько способов оценки гидрофобности боковых цепей аминокислот, входящих в состав белка. Согласно одному из них, предложенному Р. Вольфенденом, определяют распределение соединений, моделирующих боковую цепь того или иного остатка между водой и находящимся в равновесии с ней паром. Так, боковая цепь треонина аппроксимировалась этиловым спиртом, радикал аланина — метаном и т.п. В этих условиях гидрофобные соединения будут стремиться покинуть воду и перейти в пар.
Оказалось, что по величине константы равновесия паровая фаза/вода (т.е. по склонности перехода в пар) боковые цепи аминокислот могут быть собраны в следующие группы:
1. Константа порядка 102 — глицин, лейцин, изолейцин, валин, аланин.
2. Константа порядка 101 — фенилаланин, цистеин, метионин.
3. Константа порядка 10-4 — треонин, серин, триптофан, тирозин.
4. Константа порядка 10-8 — аспарагин, лизин, глутамин, глутамат, гистидин, аспартат.
5. Константа 10-14 — аргинин.
Первые две группы включают в себя гидрофобные аминокислоты, боковые цепи которых стремятся избежать контакта с водой. Помещение глицина в первую группу объясняется тем, что молекула водорода плохо моделирует атом водорода в глицине, В действительности при упаковке остатков глицина в белке особенно значителен вклад пептидной группировки —NH—СН—СО—, поэтому глицин трудно отнести к гидрофобным остаткам. Впрочем, известны случаи, когда в фиксированной третичной структуре белка метиленовая группа остатка глицина —СН2— выполняет роль гидрофобного звена.
Третья-пятая группы включают гидрофильные аминокислотные остатки. Для пролина в рамках данного подхода нельзя предложить модели. Анализ пространственных структур множества белков показывает, что указанное отнесение аминокислот к гидрофобным или гидрофильным в общем коррелирует с их распределением преимущественно внутри или на поверхности белковой глобулы (табл. 6.1, 6.2).