Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Ферменты
Алкогольдегидрогеназа
Как ни велики возможности ансамблей, образованных функциональными группами белка, в ряде случаев они недостаточны, например при катализе некоторых окислительно-восстановительных реакций. Такие затруднения, однако, могут быть преодолены путем вовлечения в механизм действия ферментов небелковых лигандов — ионов металлов или коферментов. Примером такого механизма является действие алкогольдегидрогеназы печени.
Этот фермент катализирует перенос гидрид-иона Н- от группы СН2ОН первичных спиртов различной структуры на никотинамидную часть кофермента — никотинамидадениндинуклеотид (НАД). Схематически эта реакция может быть представлена следующим образом:

Тот же фермент, как обычно, способен катализировать и обратную реакцию — восстановление альдегида до спирта.
Хорошо изученная алкогольдегидрогеназа печени лошади построена из двух одинаковых субъединиц, каждая из которых содержит в одной полипептидной цепи 374 аминокислотных остатка и образует два домена. Каталитический домен, в котором локализованы все компоненты активного центра фермента, в том числе и остатки, связывающие еще один небелковый лиганд — участвующий в катализе ион цинка, — объединяет N-концевой (остатки 1-175) и С-концевой (остатки 319-374) фрагменты полипептидной цепи.
Кофермент(нуклеотид)связывающий домен сформирован центральным фрагментом (остатки 176-318). По вторичной и третичной структуре он очень сходен с нуклеотидсвязывающими доменами других ферментов, хотя их первичные структуры не обнаруживают сколько-нибудь существенных соответствий.
Предполагают, что характерная пространственная структура нуклеотидсвязывающего домена возникла на весьма ранних этапах эволюции и многократно использовалась как готовый функциональный модуль, который мог объединяться с соответствующими каталитическими центрами, образуя различные ферменты, содержащие НАД в качестве кофермента. Понятно, что такой путь эволюции ферментов эффективнее создания всякий раз de novo функционально однотипной структуры.
Контакт между субъединицами определяется: преимущественно взаимодействием нуклеотидсвязывающих доменов, которые образуют своего рода «ядро» димера. Как это нередко бывает при образовании четвертичной структуры, ß-складчатый лист одной субъединицы «стыкуется» с такой же структурой другой субъединицы, образуя весьма протяженный ß-складчатый слой. Это взаимодействие дополняется развитой сетью гидрофобных контактов, в которых участвует около 30 аминокислотных остатков, что делает диссоциацию димера весьма трудной даже в 8 М мочевине.
Связывание кофермента. Аденозиндифосфатрибозный фрагмент НАД дает множество нековалентных контактов с ферментом. Аденин располагается в гидрофобном кармане, 2'-гидроксил рибозы аденозина образует водородную связь с карбоксилом Asp-223, пирофосфатная группировка — солевую связь с гуанидином Arg-47, принадлежащего каталитическому домену. «Концевой», т.е. ближайший к никотинамиду, остаток рибозы образует водородные связи с карбонильными группами Gly-293 и Ilе-269. Множественность нековалентных связей обеспечивает точное размещение кофермента в активном центре алкогольдегидрогеназы.
Связывание субстрата. Зона связывания субстрата располагается в глубоком «кармане» — канале между каталитическим и нуклеотидсвязывающим доменами одной из субъединиц, но в нее входят и отдельные аминокислотные остатки второй субъединицы. Этот канал как бы выстлан гидрофобными боковыми цепями, что позволяет установить гидрофобные контакты с радикалом R спирта. Интересно, что формирование канала завершается после связывания НАД и вызванного этим изменения конформации фермента. Алкогольдегидрогеназа печени может связывать весьма различные спирты — от этанола до производных бензилового спирта С6Н5СН2ОН, ω-оксикислот и даже стероидных спиртов. Важно лишь, чтобы они содержали в своей структуре гидрофобный фрагмент. Среди остатков, участвующих в связывании бензилового спирта, Leu-116 и Leu-57, Val-294 и Phe-93. Сорбируясь, субстрат выталкивает из зоны связывания несколько молекул воды и в определенной мере стягивает прилегающую часть фермента в более компактную структуру. Не исключено, что это весьма небольшое изменение строения фермента, наведенное связавшимся субстратом, играет существенную роль в катализе.
Компоненты каталитического центра. Каталитический центр алкогольдегидрогеназы содержит ион цинка, который окружен четырьмя лигандами, расположенными в вершинах неправильного тетраэдра. Три из них принадлежат белку — это тиоловые группы остатков Cys-16 и Cys-174 и имидазол His-67. Четвертое координационное место занимает кислород субстрата, а в его отсутствие — молекула воды. Гидроксильная группа остатка Ser-48 способна образовать водородную связь с кислородом лиганда — воды или спирта.
Вероятный механизм действия фермента. Предполагают, что спирт, гидрофобная цепь которого связана в гидрофобном канале фермента, ориентируется так, что его кислород устанавливает непосредственную связь с ионом цинка, вытесняя из четвертого координационного положения находившуюся там молекулу воды (рис. 10.10). Это приводит к отщеплению протона гидроксильной группы, причем связь с ионом цинка образует алкоголят-анион спирта R—СH2О-:
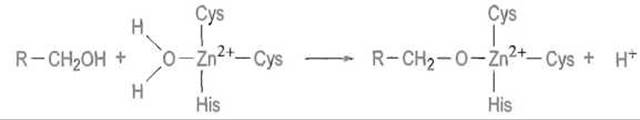
Понятно, что существование такой структуры, чрезвычайно чувствительной к гидролизу, возможно только внутри каталитического центра, где реакция разыгрывается в отсутствие контактов с водой.
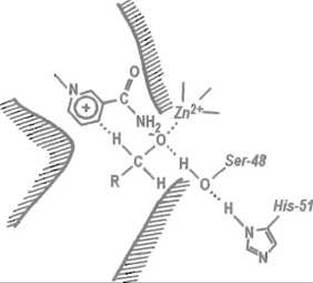
Рис. 10.10. Размещение субстрата в активном центре алкогольдегидрогеназы.
При связывании субстрата (спирта) его гидроксильная группа сближается с ионом цинка и утрачивает протон, превращаясь в алкоголят. В отщеплении протона и стабилизации алкоголята участвует система водородных связей с Ser-48 и His-51
В этом еще раз проявляется характерная особенность ферментативного катализа — перенос реакции в благоприятную среду.
Алкоголят-анион далее стабилизируется путем смещения электронной плотности от атома кислорода алкоголята к связи С—О, которая в конечном счете превращается в двойную, а гидрид-ион от атома углерода переносится, видимо, по структурно детерминированному пути в положение 4 никотинамидного ядра кофермента, причем НАД+ превращается в восстановленную форму НАДН:
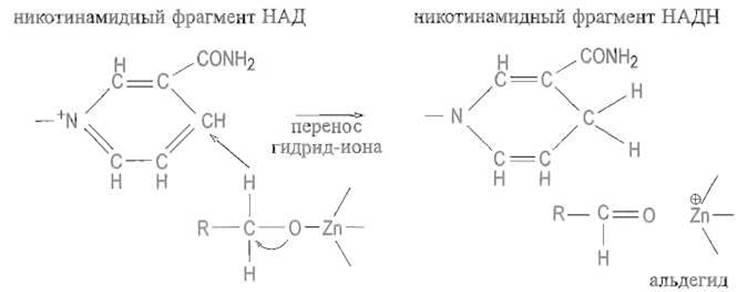
При обратной реакции перенос гидрид-иона происходит от NADH к углероду альдегидной группы, двойная связь которой оказывается поляризованной за счет влияния связанного с ферментом иона цинка на атом кислорода. Такая поляризация усиливает частичный положительный заряд на атоме углерода карбонильной группы, что благоприятствует присоединению к этому атому гидрид-иона.
Рассмотренный пример показывает возможность обогащения функциональных свойств ферментов путем включения лигандов — иона металла и кофактора — в структуру активного центра.