Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Имунноглобулины
Центр связывания антигенов
Как упоминалось, центр связывания антигенов формируют совместно вариабельные домены легкой и тяжелой цепей: VL и VH. По способу пространственной укладки пептидных цепей они похожи, образуя, как и другие домены иммуноглобулинов, два β-складчатых слоя, которые отстоят один от другого примерно на 10 Å и соединены внутридоменной дисульфидной связью. Пространство между слоями заполнено достаточно плотно упакованными гидрофобными боковыми цепями аминокислот. Все эти устойчивые черты третичной структуры VL- и VH-доменов предопределены сходством их первичной структуры. Однако петли, соединяющие отрезки β-структуры в каждом из этих доменов, резко отличаются по последовательности аминокислот, если сравнивать между собой однотипные антитела с разной специфичностью: они гипервариабельны (рис. 13.3, 13.4).
Три гипервариабельные петли каждого из доменов пространственно сближены и объединяются в единую весьма неровную поверхность — зону связывания антигена. Последняя образована шестью петлями: L1, L2, L3 (из VL-домена) и Н1, H2, Н3 (из VH-домена). Эти петли почти точно совпадают с гипервариабельными участками аминокислотной последовательности V-доменов, так называемыми районами, определяющими комплементарностъ (от англ. Complementarity Determining Regions — CDR).
Замены аминокислот в этих петлях (рис. 13.5) приводят к замещению одних боковых цепей другими и, следовательно, к изменению рельефа и всего характера антигенсвязывающей зоны, чем и определяется ее способность быть комплементарной молекулам самой различной природы. Поверхность антигенсвязывающего района изменяется еще и потому, что замены аминокислот в гипевариабельных участках влияют на конформацию образуемых ими петель. Может изменяться и длина петель, в особенности петли Н3.

Рис. 13.3. Пространственное строение вариабельного домена легкой цепи одного из иммуноглобулинов Складчатыми полосками изображены ß-структурные отрезки; L1, L2, L3 — гипервариабельные петли, соединяющие эти отрезки (соответствуют районам, определяющим комплементарность, — CDR)
Рентгеноструктурный анализ комплексов антиген — антитело (по техническим причинам обычно исследуют комплекс, образованный Fab-фрагментом, а не целой молекулой иммуноглобулина) позволил вскрыть основные факторы, которыми определяются прочность и высокая специфичность их образования.
Прежде всего это плотная подгонка поверхности активного центра антитела к структуре антигена. Макромолекулы, в особенности белки, вступают в реакцию с данным иммуноглобулином лишь частью своей поверхности — так называемым эпитопом. Для комплексов лизоцима с индивидуальными иммуноглобулинами (моноклональными антителами) показано, что их контактирующие поверхности подогнаны настолько точно, что на площади примерно в 700 Å2 оказываются вытесненными все молекулы воды, которые гидратировали оба белка. Это удаление связанной, а значит, упорядоченной воды повышает неупорядоченность системы в целом, что приводит к росту энтропии и благоприятствует образованию прочного комплекса. Вместе с тем сближение функциональных групп, принадлежащих антигену и антителу, позволяет установить целый ряд ван-дер-ваальсовых контактов, водородных и ионных связей. Так, при образовании комплекса лизоцима и Fab'-фрагмента иммуноглобулина возникает 126 межатомных контактов, в том числе 14 водородных связей и одна ионная связь между аминогруппой лизина и карбоксилат-ионом аспарагиновой кислоты.
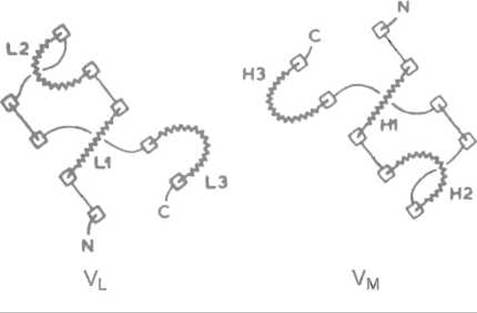
Рис. 13.4. Расположение гипервариабельных участков в антигенсвязывающей зоне иммуноглобулина. Квадратами обозначены ß-спиральные отрезки, рассматриваемые с торца, зигзагообразными линиями — гипервариабельные петли. Остальные обозначения общепринятые; ср. рис. 13.5
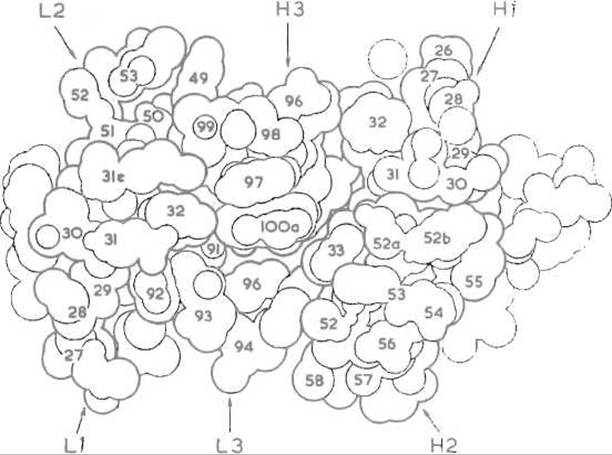
Рис. 13.5. Модель антигенсвязывающего участка пространственной структуры одного из иммуноглобулинов.
Контурные линии, подобно горизонталям топографической карты, проведены через 2 Å, гипервариабельные участки легких и тяжелых цепей обозначены соответственно L1, L2, L3, Н1, Н2 и Н3. Замены аминокислотных остатков, происходящие на этих участках, могут изменять как рельеф поверхности контакта с антигеном, так и ее характер, например распределение заряженных, полярных и неполярных групп
|
Аминокислотные остатки моноклонального антитела НуНеl-10 |
Взаимодействующие с ними остатки лизоцима |
|
Домен VL |
|
|
Gly-30 |
Gly-16 |
|
Asn-31 (Н-связь) |
His-15, Gly-16, Lys-96 |
|
Asn-32 (Н-связь) |
Gly-16, Tyr-20 |
|
Tyr-50 |
Asn-93, Lys-96 |
|
Gln-53 (Н-связь) |
Thr-89, Asn-93 |
|
Ser-91 (Главная цепь) |
Tyr-20 |
|
Asn-92 (Н-связь, главная цепь) |
Tyr-20, Arg-21 |
|
Туr-96 (Н-связь) |
Arg-21 |
|
Домен VH |
|
|
Thr-30 |
Arg-70 |
|
Ser-31 (Н-связь) |
Arg-73, Leu-75 |
|
Asp-32 (ионная связь) |
Lys-97 |
|
Туr-33 (Н-связь) |
Trp-63, Lys-97, Ile-98, Ser-100, Asp-101 |
|
Туr-50 (Н-связь) |
Arg-21, Ser-100 |
|
Ser-52 (Н-связь) |
Asp-101 |
|
Туr-53 (Н-связь) |
Trp-63, Leu-75, Asp-101 |
|
Ser-54 |
Asp-101 |
|
Ser-56 |
Asp-101, Gly-102 |
|
Tyr-58 (H-связь) |
Arg-21, Ser-100, Gly-102 |
|
Тrр-95 |
Arg-21, Lys-97, Ser-100 |
Полное вытеснение воды из зоны связывания антигена стабилизирует водородные и ионные связи. Результатом является весьма высокая прочность комплекса, характеризующаяся константой связывания порядка 107-1010 М-1.
Заметим, что рельеф поверхности контакта антигена и антитела может быть весьма различным. Поверхность бывает почти плоской, со впадинами или выпуклостями. Например, одно из антител к лизоциму частично заполняет своим выпуклым центром связывания впадину, в которой размещается субстрат этого фермента, и поэтому является его ингибитором. У лизоцима в этом комплексе площадь контакта с иммуноглобулином составляет около 15% всей доступной растворителю поверхности белка.
В качестве эпитопа нередко выступает несколько сближенных в пространственной структуре белка-антигена участков последовательности. Определена структура трех комплексов лизоцима с моноклональными антителами. Суммарная площадь эпитопов в них — около 40% поверхности белка, а поскольку известно, что существуют и другие эпитопы, по-видимому, практически все или почти все доступные участки молекулы белка могут обладать иммунологической активностью.
Еще один источник способности семейства иммуноглобулинов связывать антигены самой различной структуры состоит в том, что поверхность зоны связывания, образованная VL- и VH-доменами, составляет около 2000 Å2 и намного превышает обычную площадь эпитопа на поверхности белка-антигена (500—1000 Å2, у большинства небелковых антигенов она еще меньше). Вследствие этого для образования комплементарной эпитопу структуры может использоваться не вся поверхность зоны связывания доменов VL и VH, а какая-то ее часть, в наибольшей мере соответствующая строению антигена.