Молекулярная биология: Структура и функции белков - Степанов В.М. 2005
Фибриллярные белки
Эластин
Эластин — нерастворимый фибриллярный белок, играющий важную роль в формировании эластичных тканей, прежде всего стенок артерий, легких и связок. Полипептидная цепь его предшественника тропоэластина, синтезируемая, как и коллаген, фибробластами, состоит примерно из 760 аминокислотных остатков. Более половины из них приходится на глицин и аланин, четверть — на типично гидрофобные аминокислоты, среди которых особенно много валина, в то время как число гидрофильных аминокислот очень невелико. Содержание пролина в эластине (11%) значительно меньше, чем в коллагене. Часть остатков пролина. гидроксилирована, однако оксипролин, по-видимому, не играет существенной роли в эластине и, возможно, образуется попутно, как следствие высокой активности пролингидроксилазы в фибробластах, где синтезируется и коллаген.
Для первичной структуры эластина характерно обилие повторяющихся участков последовательности. Например последовательность Pro—Gly—Val—Gly—Val встречается в эластине по меньшей мере 11 раз подряд. Эластин построен из большого числа чередующихся гидрофобных и гидрофильных участков полипептидной цепи, которые соответствуют множеству относительно коротких экзонов в структурном гене этого белка. Гидрофильные участки обогащены лизином.
По-видимому, гидрофобные участки ответственны за агрегацию, чрезвычайно характерную для эластина. Гидрофильные же определяют образование межмолекулярных сшивок, которые делают агрегацию необратимой. Примерно в середине каждого из гидрофильных участков содержатся остатки лизина, разделенные двумя-тремя остатками других аминокислот, часто аланина, например Lys—Ala—Ala—Lys, Lys—Ser—Ala—Ala—Lys—Val—Ala—Ala—Lys, Lys—Ala—Pro—Lys.
При созревании тропоэластина почти все остатки лизина превращаются в аль-лизин под действием того же медьсодержащего фермента лизиноксидазы, который модифицирует коллаген. Образовавшиеся при этом альдегидные группы вступают в реакции конденсации с другими остатками аль-лизина, а также с є-амино- группой еще не окисленного остатка лизина, в результате чего четыре сближенных в агрегате остатка лизина дают десмозин — аминокислоту с пиридиниевым ядром, объединяющую в один узел четыре участка пептидной цепи эластина:
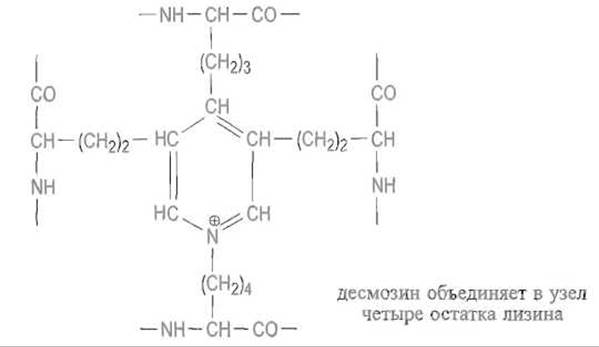
Сшивки такого типа делают эластин нерастворимым в воде, в то время как участки между ними, имеющие конформацию неупорядоченного клубка, сохраняют способность к обратимому растяжению, чем и обусловлена растяжимость связок и стенок артерий. Инактивация лизиноксидазы, которая может быть вызвана дефицитом ионов меди или блокированием пиридоксаля в активном центре фермента (вследствие реакции с аминогруппой ß-аминопропионитрила — латирина), тормозит созревание эластина и приводит к утрате эластичности связок и артерий, а иногда к разрыву аорты.