ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 18. Иммунитет к паразитарным инвазиям
МЕХАНИЗМЫ ЗАЩИТЫ ОТ ИММУННОГО ОТВЕТА
Для успешного внедрения и развития в организме-хозяине паразитам необходимо избежать действия его защитных механизмов, поэтому паразитические простейшие и гельминты обладают способностью обходить их разнообразными способами. Некоторые из паразитов даже используют клетки и молекулы иммунной системы хозяина в своих интересах: лейшмании проникают в макрофаги с помощью рецепторов комплемента, не вызывая по этой причине вспышки дыхания и соответственно не подвергаясь разрушению под действием токсических продуктов макрофагов.
Цитокины хозяина, выполняя защитную роль при иммунном ответе на многие паразитарные инвазии, одновременно способствуют развитию паразитов. Так, ФНОα стимулирует откладывание яиц половозрелыми особями S. mansoni, а ИФγ служит фактором роста для Т. brucei.
Паразиты могут быть устойчивы к разрушению комплементом
В случае лейшманий подобного рола устойчивость коррелирует с вирулентностью. При заражении L. tropica, клетки которой легко уничтожаются комплементом, возникает локализованная самоизлечивающаяся инфекция кожи, тогда как L. donovani - организм, в 10 раз более устойчивый к действию комплемента — распространяется во внутренних органах, вызывая заболевание, часто с летальным исходом.
Механизмы зашиты паразитов от действия комплемента различны. В случае L. major липофосфогликановая поверхностная оболочка простейшего активирует комплемент, однако лизирующий мембрану комплекс сбрасывается с их клеток и тем самым они избегают лизиса. Трипомастиготы Т. cruzi несут поверхностный гликопротеин, который обладает активностью фактора ускорения диссоциации С3-конвертазы (ФУД), ограничивающего реакционнеспособность комплемента (см. гл. 4). Шистосомулы приобретают устойчивость по мере созревания, что также коррелирует с образованием поверхностных молекул, сходных с ФУД.
Внутриклеточные паразиты избегают разрушения различными путями
Простейшие, паразитирующие внутри макрофагов, различными способами избегают уничтожения под действием метаболитов кислорода и лизосомных ферментов (рис. 18.20 и 18.21). Клетки Т. gondii проникают в макрофаги не путем фагоцитоза (рис. 18.21) и поэтому не вызывают вспышки дыхания; клетки Leishmania spp. могут проникать внутрь макрофагов, связываясь с рецепторами комплемента, — другой путь обхода вспышки дыхания. Кроме того, лейшмании обладают ферментом супероксиддисмутазой и другими ферментами, защищающими их от действия высокоактивных метаболитов кислорода. Вакуоли, в которых выживают лейшмании, представляют собой лизосомы (рис. 18.22), однако эти простейшие обладают механизмами, обеспечивающими защиту отлизосомных ферментов. Липофосфогликановая поверхностная оболочка лейшмании функционирует как «ловушка» для метаболитов кислорода и защищает от ферментативного лизиса; кроме того, содержащийся в ней гликопротеин Gp63 (рис. 18.23) ингибирует действие лизосомных ферментов макрофагов. Лейшмании способны также снижать экспрессию антигенов МНС класса II на поверхности макрофагов, в которых они паразитируют, уменьшая, таким образом, способность макрофагов стимулировать Тх-клетки. Указанные механизмы, однако, менее эффективны при заражении иммунного хозяина.
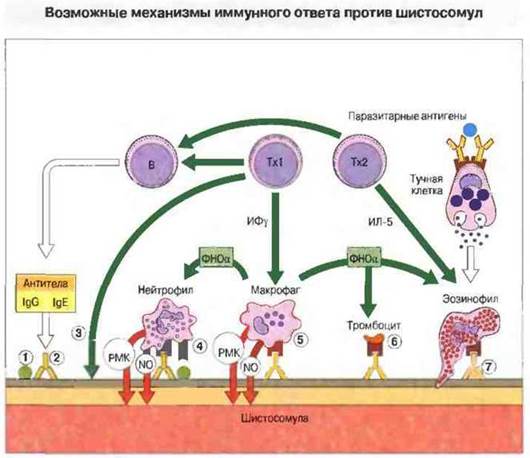
Рис. 18.19. В условиях in vitro выявлены различные механизмы повреждения шистосом. Комплемент не только непосредственно повреждает гельминтов (1), но и действует в комплексе с антителами (2). Тх1-клетки могут подавлять развитие шистосомул в легких (3). Антитела сенсибилизируют нейтрофилы (4), макрофаги (5), тромбоциты (6) и эозинофилы (7), вызывая реакции антителозависимой клеточной цитотоксичности. Нейтрофилы и макрофаги действуют, вероятно, путем образования токсичных метаболитов кислорода и азота, тогда как эозинофилы повреждают тегумент червя путем выделения главного основного белка. Ответ усиливают цитокины (например, ФНОα). Антитела IgE выполняют важную роль в сенсибилизации эозинофилов и местных тучных клеток, которые высвобождают различные медиаторы, в том числе и вызывающие активацию эозинофилов.
(РМК - реакционноспособные метаболиты кислорода.)
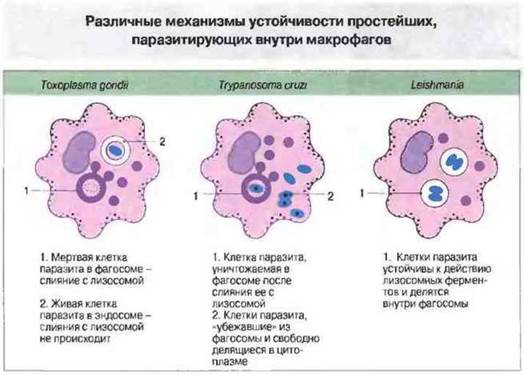
Рис. 18.20.
Toxoplasma gondii. Живые амебы активно проникают в клетку, где локализуются в мембраносвязанной вакуоли. При этом они недоступны для ферментов, поскольку лизосомы не сливаются с такой вакуолью. Однако погибших амеб фагоциты поглощают путем нормального фагоцитоза с образованием фагосом (если амебы покрыты антителами, которые связываются с Fc-рецепторами на поверхности макрофагов), где они разрушаются ферментами после слияния фагосом с лизосомами.
Trypanosoma cruzi. Выживаемость этого паразита зависит от стадии развития: трипомастиготы «убегают» из фагосом и делятся в цитоплазме, тогда как эпимастиготы остаются в фагосомах и уничтожаются. Доля амеб, присутствующих в цитоплазме, меньше, если макрофаги активированы.
Leishmania spp. Лейшмании размножаются внутри фагосом: они устойчивы к действию лизирующих ферментов, так как обладают поверхностной протеазой. Если макрофаги были предварительно активированы цитокинами, количество проникающих в клетки и размножающихся в них паразитов будет меньше.
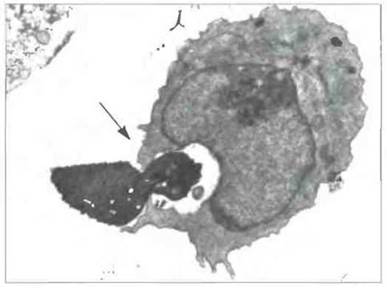
Рис. 18.21. Электронная микрофотография, показывающая активное проникновение Toxoplasma gondii в клетку хозяина. Внедрение происходит путем образования прочного контакта с мембраной клетки хозяина (показан стрелкой) и сопровождается модификацией образованной фагосомы для предотвращения ее слияния с лизосомой. (Фото любезно предоставлено д-ром J. Smith.)
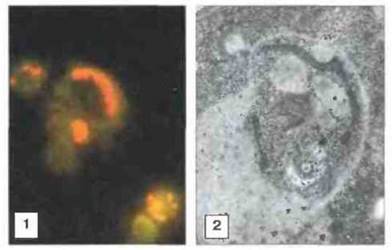
Рис. 18.22. Вакуоль, содержащая клетки лейшманий - это лизосома. 1. Иммунофлуоресцентное окрашивание макрофагов мыши, инфицированных Leishmania mexiсаnа, с помощью конъюгированных с родамином антител к тубулину - окрашивают лейшмании в жёлто-красный цвет - и коньюгированных с флуоресцеином моноклональных антител, реагирующих с поздним маркером эндосом/лизосом LAMP-1, - зеленый цвет 2. Электронная микрофотография инфицированного L. mexicana макрофага мыши, обработанного меченными золотом антителами к катепсину D для выявления лизосомной протеиназы в вакуоли, содержащей лейшмании. (Фото любезно предоставлены д-ром D. Russel.)
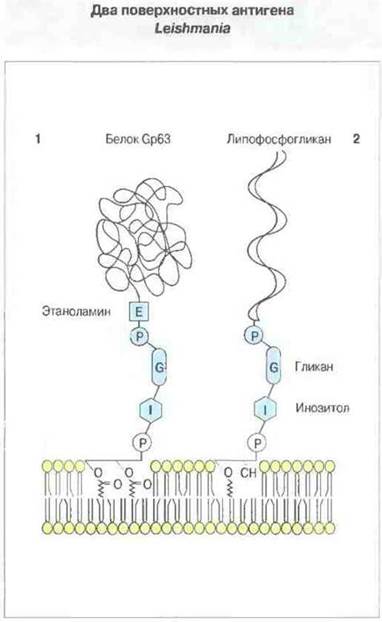
Рис. 18.23. Схематическое изображение двух поверхностных антигенов Leishmania, заякоренных в мембране фосфатидилинозитольными «хвостами» (GPI-якорь).
1. Белковый антиген Gp63 обладает протеазной активностью У L. mexicana он совместно с липофосфогликаном связывает комплемент. Это позволяет промастиготе проникать в макрофаг при помощи рецептора к компоненту С3 комплемента.
2. Гликолипидный антиген липофосфогликан обеспечивает устойчивость к комплемент-опосредованному лизису. У L. major он связывает С3b, фрагмент третьего компонента комплемента, позволяя промастиготе проникать внутрь макрофага при помощи рецептора CR1 комплемента. У мыши антитела к обоим антигенам обеспечивают защиту против кожного лейшманиоза.
Как теперь известно, многие белки оболочки паразитов, например вариабельный поверхностный гликопротеин Т. brucei, связаны с поверхностной мембраной с помощью GPI-якоря.
Внеклеточные паразиты способны к маскировке
Паразиты, чувствительные к специфическим антителам, обладают рядом механизмов устойчивости к гуморальному иммунному ответу. У африканских трипаносом обнаружена способность к антигенной изменчивости: вариабельный поверхностный гликопротеин, образующий поверхностную оболочку паразитов, может экспрессироваться в новых, структурно измененных формах и это защищает лежащую ниже мембрану от лизиса под действием защитных систем организма-хозяина. Новые популяции трипаносом, возникающие в ходе инфекции, отличаются по антигенному составу от предыдущих (рис. 18.24 и 18.25). Некоторые антигены малярийных паразитов также обнаруживают антигенную изменчивость.
Другие паразитические организмы, например шистосомы, «одеваются» в оболочку из антигенов хозяина, чтобы его защитные системы не распознали их как чужеродные объекты и не отличили от своих тканей. При культивировании в питательной среде, содержащей сыворотку человека и эритроциты, шистосомулы способны приобретать поверхностные структуры, содержащие детерминанты групп крови А, В и Н, а также антигены МНС. Однако в среде, лишенной молекул хозяина, шистосомулы, как отмечено выше, также приобретают устойчивость к действию антител и комплемента.
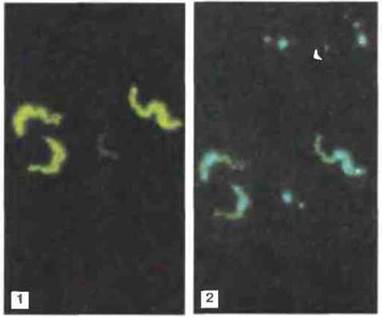
Рис. 18.24. Антигенная изменчивость у трипаносом. Иммунофлуоресцентное окрашивание трипаносом с помощью моноклональных антител, специфичных к определенному антигенному варианту (1). Микрофотография (2) представляет собой то же поле зрения, но с окраской ядер и кинетопластов паразита красителем, связывающим ДНК. Только некоторые из паразитов экспрессируют данный вариант, в то время как другие экспрессируют отличные от этого варианты антигена. (Фото любезно предоставлены д-ром М. Turner.)
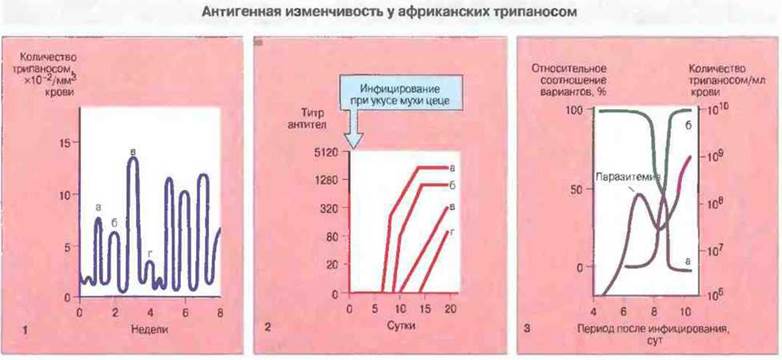
Рис. 18.25. Трипаносомная инфекция может длиться месяцами и сопровождаться периодическими вспышками паразитемии.
На графике 1 показаны колебания паразитемии при сонной болезни. Хотя инфекция была вызвана одним возбудителем, последовательные вспышки болезни вызывают его иммунологически различные популяции (а, б, в, г), при этом антитела против предшествующих антигенных вариантов не обеспечивают дальнейшую защиту Существует устойчивая тенденция к появлению новых антигенных вариантов в одной и той же последовательности в различных организмах-хозяевах. Подобная изменчивость не обнаруживается у животных с нарушенным иммунитетом (например, обработанных определенным образом для ослабления той или иной иммунной функции).
График 2 показывает динамику образования антител к четырем вариантам трипаносомных антигенов у кролика после укуса мухи цеце - переносчика Trypanosoma brucei. Антитела к данному антигенному варианту обнаруживаются сразу же после его появления, и их титр повышается, выходя на плато. Образование антител вызывает изменение паразитарного антигена и появление иммунологически новой популяции паразита.
График 3 иллюстрирует кинетику одного цикла антигенной изменчивости. Крыса была инфицирована гомогенной популяцией одного антигенного варианта Т. brucei (а). Вторая волна паразитемии наступает, когда появляется новый доминирующий антигенный вариант (б).
Некоторые внеклеточные паразиты «прячутся» от иммунной атаки
Отдельные виды простейших (например, Entamoeba histolytica) и гельминтов (например, Т. spiralis) образуют защитные цисты; половозрелые особи О. volvulus, локализованные в коже, индуцируют организм-хозяин к «окружению» их коллагеновыми узелками. Нематоды и ленточные черви защищены от многих ответных реакций хозяина просто благодаря тому, что находятся в кишечнике.
Некоторые внеклеточные паразиты способны выдерживать иммунную атаку
Известны многочисленные примеры простых физических способов зашиты у паразитов: нематоды имеют толстую внеклеточную кутикулу, которая защищает их от токсичных метаболитов организма-хозяина (рис. 18.26); тегумент шистосомул утолщается по мере их превращения в половозрелых особей, также обеспечивая защиту; «свободная» поверхностная оболочка многих нематод может «сползать» под действием иммунного ответа; ленточные черви предотвращают иммунные реакции, секретируя ингибитор эластазы, который препятствует привлечению к ним нейтрофилов.
Многие гельминты обладают способностью предохранять себя от высокоактивных метаболитов О2, образуемых при вспышке дыхания в клетках иммунной системы. Например, филярии, поражающие лимфатическую систему, способны секретировать поверхностносвязанную глутатион пероксидазу; шистосомы имеют поверхностносвязанные глутатион-S-трансферазы, нематоды Onchocerca способны секретировать супероксиддисмутазу. У некоторых нематод и трематод выработан механизм повреждения антител путем секреции протеаз, расщепляющих иммуноглобулины с удалением Fc-фрагмента.
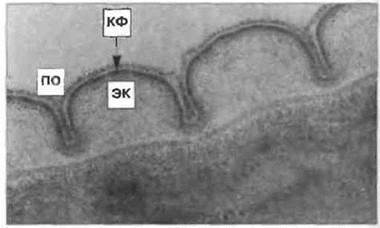
Рис. 18.26. Электронная микрофотография инфекционной личинки Тохосага canis. Видна поверхностная оболочка (ПО), связанная с катионизированным ферритином (КФ), покрывающим эпикутикулу (ЭК). Фиксация глутаральдегидом и четырехоксидом осмия. (Фото любезно предоставлено проф. R. Maizels; с разрешения из Exp. Parasitol. 1992; 75: 72-86.)
Большинство паразитов противодействует иммунному ответу
Для всех паразитарных инвазий характерна иммуносупрессия (рис. 18.27), и она касается как гуморального, так и клеточного ответа. Некоторые паразиты непосредственно вызывают разрушение лимфоидных клеток и тканей (например, ювенильные личинки Т. spiralis выделяют лимфоцитотоксический фактор), однако в основном подавление иммунного ответа происходит путем инактивации макрофагов. Эти клетки могут быть «перегружены» свободными антигенами, поскольку многие гельминты секретируют значительное количество полисахаридов и гликоконъюгатов, которые препятствуют процессингу антигенов. У макрофагов мышей, зараженных шистосомами, нарушена способность презентировать антигены. Сходным образом, у мышей, зараженных африканскими трипаносомами, снижены презентация антигена и секреция ИЛ-1. При малярии в макрофагах накапливается пигмент гемозоин - продукт расщепления гемоглобина, подавляющий различные функции этих клеток. Многие продукты метаболизма паразитов стимулируют выделение макрофагами простагландинов и других супрессивных молекул, которые подавляют воспалительные реакции. Интересно, что цестолы и нематоды сами способны секретировать простагланлины, которые также супрессируют воспалительные реакции.
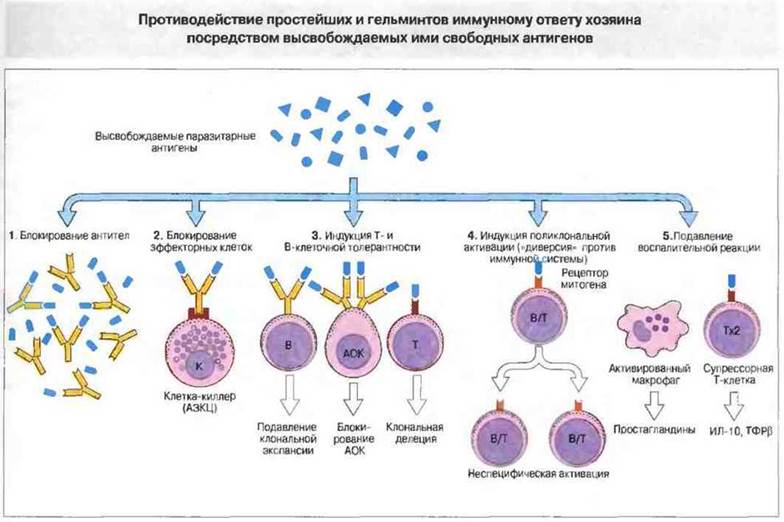
Рис. 18.27. Свободные антигены способны:
1) взаимодействовать с антителами и предотвращать их действие на паразитов, т. е. выполнять роль дымовой завесы или приманки. По-видимому, это характерно для вариабельного поверхностного гликопротеина Trypanosoma brucei и растворимых антигенов Plasmodium falciparum, полиморфных и содержащих повторяющиеся последовательности аминокислотных остатков;
2) блокировать эффекторные клетки как непосредственным образом, так и посредством иммунных комплексов Циркулирующие комплексы, например, способны подавлять цитотоксическую активность К-клеток против Schistosoma mansoni;
3) индуцировать толерантность Т- или В-клеток, вероятно блокируя антителообразующие клетки (АОК) или истощая популяцию зрелых антигенспецифичных лимфоцитов путем подавления клональной экспансии;
4) вызывать поликлональную активацию. Многие паразитарные продукты оказывают митогенный эффект в отношении В- и Т-клеток, и при инвазиях в сыворотке часто присутствуют в высоких концентрациях неспецифические IgM (и IgG) - возможный результат такой поликлональной стимуляции. Продолжение ее приводит, предположительно, к ослаблению функций В-клеток, прогрессивному истощению популяции антигенреактивных В-лимфоцитов и, таким образом, к иммуносупрессии;
5) активировать Т-клетки, в первую очередь Тх2-клетки, или макрофаги, либо и те и другие, вызывая выделение ими иммуносупрессивных факторов.
Растворимые антигены паразитов, выделяемые ими в огромных количествах, могут подавлять иммунный ответ хозяина путем так называемого иммунного отвлечения. Например, растворимые антигены (S-, или термостабильные) Р. falciparum, по-видимому, нейтрализуют циркулирующие антитела, создавая своего рода «дымовую завесу», защищающую от них паразитов. Многие слушивающиеся поверхностные антигены паразитов представляют собой растворимую форму молекул, встроенных в их клеточную мембрану с помощью GPI-якоря; в том числе это вариабельный поверхностный гликопротеин Т. brucei, липофосфогликан, или «секретируемый фактор», Leishmania (рис. 18.23) и некоторые поверхностные антигены шистосомул. Такие антигены высвобождаются под действием эндогенных фосфатидилинозитол-специфичных фосфолипаз.
Антигенспецифическая супрессия проявляется также в подавлении реакции замедленной гиперчувствительности. Эта супрессия может быть избирательной и затрагивать только популяцию Т-клеток CD4+, но изменять при этом соотношение Тх1/Тх2 в благоприятную для паразита сторону. Т-клетки больных лейшманиозом (заражение L. donovani) при культивировании со специфическим антигеном не секретируют ИЛ-2 или ИФγ. Продукция ИЛ-1 и экспрессия антигенов МНС класса II у них снижены, а секреция простагландинов повышенная. Состояние таких больных улучшается при лечении ИФγ в сочетании с пятивалентной сурьмой. Сходным образом, при филяриозе Тх1-клетки не пролиферируют в ответ на специфические антигены, хотя гуморальный эффект в этом случае не подавляется. Действительно, у больных тяжелой формой филяриоза или шистосомоза присутствуют в значительном количестве антитела IgG4, которые блокируют защитный IgE-ответ. При шистосомозе антитела IgM и IgG2 против некоторых углеводных антигенов шистосом ингибируют цитотоксические функции гранулоцитов и уровень этих антител коррелирует с чувствительностью к повторному заражению.
При некоторых протозойных инфекциях, в том числе малярии, африканской сонной болезни и болезни Чагаса, отмечена недостаточность секреции ИЛ-2 - другого продуцируемого пролиферирующими Тх1-лимфоцитами цитокина. У мышей, инфицированных Т. cruzi, некое выделяемое паразитом вещество, по-видимому, подавляет экспрессию рецепторов ИЛ-2. Введение им ИЛ-2 индуцирует образование рецепторов, восстанавливает активность Т-хелперных клеток, приводит к увеличению синтеза специфичных в отношении паразита антител IgM и IgG, а также к уменьшению численности паразитов в крови и повышает выживаемость животных.
Некоторые из рассмотренных выше механизмов устойчивости паразитов к защитным реакциям организма-хозяина приведены на рис. 18.28.
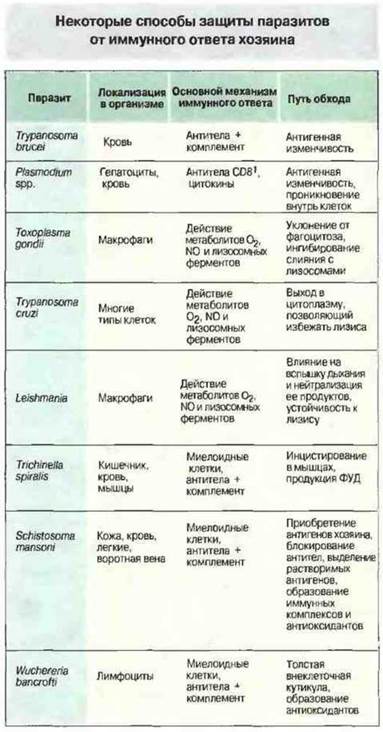
Рис. 18.28. Паразиты обладают различными свойствами, позволяющими им ускользнуть от защитных реакций хозяина. (ФУД - фактор, ускоряющий диссоциацию С3-конвертазы (см. гл. 4).)