ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 23. Гиперчувствительность - тип I
ИММУНОГЛОБУЛИНЫ Е
Первоначальный контакт аллергена со слизистой оболочкой вызывает сложную последовательность событий, приводящих к продукции IgE. Этот IgE-ответ возникает локально, в участке проникновения аллергена в организм, т. е. на слизистых оболочках и/иди в регионарных лимфоузлах. Продукция В-клетками IgE зависит от презентации аллергена АПК и кооперации между В и Тх2-клетками (см. рис. 23.3). Местно продуцируемые IgE вначале сенсибилизируют только местные тучные клетки, но затем проникают в кровь и связываются со специфическими рецепторами циркулирующих базофилов и тканевых тучных клеток во всем организме.
Важное свойство IgE — высокая аффинность к Fc-участкам рецепторонтучных клеток и базофилов. И хотя период полужизни свободных IgE в сыворотке составляет всего несколько суток, тучные клетки могут оставаться сенсибилизированными IgE в течение многих месяцев благодаря высокой аффинности связывания этих иммуноглобулинов с рецепторами FcεRI, которые защищают IgE от разрушения сывороточными протеазами. (FcεRII обладает гораздо меньшим сродством к IgE). Это было показано изящными экспериментами Стенворта (Stanworth), который вводил сыворотку страдающего атопией человека в двенадцать разных участков кожи собственной руки, а затем каждую неделю па протяжении трех месяцев повторно вводил специфический аллерген всякий раз в новые сенсибилизированные участки кожи. При введении аллергена в последний участок на нем все еще развивалась гиперемическая реакция с волдырями. Иными словами, даже через три месяца после сенсибилизации с местными тучными клетками кожи оставалось связанным достаточное для возникновения реакции количество IgE.
Аллергические заболевания сопровождаются повышением уровня IgE
При аллергических заболеваниях содержание IgE в сыворотке крови часто повышено; особенно значительное его возрастание отмечается при паразитарных инвазиях. В случае симптомов атопии у детей и взрослых повышенный уровень IgE имеет диагностическое значение, хотя нормальное его содержание не исключает атопии (рис. 23.4). Следует отмстить, что сам по себе уровень IgE не служит показателем аллергического состояния, поскольку важную роль в возникновении клинических симптомов играют также генетические и средовые факторы. Тем не менее очень высокий уровень IgE в отсутствие признаков гельминтоза с высокой вероятностью указывает на аллергию.
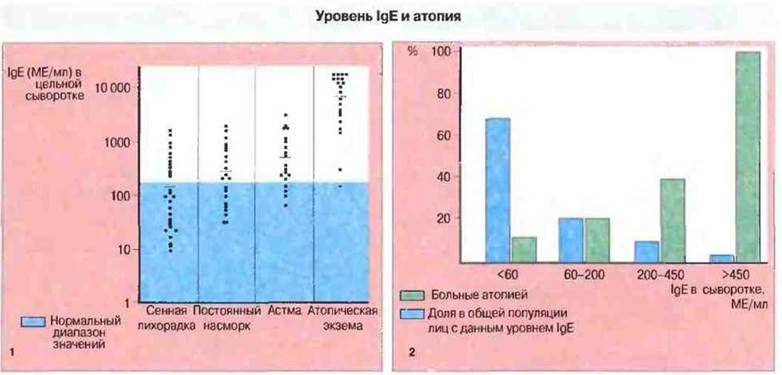
Рис. 23.4.
1. В норме концентрация IgE в сыворотке (примерно 100 МЕ/мл) в 105 раз ниже уровня IgG (около 10 мг/мл) и составляет менее 0,001% общего уровня иммуноглобулинов. У лиц с атопией содержание IgEобычно возрастает, что особенно очевидно при атопической экземе. (1 ME = 2 нг). 2. Относительное количество лиц с повышенным уровнем IgE в популяции тем меньше, чем выше рассматриваемое значение концентрации этого иммуноглобулина, но вероятность атопии среди них в этом ряду возрастает. Среди тех, у кого содержание IgE превышает 450 МЕ/мл, атопия имеет место уже в большинстве случаев.
При обследовании крупных групп населения число лиц с положительными кожными пробами намного превышает количество тех. у кого действительно имеются симптомы атонии. Недавно установлено, что положительные кожные реакции на один или несколько обычных аллергенов имеются почти у 30% лиц из случайной выборки в 5000 человек. Таким образом, у этих людей специфический IgE вырабатывается, но отсутствует некий фактор (фактор X, см. рис. 23.27), обусловливающий клинические симптомы атопии.
Продукцию IgE регулируют хелперные Т-клетки
Указания на регуляторную роль «супрессорных» Т-клеток в ранних исследованиях. Исследования в лаборатории Тада (Tada), проведенные на крысах в начале 1970-х гг., четко продемонстрировали регуляторную роль Т-клеток в продукции IgE. У животных, иммунизированных антигенным препаратом ДНФ—Ascaris (с Bordetella pertussis в качестве адъюванта), тигры IgE возрастали, достигая пика через 5—10 сут, а в течение последующих 6 нед постепенно нормализовывались. Если же крыс вначале тимэктомировали или облучали. IgE-ответ был более выраженным и продолжительным. Когда на стадии усиленной продукции IgE тимэктомированным животным вводили гимоциты или клетки селезенки крыс, примированных антигенным препаратом Ascaris, продукция IgE уменьшалась (рис. 23.5). Супрессию IgE-ответа эти исследователи рассматривали как следствие активности супрессорных Т-клеток, присутствующих во вводимых клеточных препаратах; тимэктомия или облучение, очевидно, снижали эту активность. Перенос клеток не отражался на уровнях IgG и IgM у реципиентов, что свидетельствовало об особенно высокой чувствительности именно IgE-ответа к действию гипотетических супрессорных Т-клеток.
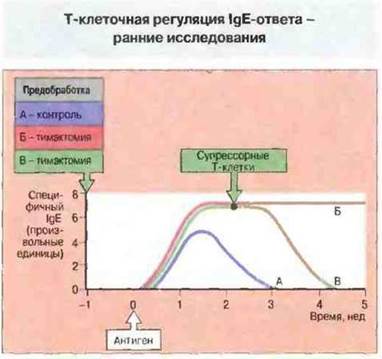
Рис. 23.5. IgE-ответ регулируется как Т-хелперами (Тх), так и Т-супрессорами (Тс). Этот эксперимент проводили на трех группах крыс: контрольной (А), не подвергавшейся какому-либо воздействию в течение недели перед введением антигена, и двух опытных (Б и В), в которых крысам перед иммунизацией удаляли тимус. После введения антигена у животных периодически определяли уровни IgE. В контроле иммунизация антигеном приводила к временному повышению содержания антигенспецифичного IgE. Тимэктомия (или облучение) обусловливала более длительный ответ (Б), который можно было сократить введением стимулированных антигеном клеток селезенки, содержащей Тс (В). У крыс, тимэктомированных в неонатальном возрасте. IgE-ответ вообще отсутствовал, что указывает на необходимость Тх-клеток для его развития.
Как показали другие эксперименты, тимэктомия в неонатальном возрасте полностью лишает крыс способности продуцировать IgE в ответ на введение антигенного препарата ЗХНФ- Ascaris, что свидетельствует о необходимости Тх-клеток для индукции этой реакции. При некоторых клинических состояниях обнаруживается обратная корреляция между количеством супрессорных Т-клеток и уровнем IgE, указывающая на значение Т-клеточной регуляции для синтеза IgE и у человека.
Супрессивный эффект осуществляют Тх1-клетки. В настоящее время известно, что за описанную Тада регуляцию синтеза IgE ответственны субпопуляции Тх-клеток, выделяющих специфические цитокины. Клеточные и молекулярные механизмы такой регуляции показаны на рис. 23.6. Следует обратить внимание на то, что цитокины, продуцируемые Тх2-клетками (ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-9 и ИЛ-13), кодирует кластер генов, расположенный у человека в хромосоме 5, а у крысы — в хромосоме 13.
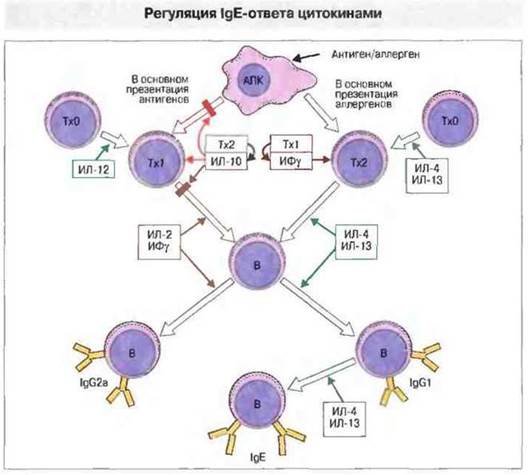
Рис. 23.6. Образование той или иной субпопуляции Т-клеток из Тх0-клеток и соответственно судьба В-клеток определяются присутствием тех или иных цитокинов. Так, преобладание в среде цитокинов ИЛ-4 и ИЛ-13 способствует образованию Тх2-клеток и переключению В-клеток на продукцию IgЕ. Цитокин ИЛ-10, продуцируемый Тх2-клетками, ингибирует Тх1-ответ, влияя на АПК, и усиливает зависимость ответа от Тх2. Таким образом, именно Тх2-ответ способствует продукции IgE в ответ на аллергены. Напротив, Тх1-ответу на типичные антигены, например на столбнячный анатоксин, способствует продукция ИФу, ИЛ-2 и ИЛ-12, которые одновременно подавляют образование Тх2-клеток. Тх1-ответ стимулирует продукцию IgG и формирование Т-клеточного иммунитета.
Важная роль этих цитокинов in vivo была установлена на мышах, у которых нейтрализующие антитела к ИЛ-4 или введение ИФγ ингибировали IgE-ответ. Точно так же трансгенные мыши, гомозиготные по мутации, инактивирующей ген ИЛ-4, неспособны продуцировать IgE при заражении нематодами. У больных с гипер-IgE-синдромом введение ИФα (он вызывает меньше побочных эффектов, чем ИФγ) также приводит к снижению уровня IgE в сыворотке. Молекулярные механизмы, посредством которых ИЛ-4/ИЛ-13 переключают В-клетки на синтез IgE, остаются неизвестными.
Следует отметить, что Тх2-клетки продуцируют также ИЛ-5, который стимулирует синтез и секрецию В-клетками IgA, а также играет важную роль в созревании и выживании эозинофилов в очагах воспаления. Этим может объясняться эозинофилия, столь часто сопровождающая опосредованные IgE аллергические реакции (см. также рис. 23.20—23.22). Очевидно, полезной стратегией терапии IgE-опосредуемых заболеваний могло бы стать воздействие, направленное на изменение состава продуцируемых цитокинов или их эффектов.