ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 23. Гиперчувствительность - тип I
ТУЧНЫЕ КЛЕТКИ
Давно известно, что существуют различия между видами по морфологии тучных клеток — окрашиваемости, характеру наружной поверхности и механизму дегрануляции. Последнее можно четко продемонстрировать; у человека перед экзоцитозом гранул их мембраны сливаются друг с другом (совместный экзоцитоз), тогда как у крысы гранулы высвобождаются порознь (рис. 23.10).
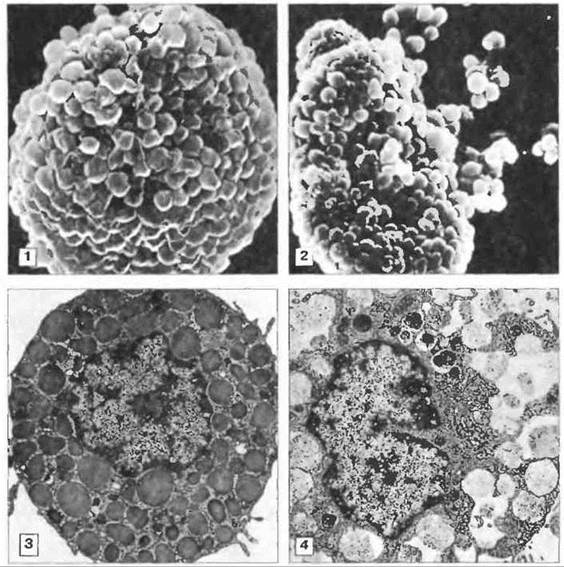
Рис. 23.10. Электронно-микроскопические фотографии тучных клеток крысы. 1. Интактная тучная клетка брюшины крысы с покрытыми клеточной мембраной гранулами. Сканирующая электронная микроскопия, х1500 2. Дегрануляция тучной клетки брюшины крысы после 30-секундной инкубации с антителами анти-IgE. Сканирующая электронная микроскопия, х1500. (Фото любезно предоставлены д-ром Т. Оrr.) 3. Тучная клетка брюшины крысы с электроноплотными гранулами. 4. После инкубации с антителами анти-IgE происходит вакуолизация клетки, сопровождающаяся экзоцитозом содержимого гранул. Просвечивающая электронная микроскопия, х 2700. (Фото любезно предоставлены д-ром D. Lawson.)
По тканевой локализации тучных клеток, их окрашиваемости и набору протеаз различают два типа этих клеток — соединительнотканные тучные клетки (СТТК) и тучные клетки слизистых оболочек (ТКСО) (рис. 23.11 и 23.12).
Между двумя популяциями тучных клеток имеются и функциональные различия — они по- разному реагируют на вещества, стимулирующие дегрануляцию (ионофоры Са2+, препарат 48/80 и т. д.) или ингибирующие выброс гистамина (кромогликат натрия).
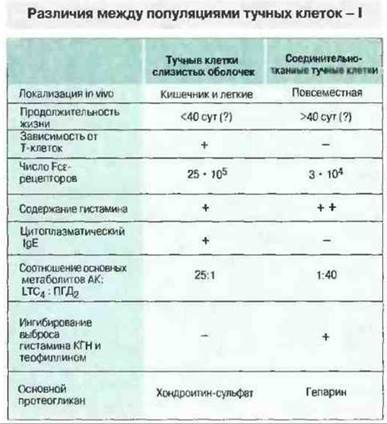
Рис. 23.11. Существуют по меньшей мере две субпопуляции тучных клеток - тучные клетки слизистых оболочек (ТКСО) и соединительнотканные тучные клетки (СТТК). Различия этих клеток по морфологии и реакции на фармакологические препараты свидетельствуют об их разной функциональной роли in vivo. ТКСО принимают участие в реакциях на глистную инвазию и, возможно, в аллергических реакциях. ТКСО имеют меньшие размеры и меньшую продолжительность жизни, чем СТТК; их функция зависит от Т-клеток, на их поверхности присутствует больше Fcε-рецепторов, а в цитоплазме содержится IgE. Г ранулы клеток обоих типов содержат гистамин и серотонин; большее количество гранул в СТТК может объясняться большим содержанием в них гистамина. Тучные клетки обоих типов продуцируют основные метаболиты арахидоновой кислоты (АК) - простагландины и лейкотриены, но в разных количествах. Например, ТКСО продуцируют лейкотриен LTC4 и простагландин ПГD2 в соотношении 25:1, а СТТК - 1.40 Различные вещества по-разному влияют на дегрануляцию клеток двух типов. Кромогликат натрия (КГН) и теофиллин ингибируют выброс гистамина из СТТК, но не из ТКСО. (Это может иметь важное значение при лечении астмы.) Следует учесть, что многие из приведенных данных получены в исследованиях на грызунах и могут быть неприменимы к человеку.
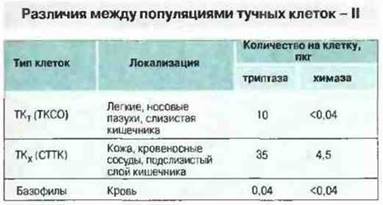
Рис. 23.12. Триптаза представляет собой тетрамер мол. массой 134 кДа. на долю которого приходится до 25 % белка тучной клетки. Химаза - это мономер с мол. массой 30 кДа. По соотношению этих протеаз тучные клетки разделяют на субпопуляции ТКт и ТКХ, по-разному представленные в разных тканях у человека. Базофилы содержат крайне малое количество обеих этих протеаз. (Подстрочные буквы - «т» и «х» - означают присутствие триптазы и химазы в клетках.)
Классификация тучных клеток по их локализации и морфологии
В большинстве тканей СТТК локализованы вокруг сосудов. Хотя СТТК разных тканей обладают сходными свойствами, клетки из брюшины и кожи, например, могут значительно различаться количеством и размером гранул, плотностью окрашивания и реакциями на фармакологические препараты (см. рис. 23.11 и 23.12). ТКСО распределяются иным образом: у человека наибольшая концентрация их отмечается в слизистой оболочке средней части кишечника и в легких.
При паразитарной инвазии, например Nippnstrougylus brasiliemis у крыс, количество ТКСО в слизистой кишечника резко возрастает. Увеличение их количества наблюдается также при болезни Крона и язвенном колите. Однако роль тучных клеток при этих заболеваниях неясна.
Предполагается, что предшественники кишечных ТКСО образуются в регионарных лимфоузлах и попадают в кишечник через грудной проток. Пролиферация ТКСО при паразитарной инвазии явно зависит от Т-клеточных цитокинов, в том числе ИЛ-3 и ИЛ-4. Клоны же СТТК образуются в культуре из фибробластов независимо от Т-клеток или Т-клеточных факторов.
Недавно подученные данные свидетельствуют о том, что ТКСО и СТТК образуются из одних и тех же клеток-предшественников, а окончательный их фенотип зависит от факторов микроокружения.
СТТК и ТКСО содержат в гранулах характерные протеазы. В недавно проведенных исследованиях гены некоторых протеаз из гранул тучных клеток были клонированы и секвенированы. По различному содержанию двух из этих ферментов — триптазы и химазы — СТТК и ТКСО можно разделить на субпопуляции (см. рис. 23.12).
Эти протеазы представляют интерес для медицины, так как триптаза может вызывать гиперреактивность бронхов, а химаза стимулирует секрецию бронхиальной слизи; и то, и другое - характерные признаки астмы (см. рис. 23.20). Обе протеазы способны также расщеплять вазоактивный интестинальный пептид (ВИП), медиатор расслабления бронхов. Кроме того, триптаза является мощным фактором роста фибробластов и может служить молекулярным звеном, связывающим активацию тучных клеток с фиброзом.
Клинические исследования тучных клеток при астме и сенной лихорадке
Недавние клинические исследования показали, что во время сезона цветения (но не перед ним) у лиц, страдающих сенной лихорадкой, наблюдается инфильтрация эпителия носовой полости ТКСО. Подобно этому, увеличенное количество тучных клеток (пока не охарактеризованных) обнаруживается в бронхоальвеолярных смывах от больных астмой.
Поскольку слизистая поверхность бронхов является участком первого контакта организма с вдыхаемым аллергеном, взаимодействие с ним тучных клеток приводит к выбросу медиаторов и увеличению проницаемости ели зистой. В результате происходит дальнейшее выделение медиаторов тучными клетками подслизистого слоя, что усиливает клинические симптомы. Степень де- грануляции можно оценить по уровню триптазы в сыворотке. Благодаря стабильности молекулы триптаза служит более надежным маркером дегрануляции тучных клеток, чем гистамин.
Лекарственные препараты, влияющие на тучные клетки, могут оказывать клинически важные эффекты. Выяснение природы тучных клеток бронхоальвеолярной поверхности и их реакции на антиаллергические средства могло бы существенно помочь разработке способов терапии. Например, у крыс, зараженных паразитом Nippostrongylus brasiliensis, кортикостероиды быстро и резко уменьшают накопление ТКСО в кишечнике.
Интересно, что местное применение кортикостероидов блокирует также увеличение количества тучных клеток в носовой полости, которое наблюдается у лиц, страдающих сенной лихорадкой, в период цветения. Механизм этой супрессии неясен, но известно, что кортикостероиды ингибируют продукцию Тх-клетками цитокинов, в том числе ИЛ-3 и ИЛ-4, действующих как факторы роста тучных клеток.
Влияние различных лекарственных средств на дегрануляцию тучных клеток может иметь важнейшее функциональное и клиническое значение. У крыс кромогликат натрия и теофиллин ингибируют выброс гистамина из СТТК, но не из ТКСО. Гетерогенность тучных клеток и их видовые различия не позволяют с уверенностью экстраполировать эти данные на человека. Получение «чистых» клонов тучных клеток человека могло бы помочь разработке средств лечения аллергических заболеваний, ставших в наше время бичом человечества.
Другие клетки иммунной системы также связывают IgE
Нормальные эозинофилы и тромбоциты при сенсибилизации IgE приобретают повышенную цитотоксичность в отношении некоторых паразитов, включая шистосом. Кроме того, у страдающих аллергией лиц эти клетки могут сенсибилизироваться циркулирующими иммунными комплексами, содержащими IgE. Как эозинофилы, так и тромбоциты, возможно, принимают участие в аллергических реакциях, поскольку они содержат различные медиаторы и воспалительные белки, способные усиливать эти реакции. Недавно было установлено, что эозинофилы, макрофаги, тромбоциты и клетки Лангерганса экспрессируют как высоко-, так и низкоаффинные рецепторы к IgE (рис. 23.13).
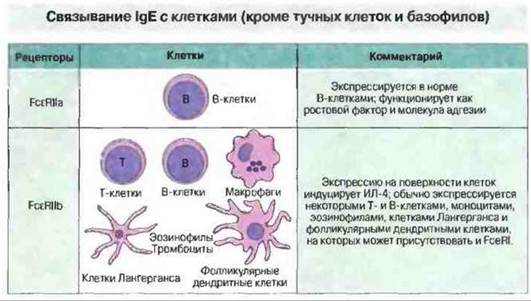
Рис. 23.13. По сравнению с FcεRI тучных клеток и базофилов рецепторы других клеток (FcεRII) обладают гораздо меньшей аффинностью к IgE. Рецептор FcεRIIa конститутивно экспрессируется нормальными В-клетками, тогда как экспрессию FceRllb различными клетками индуцирует ИЛ-4. Рецептор FcεRIIb экспрессируется на Т-клетках, В-клетках, моноцитах и макрофагах, а также на кожных клетках Лангерганса. Клетки Лангерганса, макрофаги и эозинофилы экспрессируют и высокоаффинные FcεRI.
Примечательно, что на поверхности кожных клеток Лангерганса у больных атопической экземой присутствует связанный IgE, который может играть важную роль в презентации антигена/аллергена инфильтрирующим кожу Т-клеткам и тем самым вызывать воспалительные реакции в коже. Такие IgE-связывающие клетки Лангерганса отсутствуют в коже здоровых людей или лиц с атопией без экземы.
Дегрануляция тучных клеток может индуцироваться различными путями
После связывания IgE с FcεRI на поверхности тучных клеток и базофилов перекрестное связывание этого иммуноглобулина может вызывать дегрануляцию клеток. Такое перекрестное связывание осуществляется аллергеном или другими молекулами и приводит к агрегации Fcε-рецепторов, что вызывает поступление кальция в клетку и как следствие ее дегранулицию.
К дегрануляции приводит также непосредственное перекрестное связывание рецепторов (рис. 23.14). Например, такие лектины, как ФГА или КонА, могут перекрест но связывать IgE, взаимодействуя с углеводными остатками в составе Fc-фрагмента. Этим, возможно, объясняется причина крапивницы у некоторых лиц с аллергией на землянику — ягоды, содержащие большое количество лектина.
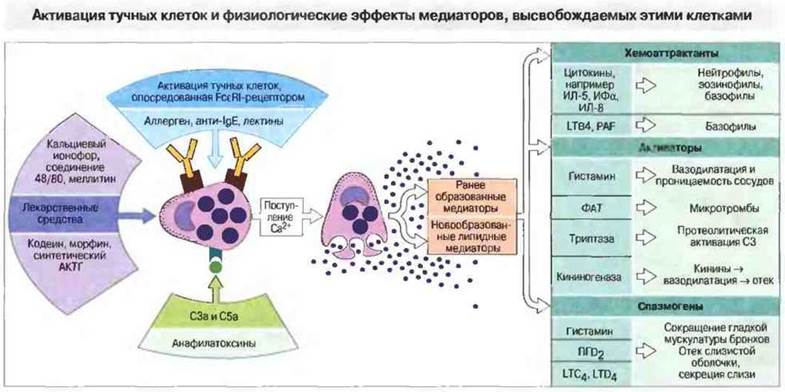
Рис. 23.14. Тучные клетки могут активироваться иммунологическими стимулами, приводящими к перекрестному связыванию Fcε-рецепторов, а также другими агентами, такими как анафилатоксины и секретогены (например, соединение 48/80, меллитин и кальциевый ионофор А23187). Как установлено, и некоторые другие вещества, в том числе кодеин, морфин и синтетический АКТГ, непосредственно действуют на тучные клетки. Все эти агенты оказывают один и тот же эффект - вызывают поступление в клетку ионов Са2+, необходимое как обязательное условие для ее дегрануляции. Формирование микротрубочек и перемещение гранул к клеточной мембране приводит к их слиянию с мембраной и высвобождению находящихся в гранулах ранее образованных медиаторов. Изменении плазматической мембраны, сопровождающиеся активацией фосфолипазы А2, обусловливают высвобождение арахидоновой кислоты, которая затем подвергается действию одного из ферментов (в зависимости от типа тучной клетки) - липоксигеназы или циклооксигеназы. К образующимся при этом липидным метаболитам циклооксигеназного пути относятся простагландины (ПГD2) и тромбоксаны, липоксигеназного пути - лейкотриены (LTC4, LTD4 и хемотаксический LTB4). Как пред-, так и новообразованные липидные медиаторы гранул оказывают эффекты трех видов.
Хемотаксические агенты привлекают к месту активации тучных клеток многие другие клетки, в частности эозинофилы, нейтрофилы и мононуклеарные клетки, включая лимфоциты. Кроме того, недавно установлено, что некоторые предобразованные цитокины, выделяемые тучными клетками при их дегрануляции, также служат сигналами хемотаксиса для воспалительных клеток.
Активаторы воспаления могут вызывать расширение сосудов, отек и (при участии фактора активации тромбоцитов, ФАТ) образование микротромбов с локальным повреждением тканей. Триптаза, главная нейтральная протеаза тучных клеток, присутствующих в легких у человека, может непосредственно активировать С3; этот эффект блокируется гепарином. Высвобождаемые при воспалении кининогеназы, превращая кининогены в кинины, расширяют мелкие кровеносные сосуды, в свою очередь способствуя воспалению.
Спазмогены непосредственно влияют на гладкую мускулатуру бронхов, но могут усиливать и секрецию слизи, приводящую к закупорке бронхов.
Некоторые вещества чрезвычайно активны в отношении дегрануляции тучных клеток. Вероятно, in vivo наибольшее значение среди них имеют продукты распада компонентов комплемента С3а и С5а. Эти анафилатоксины влияют и на многие другие клетки, в том числе на нейтрофилы, тромбоциты и макрофаги. К веществам, способным непосредственно активировать тучные клетки, относятся также кальциевые ионофоры, меллитин, соединение 48/80 и лекарственные средства, например синтетический АКТГ, кодеин и морфин. Все они активируют тучные клетки, вызывая поступление в них ионов кальция. Анафилактический ответ, индуцируемый этими агентами, идентичен ответу, опосредуемому IgE, хотя, конечно, эти вещества действуют по IgE-независимым механизмам.
Дегрануляции приводит к выделению предобразованных медиаторов и индуцирует синтез других из арахидоновой кислоты. Индуцируемое антигеном поступление кальция в тучные клетки имеет два основных следствия. Во-первых, происходит экзоаитоз гранул с высвобождением ранее образованных медиаторов (у человека это в основном гистамин). Во-вторых, индуцируется образование новых медиаторов из арахидоновой кислоты — простагландинов и лейкотриенов, которые оказывают прямое местное влияние на ткань. В легких они сразу же вызывают констрикцию бронхов, отек слизистой и гиперсекрецию слизи, что приводит к астме (см. рис. 23.14 и 23.20).
Как выясняется, различные популяции тучных клеток продуцируют разные новообразованные медиаторы. Например, противогистаминные средства оказывают клинический эффект при рините и крапивнице, но не при астме, в развитии которой более важную роль играют лейкотриены.
Некоторые соединения блокируют выделение медиаторов, увеличивая внутриклеточный уровень сАМР (например, такой эффект оказывает стимулирующий β-адренорецепторы изопреналин) или препятствуя его распаду под действием фосфодиэстеразы (таково, например, действие теофиллина). Механизм действия кромогликата натрия, блокирующего выброс гистамина из тучных клеток, пока неясен; возможно, он состоит в ингибировании вызываемого аллергеном поступления кальция в клетки; это вещество может также влиять на выделение медиаторов из других клеток.