ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 24. Гиперчувствительность - тип II
РЕАКЦИИ ПРОТИВ КЛЕТОК КРОВИ
Наиболее яркие примеры гиперчувствительности II типа — это антиэритроцитарные реакции. Они могут вызывать тяжелые последствия в следующих случаях:
✵ переливание несовместимой крови, когда реципиент сенсибилизирован к поверхностным антигенам эритроцитов донора;
✵ гемолитическая болезнь новорожденных, возникающая в результате сенсибилизации беременной женщины эритроцитами плода, и
✵ аутоиммунные гемолитические анемии, когда больной сенсибилизирован собственными эритроцитами.
Антитромбоцитарные реакции могут служить причиной тромбоцитопении; при системной красной волчанке имеют место анти нейтрофильные и антилимфоцитарные реакции.
Трансфузионные реакции развиваются при наличии у реципиента антител, реагирующих с эритроцитами донора
У человека идентифицировано более 20 систем групп крови, определяющих существование более 200 генетических вариантов эритроцитарных антигенов. Каждая система групп крови представляет собой генный локус, определяющий специфичность антигенов на поверхности клеток крови (обычно, но не всегда, эритроцитов). В каждой системе возможны два или большее число фенотипов. Система АВО, например, определяет четыре возможных фенотипа (А, В. АВ и 0) и, следовательно, четыре группы крови. Иммуноциты индивида сданной группой крови распознают эритроциты, несущие аллогенные (не-свои) антигены и вырабатывают антитела к ним. Для некоторых групповых антигенов антитела могут быть и «естественными», т. е. вырабатываться без предшествующей сенсибилизации чужеродными эритроцитами (см. ниже). Трансфузия аллогенных эритроцитов человеку, у которого имеются антитела к ним, может вызывать разрушение эритроцитов и появление симптомов «трансфузионной реакции». Некоторые групповые антигены крови (АВО и резус) обладают относительно сильной иммуногенностью, т. е. чаще индуцируют образование антител. Планируя переливание крови, важно предусмотреть совместимость донора и реципиента по этим главным группам крови, иначе возникнут трансфузионные реакции. Некоторые основные системы групп крови человека перечислены на рис. 24.6.
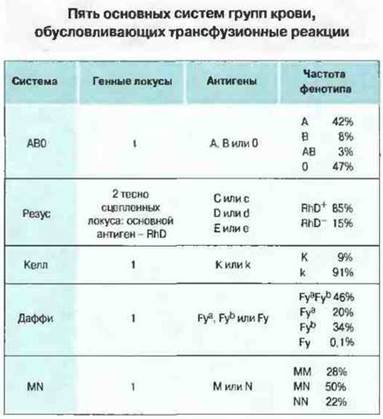
Рис. 24.6. Не все групповые антигены обладают равной антигенностью: так, RhD вызывает более сильную трансфузионную реакцию у несовместимого реципиента, чем другие антигены системы резус, a Fyа - более сильную, чем Fyb. Указанные частоты фенотипов характерны для европеоидов. Для других рас характерна иная частота генов.
Система АВО. Это наиболее важная система; соответствующие эпитоны присутствуют не только на эритроцитах, но и на клетках многих других типов, и локализованы в углеводной части гликопротеинов. Структура этих углеводов, как и углеводов, определяющих близкую систему групп крови — Льюис, зависит от генов ферментов, транспортирующих терминальные сахара к углеводному скелету (рис. 24.7). У большинства людей присутствуют антитела к аллогенным антигенам системы АВО, так как их образование не требует предварительной сенсибилизации чужеродными эритроцитами; необходимая сенсибилизация происходит при контакте с идентичными эпитопами, экспрессируемыми на клетках многих видов микроорганизмов. Поэтому антитела к антигенам АВО встречаются очень часто, что придает чрезвычайную важность подбору донорской крови именно но этой системе. Однако все люди толерантны к антигену 0, и поэтому носители данного антигена являются универсальными донорами в отношении системы АВ0.
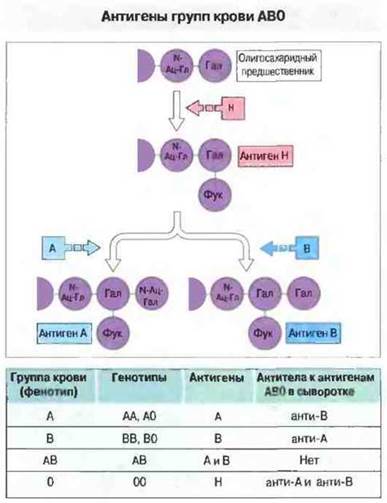
Рис. 24.7. Схема, иллюстрирующая формирование системы групп крови АВО. Фермент, кодируемый геном Н, прикрепляет остаток фукозы (Фук) к терминальному галактозному (Гал) остатку олигосахаридного предшественника, У лиц, обладающих геном А, к этому остатку галактозы присоединяется N-ацетилгалактозамин (N-Ац-Гал), а у лиц с геном В - вторая молекула галактозы; в результате образуются антигены А и В соответственно. У лиц с обоими генами образуются оба антигена. В таблице указаны генотипы и антигены системы АВО. У большинства людей продуцируются «естественные» антитела к отсутствующим у них антигенам.
Система резус. Эта система также очень важна, поскольку именно с ней связана основная при чина гемолитической болезни новорожденных. Антигены резус ассоциированы с мембранными белками 30 кДа, которые в умеренном количестве экспрессированы на поверхности эритроцитов. Эти антигены кодируются двумя тесно сцепленными генными локусами — RhD и RhCcEe, характеризующимися 92% гомологией. С клинической точки зрения наиболее важен RhD, поскольку он высокоиммуногенен; улиц RhD- локус RhD полностью отсутствует. Локус RhCcEeкодирует молекулу, содержащую эпитопы RhC/c и RhE/e.
Минорные системы групп крови. Эпитопы системы MN представлены N-концевыми гликозилированными участками гликофорина А гликопротеина поверхности эритроцитов. Антигенность определяется полиморфизмом аминокислотных остатков 1 и 5. Носителем антигенов близкой системы Ss является гликофорин В. Зависимость групп крови от поверхностных белков эритроцитов представлена на рис. 24.8. Минорные группы крови относительно редко служат причиной трансфузионных реакций, если только не производятся повторные переливания. И опять-таки, тщательный подбор донорской крови резко снижает риск таких реакций.
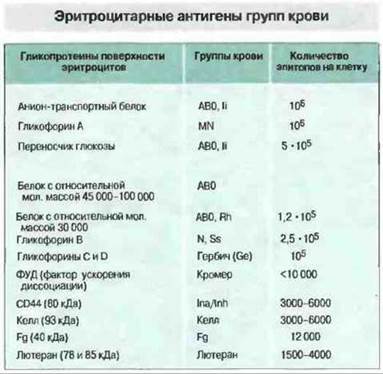
Рис. 24.8. Обратите внимание, что групповые эпитопы, формируемые углеводными структурами, такие как АВ0 и Ii (экспрессированный на полисахариде - предшественнике АВ0), могут появляться на многих различных белках, включая Rh-антигены. Другие групповые антигены, например резус и Кромер, представляют собой белки, поэтому носителями данных эпитопов могут быть лишь определенные белковые молекулы. Как правило, наиболее важные групповые антигены крови присутствуют на эритроцитах в большом количестве, создавая тем самым изобилие мишеней для комплемент-зависимого лизиса или опосредованного Fc-peцепторами клиренса.
Проба на совместимость. Цель такой пробы заключается в том, чтобы проверить, не содержатся ли в крови реципиента антитела, способные реагировать с эритроцитами донора и разрушать их. Например, антитела к антигенам системы АВО вызывают агглютинацию несовместимых клеток и эта реакция видна невооруженным глазом. Антигены минорных систем групп кропи вызывают менее выраженные реакции, которые можно зарегистрировать только с помощью непрямого теста Кумбса (см. рис. 24.12). При переливании цельной крови необходимо убедиться и в том, что сыворотка донора не содержит антител к эритроцитам реципиента. Однако переливание цельной крови осуществляют редко. Донорскую кровь обычно разделяют на клеточную и сывороточную фракции, которые используют порознь.
При трансфузионных реакциях происходит массовое разрушение клеток крови хозяина. Трансфузия эритроцитов реципиенту, у которого имеются антитела к этим клеткам, вызывает немедленную реакцию —лихорадку, падение давления, тошноту и рвоту, а также боли в спине и груди. Тяжесть реакции зависит от класса и количества участвующих в ней антител.
Антитела к антигенам системы АВО обычно относятся к классу IgM и вызывают агглютинацию, активацию комплемента и внутрисосудистый гемолиз.
Другие системы групповых антигенов крови индуцируют образование антител IgG, которые по сравнению с IgM слабее агглютинируют эритроциты. Клетки, сенсибилизированные IgG, обычно поглощаются фагоцитами печени и селезенки, хотя при тяжелых реакциях разрушение эритроцитов происходит и вследствие активации комплемента. В таких случаях возможно развитие коллапса, а выделяющееся содержимое эритроцитов может вызвать острый некроз почечных канальцев. Эти острые трансфузионные реакции часто наблюдаются у несенсибилизированных лиц и развиваются через несколько суток или недель, по мере образования антител к чужеродным клеткам. В результате возникает анемия или желтуха.
Возможны трансфузионные реакции и на другие компоненты крови, хотя их последствия, как правило, не столь серьезны, как реакций на эритроциты.
Сверхострое отторжение трансплантата связано с трансфузионной реакцией. В тех случаях, когда у реципиента уже имеются антитела к трансплантируемой ткани, происходит сверхострое отторжение трансплантата. Оно возможно лишь в отношении тех тканей, которые реваскуляризуются сразу же после пересадки, например при пересадке почки. Наиболее тяжелые реакции отторжения этого типа обусловлены антигенами системы АВО, присутствующими на почечных клетках. Повреждение вызывают антитела и активация комплемента в кровеносных сосудах с последующим привлечением и активацией нейтрофилов и тромбоцитов. Однако в настоящее время, благодаря тщательному подбору доноров и реципиентов по антигенам АВО, такие реакции наблюдаются крайне редко. Антитела к другим антигенам трансплантата (например, молекулам МНС), образовавшиеся при предыдущих пересадках, также могут вызывать реакции этого типа.
Гемолитическую болезнь новорожденных вызывают материнские IgG-антитела, реагирующие с эритроцитами плода in utero
Гемолитическая болезнь новорожденных (ГБН) развивается в тех случаях, когда мать сенсибилизирована эритроцитарными антигенами плода и у нее образуются IgG-антитела к этим антигенам. Такие антитела проходят через плаценту и реагируют с эритроцитами плода, вызывая их разрушение (рис. 24.9 и 24.10). Чаще всего в этих реакциях участвует антиген резус D(RhD).
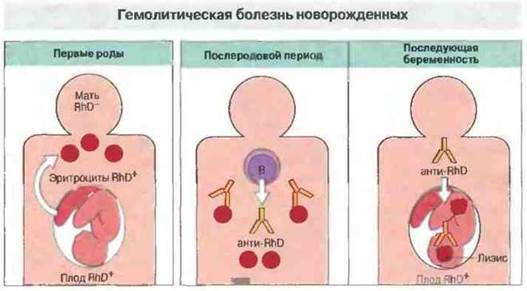
Рис. 24.9. Эритроциты резус* (RhD+) плода попадают в кровь матери обычно во время родов. Это стимулирует образование антител анти-Rh класса IgG в послеродовой период. При последующих беременностях IgG-антитела проходят через плаценту в кровь плода (антитела IgM через плаценту не проникают). Если плод опять оказывается RhD+, IgG-антитела матери вызывают разрушение его эритроцитов.
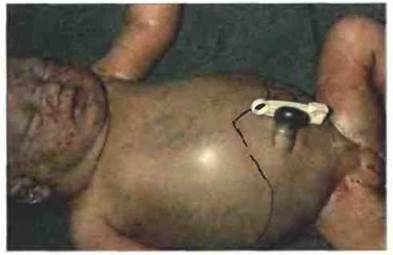
Рис. 24.10. Ребенок, страдающий ГБН. Для этой болезни характерно значительное увеличение размеров печени и селезенки из-за разрушения эритроцитов, вызванного материнскими антиэритроцитарными антителами, попавшими в кровь плода. В крови ребенка повышена концентрация билирубина (продукта распада гемоглобина). Геморрагические петехии на лице обусловлены нарушением функции тромбоцитов. Чаще всего такие реакции направлены против антигена RhD. (Фото любезно предоставлено д-ром К. Sloper).
При второй беременности сенсибилизированной Rh--матери, если плод и на этот раз оказывается Rh+, риск ГБН возрастает Сенсибилизация Rh--матери Rh+-эритроцитами плода обычно происходит при рождении первою Rh+-ребенка, когда какая-то часть его эритроцитов попадает через плаценту в кровь матери и распознается се иммунной системой. Таким образом, первый Rh--несовместимый ребенок обычно остается здоровым, тогда как для последующих детей высок риск заболевания, поскольку мать при каждой новой беременности сенсибилизируется повторно.
ГБН может быть связана и с реакциями на другие групповые антигены крови; следующим по частоте иммуногенным антигеном является К-антиген системы Келл. Реакции, обусловленные антителами анти-К, встречаются гораздо реже, чем обусловленные анти-RhD, поскольку антиген К встречается относительно редко (9%) и обладает более слабой антигенностью.
Известно, что риск ГБН вследствие резус-несовместимости уменьшается, если у отца и матери группы крови системы АВ0 различные. Это наблюдение позволило считать, что в таких случаях в организме Rh--матери клетки Rh+ разрушаются быстрее, поскольку они несовместимы и по антигенам АВ0. В результате Rh+-эритроциты плода не успевают сенсибилизировать мать. Отсюда возникла идея резус-профилактики: сразу после рождения Rh+-peбенка Rh--матерью ей вводят антитела анти-RhD с целью разрушить попавшие в ее кровь эритроциты Rh+-плода прежде, чем они смогут оказать сенсибизирующее действие. Таким способом удалось существенно снизить частоту ГБН, обусловленной резус-несовместимостью (рис. 24.11).
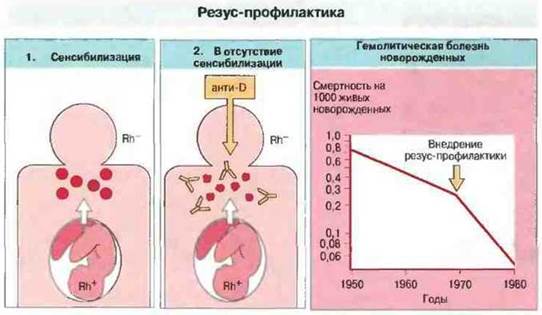
Рис. 24.11. 1. В отсутствие профилактики эритроциты Rh+, попадающие в кровь Rh--матери, сенсибилизируют ее к антигену Rh. 2. Если женщине сразу же после родов вводят антитела анти-Rh (анти-D), они разрушают Rh+-эритроциты и предотвращают сенсибилизацию. В период 1950-1966 гг. снижение смертности от ГБН было связано с общим улучшением медицинского обслуживания. Внедрение резус-профилактики в 1969 г. заметно ускорило это снижение.
Аутоиммунные гемолитические анемии возникают либо спонтаннно, как аутоиммунные заболевания, либо как реакции на лекарственные препараты
Реакции на групповые антигены крови могут развиваться спонтанно, как это наблюдается при аутоиммунных гемолитических анемиях, когда у больных происходит выработка антител к собственным эритроцитам Подозрение на аутоимунную гемолитическую анемию возникает в том случае, когда кровь больного дает положительный результат в непрямом антиглобулиновом тесте (рис. 24.12), выявляющем присутствие антител на эритроцитах. Обычно эти антитела направлены против эритроцитарных антигенов или иммунных комплексов, адсорбированных на поверхности эритроцитов. Непрямой антиглобулиновый тест применяется также для обнаружения антител на эритроцитах при переливании иногруппной крови и при ГБН (см. выше). Аутоиммунные гемолитические анемии можно разделить на три типа в зависимости от того, чем они вызваны:
✵ тепловыми аутоантителами, реагирующими с антигеном при 37 °С,
✵ холодовыми аутоантителами, реагирующими с антигеном только при температуре ниже 37 °С, или
✵ антителами, образующимися при аллергической реакции на лекарственные препараты.
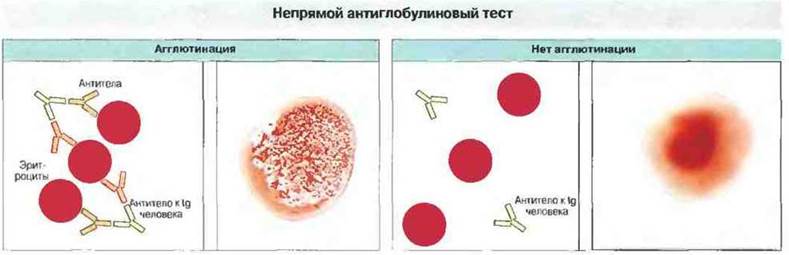
Рис. 24.12. Этот тест, называемый также пробой Кумбса, применяют для обнаружения антител на поверхности эритроцитов больного. При наличии таких антител антитела к иммуноглобулину человека вызывают агглютинацию эритроцитов. В отсутствие антител на эритроцитах антиглобулин человека агглютинации не вызывает.
Тепловые аутоантитела ускоряют элиминацию эритроцитов. Тепловые аутоантитела часто образуются к антигенам системы резус, в том числе к детерминантам локусов RhC, RhE и RhD. От антител, вызывающих трансфузионные реакции, они отличаются тем, что взаимодействуют с другими эпитопами. Существуют тепловые аутоантитела и к другим групповым антигенам крови, но они встречаются редко. Причины гемолитических анемий обычно остаются неизвестными, но некоторые из этих заболеваний ассоциированы с другими аутоиммунными болезнями. Анемия чаще связана с ускоренным разрушением сенсибилизированных эритроцитов селезеночными макрофагами, чем с их комплемент-опосредованным лизисом.
Холодовые аутоантитела вызывают лизис эритроцитов в результате фиксации комплемента. Холодовые аутоантитела часто присутствуют в более высоких титрах, чем тепловые. Они принадлежат главным образом к классу IgM и прочно связывают комплемент. В большинстве случаев эти антитела специфичны по отношению к антигенам системы групп крови Ii. Эпитопы I и iприсутствуют на молекулах — предшественниках полисахаридов, содержащих эпитопы системы АВ0, и являются результатом неполного гликолизирования основного полисахарида.
Реакция холодовых антител с эритроцитами происходит в периферической крови — кожных капиллярах, где температура крови, особенно в зимнее время, может упасть ниже 30 °С. В тяжелых случаях агрегация клеток и микротромбоз мелких сосудов, вызванные комплемент-опосредованным разрушением эритроцитов, приводят к некрозу периферических тканей. Тяжесть анемии поэтому непосредственно связана со способностью сыворотки больного фиксировать комплемент. (Опосредованного Fc-рецепторами разрушения сенсибилизрованных клеток в селезенке и печени в данном случае не происходит, поскольку температура этих органов слишком высока для взаимодействия этих антител с эритроцитами.)
Холодовые аутоиммунные гемолитические анемии чаще всего встречаются у людей пожилого возраста. Их причина неизвестна, но следует подчеркнуть, что образующиеся аутоантитела обладают весьма ограниченной клональностью, что указывает на присутствие ограниченного числа аутореактивных клонов. В то же время в ряде случаев болезни предшествует инфекция, вызванная Mycoplasma pneumoniae; анемия при этом возникает остро, длится недолго и характеризуется присутствием поликлональных аутоантител. Такие случаи, как считают, обусловлены перекрестным взаимодействием антигенов на поверхности бактерий и эритроцитов, которое вызывает нежелательные реакции в обход нормальных механизмов толерантности (см. гл. 28).
«Лекарственные» реакции на компоненты крови могут быть вызваны как связыванием антител с адсорбированными на клетках веществами, так и срывом аутотолерантности. Лекарственные препараты (или продукты их катаболизирования) могут провоцировать реакции гиперчувствительности против клеток крови (включая эритроциты и тромбоциты) тремя разными путями (рис. 24.13).
✵ Реакция возникает в том случае, если происходит связывание лекарственною вещества с клетками крови и к нему образуются антитела. При этом варианте необходимо присутствие как вещества, так и антител. Соответствующий феномен впервые был описан Акройдом (Ackroid), который обнаружил тромбоцитопеническую пурпуру (разрушение тромбоцитов, ведущее к появлению красной сыпи) после введения лекарственного препарата седормида. После введения многих лекарств, включая пенициллин, хинин и сульфаниламиды, наблюдались гемолитические анемии. Подобные реакции встречаются редко.
✵ Если на клеточной мембране эритроцитов адсорбируются иммунные комплексы «лекарственное вещество—антитело», происходит опосредованный комплементом лизис клеток.
✵ Когда лекарственное вещество вызывает аллергическую реакцию и аутоантитела направлены против самих эритроцитарных антигенов, это также вызывает повреждение, как, например, у 0,3 % больных, получающих α-метиддофа. Образующиеся при этом антитела сходны с тепловыми. В подобных случаях вскоре после отмены препарата наступает выздоровление.
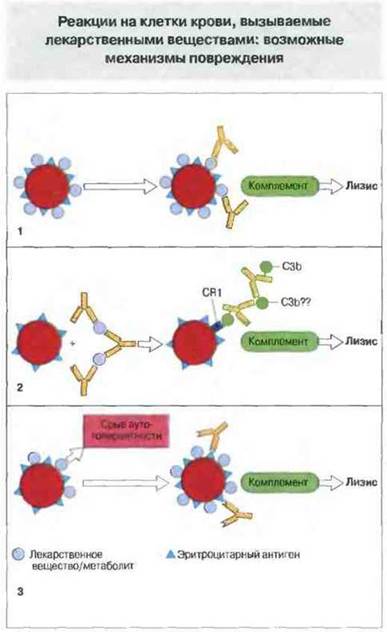
Рис. 24.13. Три механизма повреждения, вызываемого лекарственными веществами.
1. Вещество адсорбируется на клеточных мембранах. Антитела к нему связываются с клеткой и обусловливают ее комплемент-опосредованный лизис.
2. Иммунные комплексы, состоящие из вещества и антитела, адсорбируются на эритроцитах. Это могло бы происходить при участии Fc-рецептора, но вероятнее участие CR1-рецептора С3b. Повреждение обусловлено комплемент-опосредованным лизисом клеток.
3. Вещество, предположительно адсорбированное на клеточной поверхности, вызывает срыв аутотолерантности, возможно в результате стимуляции Т-хелперных (Тх) клеток. Это приводит к образованию антител к другим антигенам (групповым антигенам крови) клеточной поверхности.
Обратите внимание, что в случаях 1 и 2 для возникновения повреждения необходимо присутствие вещества на клетке, тогда как в случае 3 клетки разрушаются независимо от адсорбции на нем вещества.
При системной красной волчанке и тромбоцитопении развиваются реакции против других клеток крови
Антитела к нейтрофилам и лимфоцитам. Аутоантитела к нейтрофилам (рис. 24.14) полностью тканеспецифичны; они связываются только с нейтрофилами и ни с чем больше. (Напротив, антитела к антигенам системы АВ0 практически не обладают тканеспецифичностыо, поскольку те же антигены этой системы присутствуют не только на эритроцитах, но и на клетках мочек, слюнных желез и многих других тканей.) При системной красной волчанке (СКВ) обнаруживаются антитела как к нейтрофилам, так и к лимфоцитам, но роль таких антител в патогенезе заболевания относительно невелика, возможно потому, что эти клетки очень быстро удаляют связанные антитела со своей поверхности.
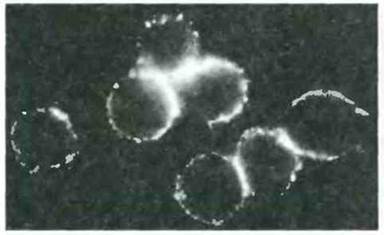
Рис. 24.14. Антитела к нейтрофилам при СКВ, обнаруживаемые по иммунофлуоресценции нормальных нейтрофилов. (К нормальным нейтрофилам добавляли сыворотку больного СКВ, а затем антитела к Fab-человека, меченные флуоресцентным красителем Микрофотография отчетливо указывает на присутствие антител к нейтрофилам.) Острая трансфузионная реакция против нейтрофилов может сопровождаться повышением температуры тела, вероятно вследствие высвобождения пирогенных веществ из поврежденных клеток. Это свидетельствует о способности антинейтрофильных антител повреждать нейтрофилы, хотя роль таких антител в патогенезе СКВ остается неясной. (Воспроизведено с разрешения из J. Clin. Inv., 1979; 64.902-12.)
Антитела к тромбоцитам. Аутоантитела к тромбоцитам присутствуют почти у 70% больных идиопатической тромбоцитопенической пурпурой (при этом заболевании происходит ускоренное исчезновение тромбоцитов из циркуляции, главным образом в результате поглощения их макрофагами селезенки). В элиминации тромбоцитов участвуют макрофагальные рецепторы иммуноадгезии.
Тромбоцитопеническая пурпура чаще развивается после бактериальных или вирусных инфекций, но может быть связана и с аутоиммунными заболеваниями, в том числе СКВ. При СКВ иногда определяются антитела к кардиолипину мембраны тромбоцитов. Аутоантитела к кардиолипину и другим фосфолипидам могут нарушать одну из реакций свертывания крови (в этом случае их называют волчаночным антикоагулянтом) и в ряде случаев служат причиной венозного тромбоза и повторных выкидышей. Механизмы развития тромбоцитопении под влиянием лекарственных веществ могут быть сходны с теми, которые показаны на рис. 24.13.