ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 25. Гиперчувствительность - тип III
ОБНАРУЖЕНИЕ ИММУННЫХ КОМПЛЕКСОВ
Отложение иммунных комплексов можно выявить с использованием иммунофлуоресценции
С наибольшей вероятностью отложение комплексов можно обнаружить в пораженном органе. С этой целью срезы тканей исследуют иммунофлуоресцентным методом на присутствие иммуноглобулинов и комплемента. Данные о составе и характере комплексов, а также месте их локализации в пораженной ткани важны для оценки тяжести и для прогноза заболевания. Например, в случае мембранозного гломерулонефрита при наличии крупных зернистых отложений IgG в субэпителиальном слое почечных клубочков прогноз плохой, а при локализации комплексов в мезангии — хороший. Воспалительная реакция обнаруживается не во всех тканях, связывающих иммунные комплексы. Например, при СКВ комплексы часто присутствуют в биоптатах не только воспаленной, но и внешне нормальной кожи.
Выявление иммунных комплексов в крови
В крови комплексы не только связаны с эритроцитами, но присутствуют также в свободной форме в плазме. Связанные с эритроцитами комплексы реже оказывают повреждающее действие, поэтому больший интерес представляет определение уровня свободных комплексов. При отборе проб крови необходимо соблюдать ряд прелости рож н остей, поскольку связанные комплексы при образовании сгустка легко высвобождаются под действием фактора I. Чтобы избежать этого, следует быстро отделять эритроциты от плазмы.
Для идентификации крупных комплексов, содержащих антитела IgG, часто используют осаждение иммунных комплексов полиэтилен гликолем (ПЭГ) с последующим определением IgG в осадке. На этом принципе основана одна из коммерческих систем определения иммунных комплексов (рис. 25.23).
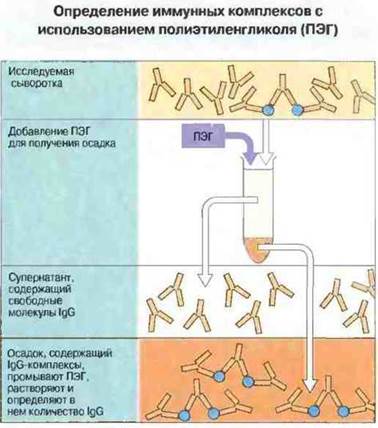
Рис. 25.23. К пробе сыворотки, содержащей IgG-комплексы и мономер IgG, добавляют полиэтиленгликоль (ПЭГ). При 2% концентрации ПЭГ осаждаются только комплексы, а свободные антитела остаются в растворе. Затем пробирки центрифугируют, при этом образуется осадок комплексов на дне. Содержащий свободные антитела супернатант удаляют. Осадок промывают и вновь переводят в раствор для определения количества присутствующего в комплексах IgG (например, с помощью простой радиальной иммунодиффузии, нефелометрии или радиоиммунологического анализа).
Циркулирующие комплексы часто определяют также по их сродству к компоненту С1q комплемента, используя радиоактивно меченный или находящийся в твердой фазе (связанный с твердой подложкой) С1q (рис. 25.24).
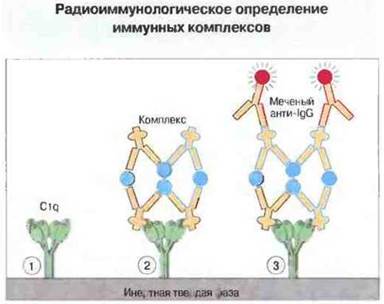
Рис. 25.24. Радиоиммунологическое определение иммунных комплексов с использованием C1q.
1. C1q связывают с инертной твердой фазой (подложкой); обычно ею служит полистироловая пробирка или пластинка.
2. Добавляют содержащую комплексы сыворотку. Комплексы связываются с твердофазным C1q посредством своих Fc-участков, доступных для взаимодействия с C1q.
3. Добавляют радиоактивно меченные антитела анти-IgG. После промывания регистрируют с помощью гамма-счетчика радиоактивность твердой фазы и по ней рассчитывают количество связанных с C1qкомплексов.
Для связывания и определения количества иммунных комплексов можно использовать и другие рецепторы, например С3-рецептор клеток линии RAJI (В-клеточная опухоль) или Fc-peцептор тромбоцитов.
Однако к определению комплексов в случае аутоиммунных заболеваний необходимо подходить с большой осторожностью. У таких больных могут присутствовать аутоантитела к компонентам самой тест-системы. При СКВ, например, образуются антилимфоцитарные и анти-ДНК-антитела, которые связываются с клетками RAJI, обусловливая ложноположительные результаты определения иммунных комплексов. Подобно этому, при ряде заболеваний соединительной ткани найдены антитела анти-CIq (структура СIq сходна со структурой коллагена), что создает возможность получения ложно-положительных результатов при использовании систем определения с применением CIq.
При любом используемом способе важно убедиться в том, что определяемые соединения действительно обладают большей молекулярной массой, чем мономерный IgG. Наконец следует учесть, что к опенке роли циркулирующих комплексов необходимо подходить даже более осторожно, чем к оценке значения тканевых отложений. Многие циркулирующие комплексы сами но себе безвредны. Повреждение возникает лишь при их отложении в тканях.
Вопросы для размышления
■ Какие факторы могут обусловливать персистенцию иммунных комплексов?
■ Почему иммунные комплексы откладываются в одних, а не других органах?
■ Какие новые воздействия на иммунную систему могли бы помочь в лечении болезней иммунных комплексов?
■ Полезна или вредна для организма вызываемая иммунными комплексами активация комплемента?
■ Каким образом класс антител влияет на судьбу иммунных комплексов?
■ Какие трудности возникают при лабораторном определении иммунных комплексов?
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Agnello V. 1983. Immune complex assays in rheumatic diseases. Hum. Pathol. 14: 343-9.
Arthus M. 1903. Injections r6petees de s6rum de cheval chez le lapin. C R. Seances Soc. Biol. Fihales 55: 817.
Birmingham D.J., Herbert L.A., Cosio F.G., et al. 1990. Immune complex erythrocyte complement receptor interactions in vivo during induction of glomerulonephritis in поп-human primates. J. Lab. Clin. Med. 116: 242-52.
Boackle S.A., Holer V.M., Karp D.R. 1997. CD21 augments antigen presentation in immune individuals. Eur. Immunol. 27: 122-29.
Cornacoff J.B., Hebert L.A., Smead W.L., Vanaman M E., Birmingham D.J., Waxman F.J. 1983. Primate erythrocyte immune complex clearing mechanrsm. J. Clin. Invest. 71: 236-47.
Czop J., Nussenzweig V. 1976 Studies on the mechanism of solubilization of immune precipitates by serum. J. Exp. Med. 143: 615-30.
Davies K.A., Erlendsson J., Beynon H.L.C. et al. 1993. Splenic uptake of immune complexes in man is complement-dependent. J. Immunol. 151: 3866 73.
Davies K.A., HirdV., StewartS., etal. 1990. A study of in vivo immune complex formation and clearing in man. J. Immunol 144: 4613-20.
Davies K.A , Schifferli J.A., Walport M.J. 1994. Complement deficiency and immune complex diseases. Springer Seminars in Immunopathology 15: 397-416.
Dixon F.J., Joseph D., Feldman J.D. et al. 1961. Experimental glomerulonephritis: the pathogenesis of a laboratory model resembling the spectrum of human glomerulonephritis. J. Exp. Med. 113: 899-919.
Dixon F.J., Vazques J.J., Weigle W.O. et al. 1958. Pathogenesis of serum sickness. Arch. Pathol. 65: 18-28
Emlen W., Carl V., Burdick CG 1992. Mechanism of transfer of immune complexes from red blood cell CR1 to monocytes. Clin. Exp. Immunol. 89: 8-17.
Finbloom D.S., Magilvary D.B., Harford J.B. etal. 1981. Influence of antigen on immune complex behaviour in mice. J. Clin. Invest. 68: 214-24.
Heidelberger M. 1941. Quantitative chemical studies on complement or alexin. J. Exp. Med. 73: 681-709.
Inman R.D. 1982. Immune complexes in SLE. Clin. Rheum. Dis. 8: 49-62.
Johnston A., Auda G.R., Kerr M.A. et al. 1992. Dissociation of primary antigen-antibody bonds is essential for complement mediated solubilization of immune complexes. Mol. Immunol. 29: 659-65.
Kijlstra H., van Es L.A., Daha M.R. 1979. The role of complement in the binding and degradation of immunoglobulin aggregates by macrophages. J. Immunol. 123: 2488-93.
Lachmann P.J. 1980. Complement deficiency and the pathogenesis of autoimmune complex disease. Chem. Immunol. 49: 245-263.
Lucisano Valim M., Lachmann P.J. 1991. The effect of antibody isotype and antigenic epitope density on the complement-fixing activity of immune complexes: a systematic study using chimaeric anti-NIP antibodies with human Fc regions. Clin. Exp. Immunol. 84: 1-8.
Miller G.W., Nussenzweig V. 1975. A new complement function: solubilization of antigen-antibody aggregates. Proc. Natl. Acad. Sci. 72: 418-22.
Qiao J.-H., Castellam L.W., Fishbein M.C. et al. 1993. Immune-complex-mediated vasculitis increases coronary artery lipid accumulation in autoimmune- prone MRL mice. Arteriosclerosis Thromb. 13: 932-43.
Schifferli J.A., Ng Y.C., Peters D.K. 1986. The role of complement and its receptor in the elimination of immune complexes. N. Engl. J. Med. 315: 488-95.
Takata Y., Tamura N., Fujota T. 1984. Interaction of C3 with antigen-antibody complexes in the process of solubilisation of immune precipitates. J. Immunol. 132: 2531-7.
Theofilopoulos A.N., Dixon F.J. 1979. The biology and detection of immune complexes. Adv. Immunol. 28: 89-220.
Warren J.S., Yabroff K.R., Remick D.G. et al. 1989. Tumour necrosis factor participates in the pathogenesis of acute immune complex alveolitis in the rat. J. Clin. Invest. 84: 1873-82.
Waxman F.J., Hebert L.E., Cornacoff J.B. et al. 1984. Complement depletion accelerates the clearance of immune complexes from the circulation of primates. J. Clin. Invest. 74: 1329-40.
Whaley K. 1987. Complement and immune complex diseases. In: Whaley К (ed). Complement in Health and Disease. Lancaster: MTP Press Ltd.
Williams R.C. 1980. Immune Complexes in Clinical and Experimental Medicine. Massachusetts: Harvard University Press.
World Health Organization Scientific Group. Technical Report 606. The Role of Immune Complexes in Disease. Geneva: WHO, 1977.