ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 28. Аутоиммунные процессы и аутоиммунные заболевания
ЭТИОЛОГИЯ
Аутореактивные В- и Т-клетки присутствуют даже в здоровом организме
Несмотря на существование сложных механизмов селекции, контролирующих при созревании лимфоцитов их аутотолерантность, в организме присутствует большое количество потенциально аутореактивных лимфоцитов. В основном они представлены тимоцитами, которые избегают элиминации, вызываемой взаимодействием с собственными пептидами (аутоэпитопами). В норме присутствующие в тимусе АПК с презентированными на их поверхности аутоэпитопами осуществляют отрицательную селекцию и тем самым вызывают гибель аутореактивных Т-клеток. Однако скрытые аутоэпитопы АПК экспрессируют в относительно низких концентрациях (либо из-за их неэффективного процессинга, либо из-за низкого сродства к аминокислотным остаткам, образующим полость в молекулах МНС, либо из-за того и другого вместе). Поэтому такие аутоэпитопы неспособны обеспечивать элиминацию аутореактивных Т-клеток (рис. 28.15).
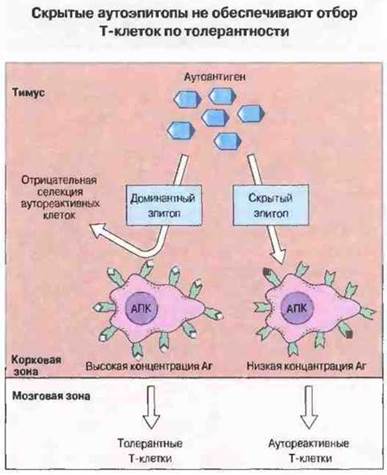
Рис. 28.15. Аутоэпитопы, появляющиеся после процессинга на поверхности АПК в высоких концентрациях и в ассоциации с молекулами МНС, называются доминантными; они служат мощными факторами делеции или анергии развивающихся аутореактивных Т-клеток. Поэтому из тимуса выходят в кровь только толерантные Т-клетки. Другие аутоэпитопы появляются на АПК в очень низких концентрациях; их называют скрытыми, в том смысле что они не обеспечивают делецию аутореактивных Т-клеток и такие клетки могут в результате пополнять периферические популяции зрелых Т- клеток. (Аг - антиген.)
Многие аутоантигены, вводимые с адъювантами, вызывают образование аутоантител даже у здоровых животных, что свидетельствует о присутствии у них аутореактивных В-клеток. Небольшое количество аутореактивных В-клеток (например, продуцирующих антитела к тиреоглобулину) может исходно присутствовать у здоровых людей. В нормальном организме присутствуют и аутореактивные Т-клетки, судя по тому что стимуляция Т-клеток из крови здоровых людей соответствующим аутоантигеном (например, основным белком миелиновой оболочки) и ИЛ-2 позволяет получить аутореактивные линии таких клеток.
Аутоиммунные процессы стимулируются антигеном
Если аутореактивные В-клетки существуют, то возникает вопрос, что стимулирует их пролиферацию и продукцию аутоантител — взаимодействие с антигеном или какие-то иные факторы наподобие неспецифических поликлональных активаторов или идиотипических взаимодействий (см. рис. 28.17). Нa роль антигена в селекции В-клеток указывает появление высокоаффинных аутоантител: они образуются в результате соматического гипермутирования - процесса, зависящего от влияния аутоантигена и Т-клеток. О значении антигена говорит и то, что аутоантитела направлены против ратных эпитопов одного и того же аутоантигена. Очень трудно представить себе не связанный с самим аутоантигеном механизм, который мог бы обусловить одновременное появление антител к разным эпитопам одной и той же молекулы. Аналогичный аргумент применим и к индукции у отдельного индивида аутоантител к органеллам (например, нуклеосомам и сплайсомам, появляющимся в виде пузырьков на поверхности клеток при апоптозе) или антигенам одного и того же органа (например, тиреоглобулину и тиреоидной пероксидазе).
Наиболее убедительное доказательство роли антигена в стимуляции аутоиммунного процесса было получено при исследовании кур линии OS, для которых характерно, как описано выше, спонтанное развитие аутоиммунного поражения щитовидной железы. Удаление у только что вылупившегося цыпленка щитовидной железы (источник антигена) предотвращает последующее появление антитиреоидных аутоантител (рис. 28.16). Кроме того, удаление щитовидной железы даже на фоне уже имеющейся продукции аутоантител приводит к резкому снижению их титра, обычно до уровня, недоступного для определения. Аналогичные эксперименты проведены на мышах линии NOD, подверженной заболеванию диабетом, не сопровождающимся ожирением (это заболевание сходно с аутоиммунным диабетом у человека). Химическое разрушение β-клеток у мышей NOD приводит к снижению титра панкреатических аутоантител. В случае волчанки введение мышам ДНКазы ослабляет проявления болезни, вероятно за счет разрушения потенциально патогенных иммунных комплексов.
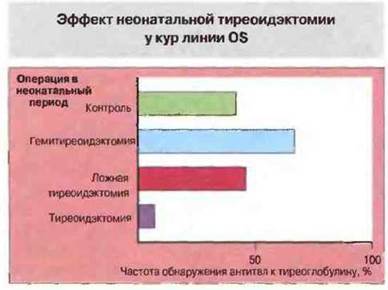
Рис. 28.16. Удаление щитовидной железы в неонатальный период предотвращает появление антитиреоидных аутоантител, что указывает на роль тиреоидных аутоантигенов в инициации аутоиммунного процесса. (По данным de Carvalho etal. 1982. J. Exp. Med. 155: 1255.)
Развитие аутоиммунного заболевания облигатно зависит от Т-клеток. Характерная для аутоантител IgG высокая аффинность обусловлена соматическими мутациями, для возникновения которых необходимо кооперативное действие Тх-клеток. На экспериментальных моделях аутоиммунных заболеваний получены прямые доказательства роли Т-клеток, но при болезнях человека получить такие доказательства гораздо труднее. Тем не менее из щитовидной железы больных тиреотоксикозом удалось выделить клоны Т-клеток, специфичные к тиреоидным антигенам, и, кроме того, установлено, что при ревматоидном артрите (как и при аутоиммунном заболевании у животных, см. рис. 28.14) положительное влияние может оказывать введение сыворотки aнти-CD4. Кроме того, на роль Т-клеток указывает ассоциация аутоиммунных заболеваний с определенными антигенами МНС (см. рис. 28.7), которая может объясняться участием этих антигенов в презентации антигенов Т-клеткам.
Многократно продемонстрировано, что при органоспецифических заболеваниях Т-клетки реагируют на антигены из органов, подвергающихся иммунной атаке. В случае же органонеспецифических аутоиммунных заболеваний неясно, какой антиген распознают Т-клетки. Один из возможных вариантов состоит в том, что Т-клетки узнают не обычный пептидный антиген, а идиотоп антитела (антигенную детерминанту в V-области иммуноглобулина). Это особенно вероятно при развитии аутоиммунной реакции против ДНК. С такой точки зрения, СКВ, например, могла бы представлять собой «болезнь идиотипа», схема которой приведена на рис. 28.17. Согласно этой гипотезе, нормальные В-клетки, используя гаметные гены, продуцируют небольшое количество аутоантител. Если такие аутоантитела образуют комплексы с аутоантигеном, эти комплексы могут поглощаться АПК (в том числе и В-клетками), которые презентируют Т-клеткам их компоненты, включая идиотопы антител. Идиотипспецифические Т-клетки могут затем «помогать» В-клеткам, продуцирующим аутоантитела.
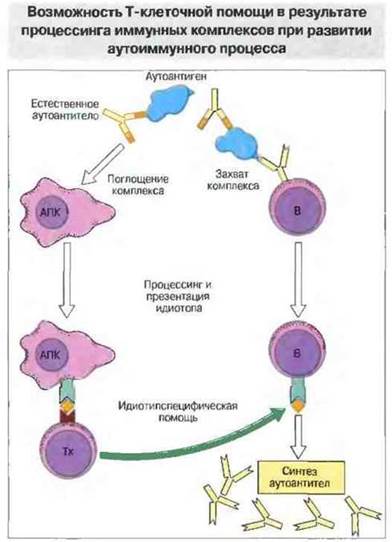
Рис. 28.17. Иммунный комплекс, состоящий из аутоантигена (например. ДНК) и естественных аутоантител (продуктов генов зародышевой линии), поглощается АПК, в которой происходит процессинг идиотипического сегмента (Id) антитела с последующей презентацией его Тх-клеткам. Иммунный комплекс могут также захватывать аутореактивные В-клетки, которые после процессинга Id презентируют его Тх-клеткам и в результате этого получают от них помощь.
Существует ряд путей обхода регуляторных механизмов, препятствующих развитию аутоиммунитета
Перекрестнореагирующие вследствие молекулярной мимикрии микробные антигены могут стимулировать аутореактивные В- и Т-клетки. В нормальных условиях непримированные аутореактивные Т-клетки, способные распознавать скрытые аутоэпитопы, не активируются, поскольку соответствующий антиген присутствует лишь в низких концентрациях на «профессиональных» АПК или презентируется «непрофессиональными» АПК (такими, как островковые β-клетки поджелудочной железы или эпителиальные клетки щитовидной железы), лишенными В7 или других костимулирующих молекул. Однако инфекция, вызванная микробом, который несет перекрестнореагирующие антигены (т. е. имеющие эпитопы, сходные со скрытыми аутоэпитопами), должна привести к появлению на профессиональных АПК такого количества подвергшихся процессингу пептидов, которое окажется достаточным для активации непримированных аутореактивных Т-клеток. В результате стимуляции эти Т-клетки приобретают способность распознавать и реагировать с аутоэпитопами на непрофессиональных АПК, поскольку больше не нуждаются в костимуляторном сигнале и обладают высокой авидностью к мишени из- за возрастания экспрессии вспомогательных молекул адгезии (рис. 28.18).
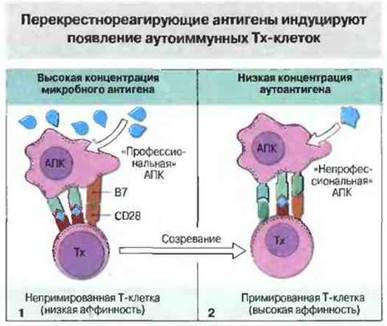
Рис. 28.18. Неспособность непримированных Тх-клеток распознавать аутоантиген на тканевой клетке, обусловлена низкой концентрацией антигена или низкой аффинностью к нему и может быть преодолена в результате связывания этими клетками перекрестнореагирующего микробного антигена. Такое связывание возможно в том случае, если этот антиген появляется на «профессиональных» АПК в большей по сравнению с аутоантигеном концентрации или рецептор Тх-клеток обладает к нему большей «врожденной» аффинностью, а также благодаря участию присутствующих на поверхности «профессиональных» АПК костимулирующих молекул, таких как В7. Это взаимодействие примирует Тх-клетки (1). Вследствие усиленной экспрессии вспомогательных молекул (например, LFA-1 и CD2) примированные Тх-клетки приобретают высокую аффинность к аутоантигену и, поскольку больше не требуют костимуляторного сигнала, могут взаимодействовать с аутоантигеном на «непрофессиональных» АПК (таких, как органоспецифические эпителиальные клетки), что приводит к развитию аутоиммунного заболевания (2).
Перекрестнореагируюшие антигены при наличии в их составе детерминант, сходных с аутоэпитопами, распознаваемыми В-клеточными рецепторами, могут нарушать толерантность и другим путем. Многие аутореактивные В-клетки не переходят в активное состояние потому, что необходимые для этого хелперные Т-клетки СГ)4+ остаются нечувствительными (либо из-за того, что толеризуются более низкими концентрациями аутоантигенов, чем В-клетки, либо из-за того, что распознают только скрытые эпитопы). Однако эти «лишенные помощи» В-клетки могут перейти в активированное состояние, если перекрестнореагирующий антиген несет и один «чужеродный» эпитоп, к которому Т-клетки не толерантны (рис. 28.19). Если активированные таким образом В-клетки при участии рецепторов концентрируют на своей поверхности аутоантиген и презентируют его покоящемуся в норме клону аутореактивных Т-хелперов, эти Тх-клетки начинают пролиферировать и действуют как хелперы, вызывая новую волну стимуляции В-клеток; в результате аутоиммунный процесс может продолжаться и после элиминации чужеродного антигена.
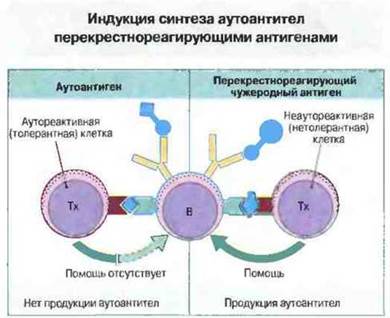
Рис. 28.19. В-клетка распознает такой эпитоп аутоантигена, которым случайно обладает и чужеродный антиген. В норме В-клетка презентирует аутоантиген, но не получает помощи от аутореактивных Тх-клеток, поскольку они функционально делетированы. При встрече с перекрестнореагирующим чужеродным антигеном В-клетка может презентировать его пептиды неаутореактивным T-клеткам и вследствие этого активироваться для пролиферации, дифференцировки и секреции аутоантител.
Эффект молекулярной мимикрии имеет место при ревматической лихорадке; в этом случае в сыворотке можно обнаружить аутоантитела к антигенам сердечных клапанов. Они появляются у небольшого процента лиц через несколько недель после перенесенной стрептококковой ангины. Углеводные поверхностные антигены стрептококков реагируют перекрестно с антигенами клапанов сердца и поэтому инфекция может привести к преодолению аутотолерантности Т-клеток по отношению к последним. При анкилозирующем спондилите имеет место, по-видимому, перекрестная реактивность между молекулами HLA-B27 и компонентами клеток некоторых штаммов Klebsiella, а при ревматоидном артрите бактериальные белки теплового шока реагируют перекрестно с молекулами DR4. Недавно найдены общие В-клеточные эпитопы у Yersinia enterocolyrica и внеклеточного домена рецептора для ТТГ (тиреотропного гормона).
В некоторых случаях чужеродный антиген может непосредственно стимулировать аутореактивные клетки. Другой механизм обхода толерантности аутореактивных Тх-клеток - это непосредственная активация аутореактивных эффекторных клеток антигеном или каким-то иным стимулятором. Например, липополиеахарид и вирус Эпштейна—Барр непосредственно стимулируют В-клетки и некоторые клоны этих клеток начинают продуцировать аутоантитела, хотя в отсутствие помощи со стороны Т-клеток титр и аффинность этих антител, как правило, остаются низкими.
Аутоиммунный процесс может быть результатом нарушений в цитокиновой сети регуляции, следствием неадекватной экспрессии МНС и недостаточной супрессии. Нарушения в регуляторной цитокиновой сети, очевидно, также могут приводить к активации аутореактивных Т-клеток. Один из подтверждающих это экспериментов состоит во введении трансгена γ-интерферона (ИФγ) в β-клетки островков поджелудочной железы. При полной экспрессии введенного трансгена в этих клетках усиливается транскрипция генов МНС класса II, что приводит к аутоиммунной деструкции островковых клеток (рис. 28.20). Это не просто результат неспецифической, хаотической воспалительной реакции, индуцируемой ИФγ, поскольку в таких случаях происходит отторжение и тех интактных островков, которые пересажены в другой участок тела. т. е. явно появляется Т-клеточная аутореактивность но отношению к антигенам поджелудочной железы.
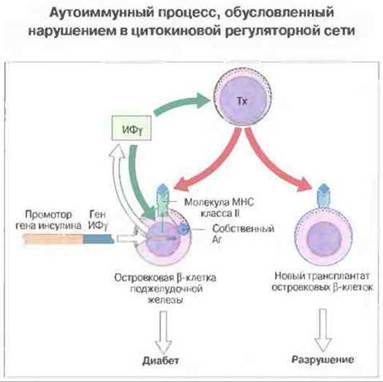
Рис. 28.20. Введение трансгена, состоящего из гена ИФγ и промотора гена инсулина, приводит к интенсивной экспрессии и секреции ИФγ клетками поджелудочной железы. В результате на поверхности этих клеток возрастает количество молекул МНС класса И (повышающая регуляция) и посредством пока невыясненного механизма, но, возможно, с участием «профессиональных» АПК активируются аутореактивные Т-клетки. Гримированные Т-клетки инициируют аутоиммунное разрушение β-клеток. О том, что в данном случае действительно имеет место аутоагрессия, свидетельствует быстрое разрушение новых трансплантатов интактных сингенных (генетически идентичных клеткам, не содержащим трансгена) островковых клеток. (Аг - антиген.)
Экспрессии молекул МНС класса II на поверхности клеток самой по себе недостаточно для активации непримированных аутореактивных Т-клеток, но она может быть необходимой для того, чтобы клетка стала мишенью для примированных аутореактивных Тх-клеток. Поэтому данные о том, что клетки щитовидной железы при тиреотоксикозе активно синтезируют молекулы МНС класса II (рис. 28.21) и тем самым приобретают способность распознаваться Т-клетками CD4+, привлекли большое внимание. Интересно, что у животных ряда предрасположенных к аутоиммунным заболеваниям линий ИФγ легче индуцирует экспрессию молекул МНС класса II на клетках-мишенях, чем у животных невосприимчивых линий.
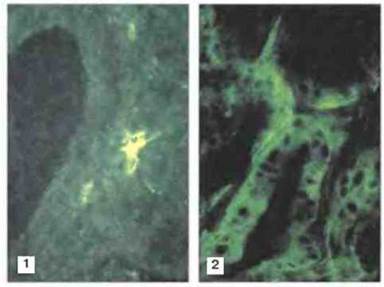
Рис. 28.21. Срезы щитовидной железы человека, окрашенные на молекулы МНС класса II. 1. Нормальная щитовидная железа с неокрашенными фолликулярными клетками и одиночной дендритной клеткой, на которой обильно присутствуют молекулы МНС класса II 2. Щитовидная железа больного тиреотоксикозом (болезнь Грейвса) с обильным содержанием молекул МНС класса II в цитоплазме клеток, которое указывает на активный синтез этих молекул.
Дальнейшим подтверждением того, что нарушение баланса цитокинов может служить причиной аутоиммунных реакций, стало неожиданное наблюдение: фактор некроза опухолей (синтезируемый в результате введения животному трансгена ФНО) смягчает проявления аутоиммунного процесса у гибридных мышей NZB/NZW.
Аутотолерантность в норме может быть обусловлена не только «игнорированием» скрытых аутоэпитопов, но и активностью Тс-клеток, а также супрессивным действием гормонов (например, стероидов), цитокинов (например, ТФРβ) и продуктов макрофагов (рис. 28.22). При недостаточности любою из этих факторов может возрастать подверженность аутоиммунным заболеваниям. Особый интерес представляет обратная связь между гипофизарно-адреналовой системой, с одной стороны, и Т-хелперами и макрофагами, с другой, поскольку нарушение различных звеньев этой связи приводит к развитию многих аутоиммунных заболеваний (рис. 28.23). У больных ревматоидным артритом, например, снижен уровень кортикостероидов, а после хирургической операции, несмотря на резкое повышение продукции ИЛ-1 и ИЛ-6, ожидаемого выброса АКТГ и кортикостероидов не происходит (из-за нарушения функции паравентрикулярного ядра гипоталамуса). У внешне здоровых родственников больных СКВ (как и у самих больных) нарушено образование неспецифических Тс-клеток, что может играть роль в патогенезе заболевания. Для возникновения аутоиммунной реакции должен быть, вероятно, нарушен не один, а несколько элементов супрессорной сети, и у больных СКВ нарушена также функция либо антиген-, либо идиотипспецифических регуляторных Т-клеток. Субпопуляция регуляторных клеток CD4+, присутствующая у молодых здоровых мышей линии NOD, может предотвращать перенос заболевания при пересадке спленоцитов от животных с диабетом мышам NOD с тяжелым комбинированным иммунодефицитом; у взрослых мышей эта субпопуляция регуляторных клеток исчезает.
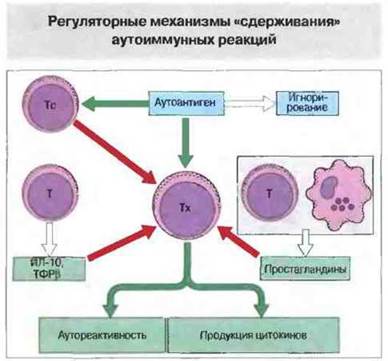
Рис. 28.22. В норме аутореактивные Тх-клетки не стимулируются скрытыми аутоэпитопами («игнорирование»), но все же на случай их активации существует система супрессивного контроля, включающая в частности антигенспецифическую супрессию со стороны Т-клеток, либо прямую (Тс), либо посредством супрессивных цитокинов, таких как ИЛ-10 и ТФРβ. Реактивность Тх-клеток ограничена также неспецифической супрессией (опосредуемой, например, простагландинами). При возрастании реактивности Тх-клеток (например, при повышении количества рецепторов к ИЛ-2), а также при нарушении супрессивных влияний повышается вероятность возникновения аутоиммунных заболеваний.
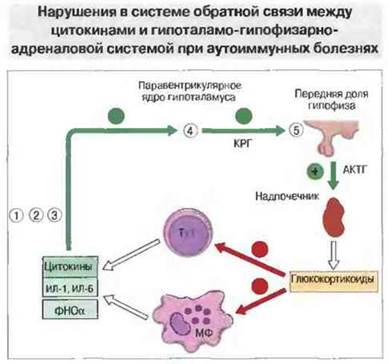
Рис. 28.23. У мышей линии NOD (1) и предрасположенных к диабету крыс линии ВВ (2) нарушена продукция ИЛ-1; введением этого цитокина можно ослабить проявления болезни. То же самое имеет место в отношении продукции ФНОα у мышей NZBxW с волчанкой (3). У больных ревматоидным артритом ослаблена гипоталамическая реакция на ИЛ-1 и ИЛ-6 (4). У кур линии OS и крыс линии Lewis нарушена гипоталамо-гипофизарная ось и при введении адъюванта Фрейнда развивается аутоиммунное заболевание (5). (КРГ - кортикотропин-ризилинг-гормон; МФ - макрофаг.)
Предшествующие нарушения в органах-мишенях могут повышать подверженность аутоиммунным заболеваниям. Как отмечено выше, у животных, предрасположенных к некоторым аутоиммунным заболеваниям, ИФγ особенно легко индуцирует появление молекул МНС класса И на клочках органов-мишеней. Имеются и другие подтверждения того, что вероятность аутоиммунного заболевания повышена в случае дефекта в органе-мишени. Так, у кур линии OS (со спонтанным аутоиммунным поражением щитовидной железы) поглощение иода щитовидной железой в условиях подавления секреции эндогенного ТТГ тироксином остается гораздо выше, чем у кур обычных линий. Это не связано с какими-либо аутоиммунными механизмами, поскольку иммуносупрессия еще больше повышает поглощение иода (рис. 28.24). Примечателен тот факт, что у кур линии Cornell (от которых путем скрещивания получена линия OS) поглощение иода повышено в еще большей степени, но спонтанный тиреоидит у них не развивается. Это указывает на возможность какой-то аномалии в щитовидной железе у кур OS, хотя и недостаточной для индукции аутоиммунного заболевания, но все же играющей определенную роль в предрасположенности к нему. Действительно, путем переноса лимфоидных клеток от взрослых кур линии OS(с поражением щитовидной железы) удавалось воспроизвести тиреоидит у молодых кур той же линии или линии Cornell, но не у птиц других гистосовместимых линий, не имеющих исходного нарушения, с которым связана предрасположенность линий OS и Cornell к аутоиммунному заболеванию. Другими примерами болезней, при которых нарушена продукция аутоантнгенов, могут служить диабет (при этом заболевании один из генетических факторов риска связан с микросателлитным маркером внутри гена транскрипционного фактора, контролирующего скорость синтеза инсулина) и ревматоидный артрит (при нем сыворотка в избытке содержит агалакто-гликоформу IgG). Здесь необходимо вновь подчеркнуть, что формирование хронического аутоиммунного процесса зависит от целого ряда факторов.
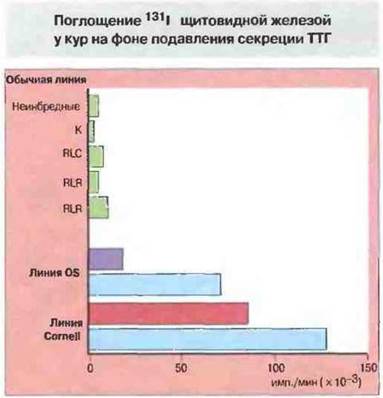
Рис. 28.24. Поглощение 131I щитовидной железой кур линии OS и родственной ей линии Cornell резко повышено по сравнению с уровнем поглощения у кур обычных линий. В данном опыте продукция эндогенного ТТГ (тиреотропный гормон) была подавлена введением тироксина, что позволяло определять независимое от ТТГ поглощение 131I. Гораздо более высокое, чем в норме, поглощение имело место у кур линии OS, для которых характерно спонтанное развитие аутоиммунного поражения щитовидной железы, и еще большее - у кур линии Cornell, родоначальной для линии OS, но не подверженной аутоиммунному заболеванию. О том, что в основе этой аномалии лежат не иммунологические, а иные механизмы, свидетельствует тот факт, что иммуносупрессия (синие полосы) не только не снижала, но даже повышала поглощение 131I щитовидной железой.