ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 29. Иммунологические методы
МЕТОДЫ ОПРЕДЕЛЕНИЯ ЭФФЕКТОРНЫХ КЛЕТОК
Разработаны различные методы для определения эффекторных функций лимфоцитов, в частности продукции антител, цитотоксичности и опосредованной Т-клетками помощи и супрессии.
В-клетки, продуцирующие IgM- или IgG-антитела, можно определить при помощи метода локального гемолиза, или реакции бляшкообразования (рис. 29.23). Другим способом выявления антителообразуюших клеток служит иммуноферментный тест ELISPOT (рис. 29.24). Он позволяет определять функционально активные Т-клетки, декретирующие те или иные растворимые медиаторы, т. е. цитокины. Определение проводят на подложке с иммобилизованными антителами к специфическому цитокину (например, анти-ИФ). Эти антитела связывают данный цитокин, выделяемый Т-клеткой в окружающую зону, и эффект связывания можно выявить путем соответствующей обработки подложки: вокруг цитокин-выделяющих Т-клеток будут видны окрашенные пятнышки.
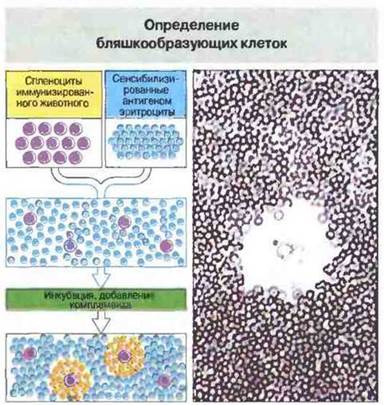
Рис. 29.23. Для определения антителообразующих клеток методом локального гемолиза, или бляшкообразования, к исследуемой клеточной популяции добавляют эритроциты, сенсибилизированные антигеном. При последующей инкубации эритроциты, окружающие антителообразующую клетку, связывают секретируемые ею специфические антитела и в результате лизируются комплементом. Вид образующейся при этом зоны просветления - бляшки - с В-клеткой в центре показан справа. Локальный гемолиз может быть двух типов.
Прямой локальный гемолиз: антигенспецифичные IgM-антитела, продуцируемые антителообразующей клеткой, способны непосредственно вызывать комплемент-зависимый гемолиз, поскольку эти антитела обладают высокой комплементсвязывающей активностью.
Непрямой локальный гемолиз: антигенспецифичные IgG-антитела связывают комплемент не столь эффективно, и чтобы усилить способность IgG-продуцирующих клеток лизировать эритроциты-мишени, требуется добавление антител анти-IgG.
Сочетая тесты прямого и непрямого локального гемолиза, можно раздельно определять число IgM- и IgG-образующих клеток.
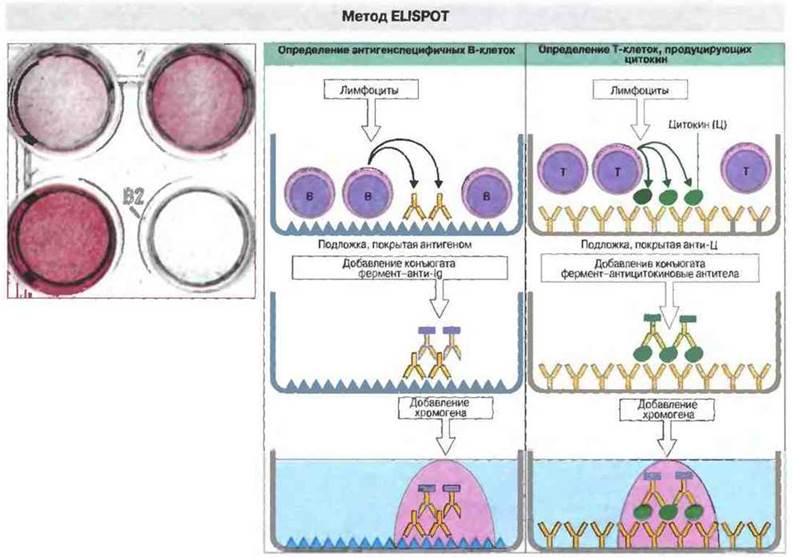
Рис. 29.24. Для определения отдельных В-клеток, продуцирующих специфические антитела, или индивидуальных Т-клеток, секретирующих те или иные цитокины, применяют метод EUSPOT - иммуноферментный тест с локальным связыванием. Чтобы выявить антителообразующие клетки, лимфоциты наносят на сенсибилизированную антигеном подложку. Секретируемые специфические антитела связываются с антигеном в непосредственной близости к продуцирующей их клетке. Места связывания (пятнышки — англ. spots) выявляют хроматографически с использованием конъюгированных с ферментом антител анти-lg и хромогена. Если нужно идентифицировать клетки, продуцирующие цитокины, на подложке иммобилизуют антицитокиновые антитела и определяют связывание их с цитокином при помощи конъюгированных с ферментом антител к другому эпитопу цитокина. Вид обработанной таким образом подложки показан вверху слева. (Фотография любезно предоставлена Р. Hutchings и издательством Blackwell Scientific Publications.)
Для определения антигенспецифичных Т-клеток часто используют тест стимуляции лимфоцитов — пролиферативный ответ Т-клеток на антиген, выявляемый по включению ими 3Н-тимидина (рис. 29.25). Цитотоксическую активность клеточных популяций обычно определяют по их способности лизировать клетки-мишени (например, инфицированные вирусами, опухолевые или аллогенные клетки). Количественно лизис клеток-мишеней определяют при помощи теста с высвобождением меченого хрома (рис. 29.26).
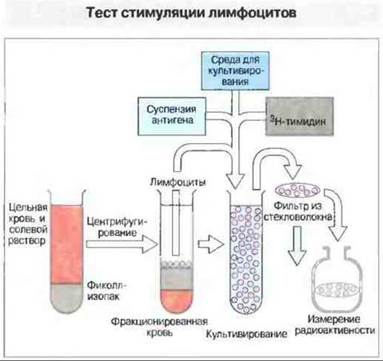
Рис. 29.25. При постановке реакции стимуляции лимфоцитов цельную кровь, разведенную солевым раствором, наслаивают на фиколл-изопак (плотность которого выше, чем у лимфоцитов, но меньше, чем у лейкоцитов) и центрифугируют (400 g). Таким образом отделяют лимфоциты от других клеток и компонентов сыворотки (см. рис. 29.19). Полученные клетки отмывают от загрязнений (включая антигены) и переносят в тест- пробирки со средой для культивирования, содержащей антиген. За 16 ч до сбора клеток в культуру добавляют 3Н-тимидин. Собирают клетки на фильтрах - дисках из стекловолокна - и измеряют радиоактивность на жидкостном сцинтилляционном счетчике. Высокий уровень радиоактивности свидетельствует о том, что клетки пролиферируют, т. е. отвечают на данный антиген Эту реакцию используют также для анализа клеток лимфоидных тканей.
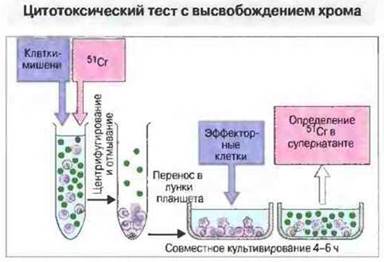
Рис. 29.26. Чтобы определить цитотоксичность эффекторных клеток, инкубируют клетки-мишени с изотопом 51Сr, который проникает внутрь клеток и связывается с белками. По окончании инкубации удаляют свободный 51Сr отмыванием, вносят клетки-мишени в лунки планшета и культивируют совместно с эффекторными клетками в течение 4-16 ч, после чего определяют в культуральной жидкости количество хрома, вышедшего в среду в результате лизирования клеток-мишеней эффекторными клетками.
Миграция лимфоцитов
В экспериментах по изучению миграции лимфоцитов in vivo обычно исследуют распределение в тех или иных тканях введенных внутривенно меченых клеток. Клетки метят либо радиоизотопами, либо стабильными флуорохромами. Радиоактивную метку применяют для количественной опенки клеточной миграции. Локализацию меченых клеток в органе можно установить радиоавтографически или путем флуоресцентной микроскопии.
Определение молекул адгезии, участвующих в миграции лимфоцитов, проводят в большинстве случаев in vitro. В тесте Стэмпера—Вудруфа (Stamper—Woodroofe) определяют непосредственно адгезию лимфоцитов к стенкам венул с высоким эндотелием на срезах лимфоузлов, пейеровых бляшек или других тканей, содержащих такие венулы. Число адгезированных клеток подсчитывают под микроскопом. Если добавление антител против молекул межклеточной адгезии снижает уровень адгезии, это служит доказательством, что они взаимодействуют в участках, близких к активным центрам данных молекул. Другим способом выявления молекул адгезии может быть блокирование in vitro адгезии лимфоцитов к монослою эндотелиальных клеток. В этом случае, чтобы убедиться в присутствии молекул адгезии, метят лимфоциты или эндотелиальные клетки и используют блокирующие адге зию антитела для иммунопреципитации специфических молекул адгезии.