ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 29. Иммунологические методы
ВЫДЕЛЕНИЕ ПОПУЛЯЦИЙ ЛИМФОЦИТОВ
Для проведения многих иммунологических исследований in vivo и in vitro требуются те или иные популяции лимфоцитов. Их получают от экспериментальных животных, в основном из тимуса, селезенки и периферических лимфоузлов. Некоторые специальные исследования требуют выделения клеток из других участков организма, например и з пейеровых бляшек. Рециркулирующие клетки можно получить путем канюлирования грудного лимфатического протока и сбора клеток в течение нескольких часов. У человека наиболее легко выделить лимфоциты периферической крови, а хирургическим путем можно получить также клетки селезенки, ми н дат и н и лимфоузлов. Однако хирургически отобранный материал часто содержит инфекционные агенты или опухолевые клетки, в зависимости от заболевания, которое вызвало необходимость хирургического вмешательства. Следует иметь в виду, что клеточные популяции, содержащиеся в перечисленных тканях, совершенно различны как но степени зрелости лимфоцитов, так и по численному соотношению в них клеток разных типов.
Тимус является источником довольно чистой Т-клеточной популяции, однако составляющие ее лимфоциты различаются по степени зрелости. При работе с лимфоцитами из других органов и тканей часто возникает необходимость в выделении отдельных субпопуляций для анализа их особых функций. Применение с этом целью описанного выше проточного флуоресцентного клеточного сортера, позволяющего разделять лимфоциты но их поверхностным маркерам, позволяет получать лишь ограниченное число клеток, поскольку скорость цитометрии с сортировкой весьма низка. Существует, однако, и ряд методов, позволяющих выделять лимфоциты и их отдельные субпопуляции сразу из всего объема исследуемого образца, - центрифугирование в градиенте плотности, розеткообразование, пэннинг и магнитное разделение.
Выделение в градиенте плотности основано на том, что лимфоциты имеют меньшую плотность, чем эритроциты и гранулоциты (рис. 29.19). Этот способ позволяет выделять большую часть лимфоцитов крови. Розеткообразование и пэннинг («просеивание» через подложку) используют для выделения субпопуляций (рис. 29.20 и 29.21). Пэннинг представляет собой разновидность аффинной хроматографии применительно к лимфоцитам. На сходном принципе основан и способ разделения с помощью магнитных гранул, покрытых специфическими антителами (например, анти-СD4). При смешивании с клетками гранулы связывают тс из них, которые распознаются фиксированными антителами. Эти клетки можно затем смыть с гранул или выделить путем наложения магнитного поля.
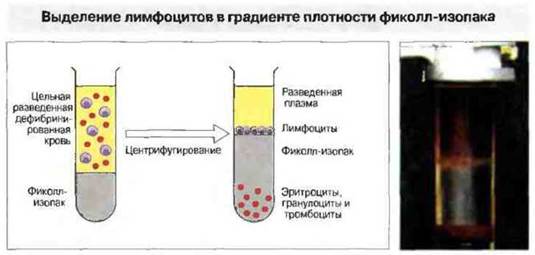
Рис. 29.19. Лимфоциты можно выделить из цельной крови в градиенте плотности фиколла. Для этого кровь дефибринируют путем встряхивания со стеклянными бусами и образовавшийся сгусток удаляют. Затем кровь разводят культуральной средой и наслаивают на раствор фиколла, заполняющий пробирку до половины. Плотность фиколла выше, чем плотность лимфоцитов, но ниже, чем плотность эритроцитов и гранулоцитов (например, нейтрофилов). После центрифугирования эритроциты и полиморфноядерные нейтрофилы (ПЯН), прошедшие через фиколл, образуют на дне пробирки осадок в виде пуговки, тогда как лимфоциты остаются на границе между средой, в которой они взвешены, и фиколлом. Препарат лимфоцитов освобождают затем от макрофагов и оставшихся ПЯН, добавляя в него железные опилки, они фагоцитируются, и поглотившие их фагоциты можно удалить при помощи сильного магнита. Макрофаги могут быть удалены и другим способом: клеточную суспензию помещают в пластиковую чашку; макрофаги прилипают к поверхности пластика и в суспензии остаются только лимфоциты.
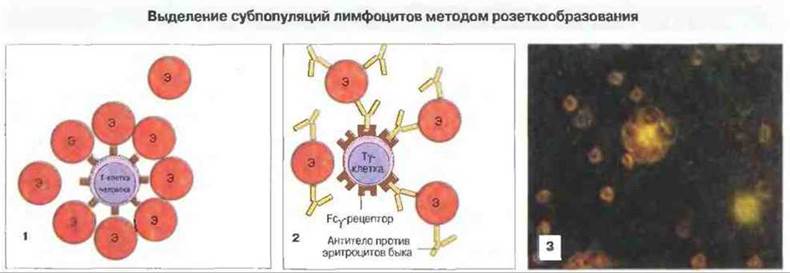
Рис. 29.20. Метод розеткообразования основан на том, что лимфоциты некоторых субпопуляций несут рецепторы, связывающиеся с эритроцитами. Т-клетки человека имеют рецепторы для эритроцитов барана (Э) - молекулы CD2 (1). На Т-клетках мыши число таких рецепторов невелико, поэтому Т-лимфоциты мыши изолировать подобным способом невозможно. При смешивании Т-клетки вместе с эритроцитами образуют «розетки», которые могут быть отделены от неспособных к розеткообразованию В-клеток в градиенте плотности фиколла. Существует также модификация этого метода, позволяющая выделять клетки с другими рецепторами (2). Например. Тγ-лимфоциты (Т-клетки, несущие рецептор для Fc-фрагмента IgG, Fcγ) можно идентифицировать и выделить методом розеткообразования с эритроцитами быка, сенсибилизированными субагглютинирующим количеством антител к этим эритроцитам. На микрофотографии (3) виден лимфоцит, образовавший розетку с эритроцитами. (Фото любезно предоставлено д-ром Р. М. Lydyard).
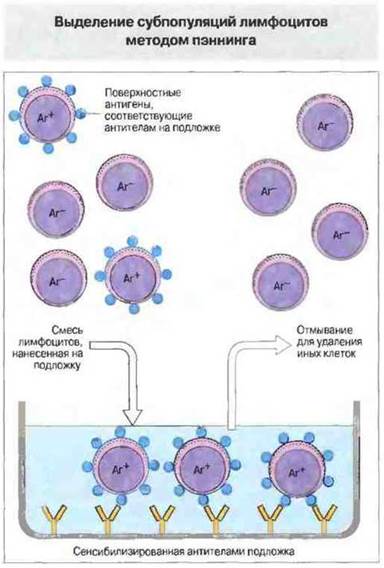
Рис. 29.21. Клеточные популяции можно разделять на подложках, сенсибилизированных антителами. Нанесенные на подложку антитела нековалентно связываются с поверхностью пластика (как при иммуносорбентном анализе), после чего на нее наносят суспензию клеток. Антиген-положительные клетки (Аг+) связываются с антителами, тогда как антиген-отрицательные (Аг+) можно удалить осторожным смыванием. Связанные клетки иногда удается отделить от подложки, изменив условия культивирования или обработав клетки ферментами. Часто связывание клеток с иммобилизованным антигеном вызывает в них те или иные изменения; например, при связывании антигена с пластиком могут возникать перекрестные связи между его молекулами, в результате чего он активирует клетки. Данный метод наиболее подходит для удаления субпопуляций, а не для их выделения из общей популяции лимфоцитов. В качестве примеров применения данного метода можно назвать разделение популяций Тх- и Тц-клеток при помощи антител анти-СD4 или анти-CD8 и отделение Т-клеток от В-лимфоцитов с использованием антител анти-lg (которые связываются с поверхностными антителами В-клеток). При обратной постановке (сенсибилизация подложки антигеном) связывающие антиген клетки можно отделять от несвязывающих.
Другой способ — он применяется для удаления ненужной клеточной популяции, — основан на использовании антител и комплемента. Если к смеси клеток добавить специфические антитела (например, анти-CDS), а затем комплемент, клетки соответствующей субпопуляции будут лизированы. Конечно, для этого метода пригодны лишь такие антитела, которые связывают комплемент; кроме того, клетки-мишени должны нести на поверхности достаточное количество молекул антигена, чтобы фиксировать литическую дозу комплемента.
Источником определенных популяций лимфоцитов могут служить антигенспецифичные Т-клеточные линии, культивируемые в течение длительного периода (рис. 29.22). Получение таких линий позволяет обойтись без частого выделения первичных культур из органов и тканей животных.
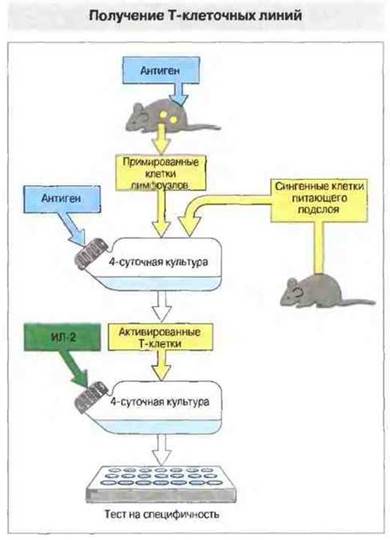
Рис. 29.22. Одна из возможных процедур получения Т-клеточных линий. Мышей примируют антигеном, вводя его обычно под кожу на подошвенной стороне задней лапки. Через неделю у животных удаляют дренирующие эту область лимфоузлы (в данном случае подколенные и паховые), и полученные из них клетки культивируют в присутствии антигена на питающем подслое из сингенных (т. е. от мышей той же инбредной линии) клеток, например нормальных лимфоцитов или спленоцитов. Через 4 сут из культуры выделяют лимфобласты и индуцируют их пролиферацию с помощью ИЛ-2. Когда число клеток достаточно возрастет, проверяют их МНС- и антигенспецифичность в реакции трансформации лимфоцитов, Полученную линию культивируют попеременно на питающем подслое из клеток, стимулированных антигеном, и в ИЛ-2-содержащей среде.