ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 4. Комплемент
■ Система комплемента - это одна иэ основных систем врожденного иммунитета, функция которой состоит в том, чтобы отличать «свое» от «не-своего». Такая дифференциация осуществляется благодаря присутствию на собственных клетках организма регуляторных молекул, подавляющих активацию комплемента.
■ Существует два главных пути (механизма) активации комплемента - классический и альтернативный. При классической активации происходит связывание иммунных комплексов с Clq, что соединяет приобретенный иммунитет (антитела) с врожденным (комплемент).
■ В плазме крови постоянно происходит «холостая» активация С3, приводящая к фиксации небольшого числа его молекул на поверхности как «своего», так и «не-своего». На поверхности собственных клеток регуляторные белки вызывают разрушение связавшихся молекул С3 и подавляют дальнейшую активацию комплемента. На чужеродных структурах, лишенных регуляторных белков, напротив, начинается альтернативная активация комплемента.
■ Наличие внутренней тиоэфирной связи в белках С3 и С4 позволяет им ковалентно взаимодействовать с гидрокси- и аминогруппами других молекул. Образование этой связи составляет ключевой момент локальной активации комплемента в очагах воспаления.
■ При активации комплемента действуют два механизма усиления. Первый известен как «запуск ферментного каскада». «Пусковым сигналом» служит связывание небольшого числа молекул C1q, вызывающее затем последовательную активацию ряда зимогенов (проферментов), которые расщепляют уже значительно большее число молекул С3.
■ Второй механизм усиления - это действующая по принципу положительной обратной связи «петля усиления». Расщепление небольшого количества молекул С3 с образованием С3bспособствует появлению фермента С3-конвертазы, который расщепляет гораздо больше С3. На собственных клетках организма имеются молекулы, подавляющие действие этой петли усиления путем расщепления С3b на неактивные продукты. На чужеродных структурах действие «петли усиления» не встречает препятствий.
■ Эффекторные механизмы системы комплемента делятся на пять групп в зависимости от функции: 1) опсонизация микробов для поглощения их фагоцитами: 2) непосредственное уничтожение микроорганизмов путем лизиса; 3) активация и хемотаксическое привлечение лейкоцитов в очаг воспаления; 4) процессинг (специфическое расщепление) иммунных комплексов; 5) индукция специфических антител путем, во-первых, усиленной локализации антигенов на поверхности В-лимфоцитов и антигенпрезентирующих клеток и, во-вторых, снижения порога активации В-лимфоцитов.
■ Патогенные микробы вырабатывают механизмы, позволяющие им избежать уничтожения системой комплемента, а в некоторых случаях даже использовать ее для усиления своей патогенности.
■ Система комплемента может участвовать в патогенезе заболевания, если происходит ее генерализованная активация in vivo или активация на собственных тканях в результате связывания комплемента аутоантителами.
ВВЕДЕНИЕ
Термин «комплемент» первоначально применил Эрлих для описания «дополнительной», присутствующей в сыворотке активности, без которой специфичные антитела не могут лизировать бактерии. Открытие этой термолабильной активности в сыворотке крови обычно приписывают Борде (1895), хотя нечто подобное несколькими годами раньше описал Натголл. В 1907 г. Феррата, диализуя сыворотку против подкисленной воды, установил, что белки комплемента можно разделить на две фракции: выпадающие в осадок эуглобулины и водорастворимую альбуминовую фракцию (псевдоглобулины). Активность комплемента проявлялась только в присутствии обеих фракций, названных тогда средней и концевой частями, а позднее — С'1 и С'2 компонентами. В последующем Сакс и Омороков обнаружили, что яд кобры инактивирует другой компонент комплемента (С'3), а Гордон установил, что следующий компонент (С'4) разрушается аммиаком. Последовательность открытия перечисленных компонентов комплемента не соответствует очередности их вступления в реакцию активации системы, и этим объясняется кажущаяся нелогичность ее современной номенклатуры.
Сложная номенклатура системы комплемента
Белки классического пути активации и лизирующего мембрану комплекса обозначены каждый своим номером и вступают в реакцию активации в следующем порядке: C1q, С1r, C1s, С4, С2, С3, С5, С6, С7, С8, С9. Среди них много предшественников ферментов — проферментов, которые приобретают активность только после расщепления. Обозначение активною фермента отличается от обозначения его неактивного предшественника надбуквенной чертой, например С1r. Продукты расщепления обозначаются гак же, как исходные компоненты комплемента, но с добавлением строчных букв - обычно для меньшего фрагмента - «а», а для большего — «b», например С3а и С3b. Из этого правила имеется одно исключение: С2b означает меньший, а С2а — больший фрагмент С2.
Белки альтернативного пути активации называют факторами и обозначают однобуквенными символами. В тексте слово фактор обычно сокращается до первой буквы F или вовсе опускается, и в результате фактор В может быть обозначен аббревиатурой FB или просто В. Регуляторные белки чаше всего обозначают аббревиатурами названий их функциональной активности: например, белок, ускоряющий диссоциацию С3-конвертазы классического пути, имеет символ DAF (decay accelerating factor), или, по-русски, ФУД (фактор ускорения диссоциации).
Клеточные рецепторы, связывающие компоненты комплемента, названы по аббревиатурам своих лигандов (например, С5а-рецептор) или как маркерные молекулы в номенклатуре CD-системы. Отдельно пронумерованы рецепторы для главных фрагментов С3 как рецепторы комплемента типов 1, 2, 3 и 4 (CR1, CR2, CR3 и CR4). К сожалению, в результате этого некоторые рецепторы в современной литературе имеют по три синонима, например С3b-рецептор = CR1 = CD35.
Белки системы комплемента относятся к различным суперсемействам
Белки, объединенные в одно суперсемейство — например иммуноглобулинов (см. гл. 6) - имеют много общих структурных и функциональных свойств. В систему комплемента входят белки, относящиеся к нескольким суперсемействам.
Классификация белков комплемента по суперсемействам позволяет лучше понять их структурные и функциональные взаимосвязи. Поясним это на примере суперсемейства регуляторных белков комплемента, называемых также регуляторами активации комплемента. К ним относятся:
✵ фактор Н — белок плазмы крови с молекулой удлиненной конфигурации;
✵ С4-связываюший белок [Cd-bp (binding protein)] — гептамерный белок плазмы, молекула которого имеет паукообразную форму;
✵ фактор, ускоряющий диссоциацию С3-конвертазы (ФУД, CD55), — белок клеточной мембраны, закрепленный в ней на своеобразной гликофосфолипидпой «ножке»;
✵ мембранный кофакторный белок (МКБ, CD46) — трансмембранный белок, действующий как кофактор расщепления С3b:
✵ рецепторы комплемента I типа (CR1, CD35) и 2 типа (CR2, CD21) — клеточные рецепторы, имеющие трансмембранные домены.
Семейство регуляторных белков комплемента кодирует группа тесно сцепленных генов, расположенных в хромосоме I. При очевидных различиях структуры все эти белки содержат одинаковый домен, состоящий примерно из 60 аминокислотных остатков и названный коротким общим повтором. Этот домен может много раз встречаться в структуре каждой молекулы, образуя ее каркас и, возможно, определяя специфичность связывания. Синтез этих белков кодируют гомологичные, тандемно расположенные экзоны.
Составляющие это семейство шесть белков выполняют также ряд общих функций в активации комплемента: фактор Н, С4-Ьр, ФУД, МКБ и CR1 подавляют образование комплексов С4b2а и С3bВb, т. е. С3-конвертаз классического и альтернативного путей активации. Некоторые из этих белков имеют и другие общие функции, но не идентичные, а лишь частично перекрывающиеся. Такие функции включают: подавление связывания С2 с С4b и фактора В с С3b, индукцию диссоциации С2а от С4b и Вb от С3b, действие в качестве кофакторов фактора I — фермента, ответственного за катаболизм С3b и С4b.
Следует отмстить, что короткие общие повторы имеются и в других белках, которые, однако, не взаимодействуют с белками комплемента; это рецептор для ИЛ-2, р2-гликопротсин I и фактор XIII системы свертывания крови.
Структура большинства белков комплемента «мозаична». Молекулярная основа родства белков внутри разных семейств становится яснее благодаря клонированию их генов. По современным представлениям, в ходе эволюции происходила многократная дупликация экзонов и их «перетасовка» между различными генами. Находясь одновременно в составе разных генов, эти дуплицированные сегменты ДНК эволюционировали параллельно и во многих случаях сохранили сходные последовательность и функцию, хотя в ряде случаев активность утрачена или приобретена новая.
Многие белки комплемента представляют собой «мозаику» из продуктов экзонов, относящихся к генам разных суперсемейств. Так, Cls, фермент классического пути, содержит участки аминокислотной последовательности из сериновой эстеразы и рецептора для липопротеинов низкой плотности, а также короткий общий повтор, встречающийся в суперсемействе регуляторных белков комплемента. Точно гак же, С6, С7, С8 и С9 — компоненты лизирующего мембрану комплекса имеют общие свойства с перфорином цитотоксических Т-лимфоцитов и катионным белком эозинофилов.
Активация комплемента - один из главных эффекторных механизмов воспаления
Система комплемента относится к факторам врожденного иммунитета и включает в себя ряд белков, действующих последовательно, т. е. каскадом, в котором каждый фермент катализирует активность следующего. Наиболее важный компонент комплемента — это С3, присутствующий в плазме крови в той же концентрации (1-2 мг/мл), что и некоторые иммуноглобулины.
Два главных пути активации комплемента отражают особенности его участия в реакциях врожденного и приобретенного иммунитета. Классический путь связан с приобретенным иммунитетом, поскольку белок Clq взаимодействует с антителами, образовавшими комплекс с антигеном. Альтернативный путь активации комплемента относится к механизмам врожденного иммунитета, начинаясь иммунонеспецифическим связыванием С3b с поверхностью микроорганизма.
Активность отдельных компонентов комплемента in vivo можно проиллюстрировать на примерах расстройств, вызванных недостаточностью этих белков (см. гл. 21). У таких больных наблюдается повышенная восприимчивость к рецидивирующим гнойным бактериальным инфекциям, а также к заболеваниям, для которых характерно повышенное образование аутоантител и иммунных комплексов. Эти наблюдения свидетельствуют о необходимости комплемента как для антибактериальной защиты, так и для устранения иммунных комплексов, которые иначе способны вызывать аутоиммунные заболевания и болезни иммунных комплексов (см. гл. 25).
В результате активации комплемента при воспалении происходят:
✵ опсонизация микроорганизмов и иммунных комплексов;
✵ активация лейкоцитов;
✵ лизис клеток-мишеней (рис. 4.1).
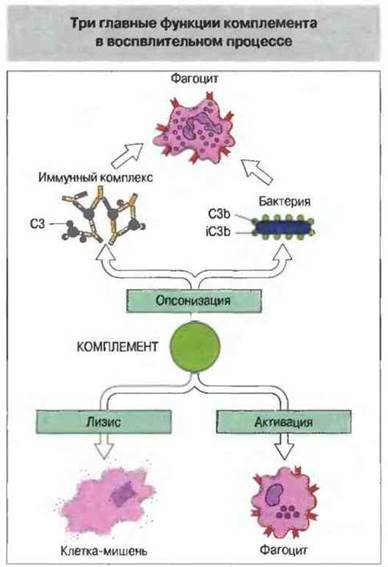
Рис. 4.1. 1. Опсонизация («одевание») комплементом микроорганизмов и иммунных комплексов для их распознавания клетками, экспрессирующими рецепторы комплемента. 2. Лизис клеток-мишеней. 3. Активация фагоцитов, включая макрофаги и нейтрофилы.
Опсонизация. Это стимуляция фагоцитоза в результате прикрепления белков комплемента к поверхности мишеней (микробов, иммунных комплексов и др.). Обладая рецепторами к опсонизируюшим белкам, фагоцитарные клетки связывают мишени, что вызывает активацию фагоцитов и эндоцитоз или фагоцитоз мишеней.
Активация лейкоцитов. Полиморфноядерные гpaнулоциты и макрофаги обладают специфическими рецепторами к мелким фрагментам белков комплемента, образующимся на поверхности мишеней в результате каскада протеолитических реакций. Диффундируя в окружающую среду, эти фрагменты привлекают фагоциты (направленное движение клеток, или хемотаксис) и, связываясь с ними, вызывают их активацию.
Лизис клеток-мишеней. Протеолитический каскад комплемента завершается погружением гидрофобного «зонда» в липидный бислой мембраны клетки-мишени и ее последующим осмотическим разрывом и лизисом.
Комплемент способен отличать «свое» от «не-своего». Относясь к факторам врожденного иммунитета, комплемент реализует механизмы, позволяющие отличать «свое» от «не-своего». Ключевой момент этой функции заключается в немедленном связывании С3b со всеми чужеродными объектами, будь то микроорганизмы или иммунные комплексы; поверхность собственных клеток организма защищена особыми молекулами, которые весьма эффективно ограничивают отложение С3b.