ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 6. Антитела и клеточные рецепторы для них
КЛЕТОЧНЫЕ РЕЦЕПТОРЫ ДЛЯ АНТИТЕЛ
Существует три типа рецепторов клеточной поверхности для IgG
Клеточные рецепторы для IgG опосредуют ряд эффекторных функций антител. Перекрестная сшивка антигеном антител Ig, связанных с рецепторами, инициирует ту или иную биологическую активность клетки, причем разные рецепторы могут индуцировать одни и те же активности, среди которых главные - фагоцитоз, зависимая от антител клеточная цитотоксичность, высвобождение медиаторов и презентация антигена.
На поверхности клеток выявлены к настоящему времени три группы рецепторов IgG человека: FcγRI (CD64), FcγRII (CD32) и FcγRIII (CD16). Все они имеют внеклеточные домены, в значительной степени гомологичные V-областям иммуноглобулинов, т. е. относятся к иммуноглобулиновому суперсемейству молекул, как и специфичный для IgA рецептор FcαR.
Свойства и распределение рецепторов для IgG. Рецептор FcγRI (CD64) на клетках человека связываете высоким сродством (108—109 М-1) мономерный IgG и имеет более ограниченное распространение, чем другие рецепторы.
Рецептор FcγRII (CD32) экспрессируют очень многие клетки, часто как единственный рецептор Ig. Он связывает с низким сродством (<107 М-1) IgG, причем только в составе иммунных комплексов или агрегатов.
Рецептор FcγRIII (CD16) обильно гликозилирован и экспрессируется в формах с мол. массой от 50 до 80 кДа. В форме FcγRIIIа его экспрессируют макрофаги. НК-клетки и некоторые Т-клетки; эта форма связывает мономерный, а также включенный в иммунный комплекс IgG с аффинностью 3 х 107 М-1. В форме FcγRIIIb, связанной с клеточной мембраной посредством GPI(фосфатидилинозитолгликан), этот рецептор экспрессируют только гранулоциты; FcγRIIIb связывает IgG с низким сродством (<107 М-1).
Дополнительное разнообразие клеточных рецепторов для IgG. Три типа Fcγ-рецепторов встречаются в 12 различных изоформах, и, кроме того, описан генетический полиморфизм для FcγRII и FcγRIII. Наряду с этой внутренней гетерогенностью существует, как установлено, и другая, обусловленная экспрессией данных рецепторов на клеточной поверхности в виде комплексов с полипептидными цепями иного происхождения. Два типа таких цепей идентифицированы. Они соединяются с рецепторами разных типов:
✵ FcγRI, аналогично FcεRI? образует комплекс с димером из γ-цепей, соединенных дисульфид ной связью,
✵ FcγRIIIa может ассоциировать с теми же димерами γ-цепи, либо с димерами ζ-цепи (из ТкР-комплекса), либо с гетеродимерами из γ- и ζ-цепей.
Ассоциированные цепи, вероятно, обеспечивают экспрессию рецепторов на плазматической мембране и, кроме того, важны, по-видимому, для передачи сигнала внутрь клетки. В случае FcγIIIb, заякоренного в мембране при помощи GPI, вероятно нет необходимости ни в γ-, ни в ζ-цепях (рис. 6.19).
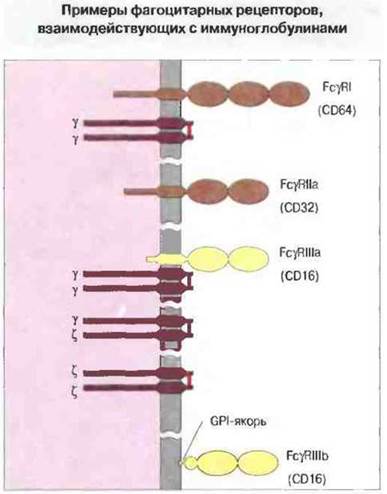
Рис. 6.19. Структура Fсγ-рецепторов человека: FcγRI (экспрессируется моноцитами), FcγRIIa (экспрессируется моноцитами и нейтрофилами), FcγRIIIa (экспрессируется моноцитами и связан с поверхностью клетки как обычный трансмембранный белок) и FcγRIIIb (экспрессируется нейтрофилами и «заякорен» в клеточной мембране фосфатидилинозитолгликаном [GPI]). Каждый тип рецепторов входит в иммуноглобулиновое суперсемейство молекул и имеет два или три внеклеточных иммуноглобулин-подобных домена. Как теперь известно, некоторые рецепторы представляют собой комплексы из различных субъединиц, соединенных дисульфидными связями. Рецепторы FcγRI и FcγRIII ассоциированы с димером γ-цепи, первоначально описанным в составе высокоаффинного комплекса FcεRI (см. рис. 6.20). Рецептор FcγRIIIa ассоциирован с димером ζ-цепи, ранее обнаруженным в составе комплекса ТкР-СD3. В ассоциации с FcγRIIIa могут быть как гомодимерные (γ-γ или ζ-ζ), так и гетеродимерные (γ-ζ) субъединицы. По-видимому, они важны для экспрессии на поверхности и для передачи сигнала через мембрану. При взаимодействии с иммуноглобулином FcγRI, вероятно, связывается со структурным участком вокруг остатка лейцина в позиции 235 домена Сн2. Такой структурный мотив присутствует в тяжелых цепях IgG1, IgG3 и IgG4.
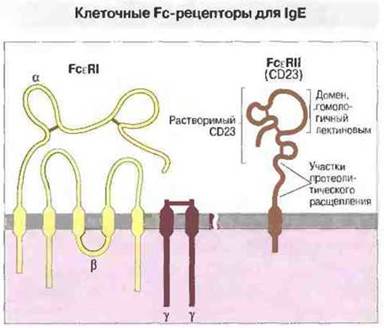
Рис. 6.20. Согласно этой модели, FcεRI состоит из четырех компонентов: одной α-цепи с двумя петлями, которые замкнуты дисульфидными связями и напоминают иммуноглобулиновые, одной β-цепи с двумя внеклеточными сегментами и двух расположенных поблизости γ-цепей, соединенных дисульфидной связью (красная полоска). Решающее значение в связывании FcεRI с IgE имеет α-цепь. Гипотетическая модель FcεRII основана на данных секвенирования и гомологии с животными лектинами. При протеолизе этих рецепторов образуется несколько типов IgE-связывающих факторов, в том числе растворимые молекулы CD23 (мол. массой 25 кДа), имеющие лектиновый домен. Судя по выраженному увеличению экспрессии FcεRII на лимфоцитах, культивируемых в присутствии IgE, этот иммуноглобулин ингибирует протеолиз рецепторов.
IgE связывается с двумя различными клеточными Fce-рецепторами
В настоящее время известны два различных клеточных рецептора для IgE (рис. 6.20). На тучных клетках и базофилах обнаружен высокоаффинный «классический» рецептор FсεRI, относящийся к иммуноглобулиновому суперсемейству молекул. Существенно отличный от него низкоаффинный Fc-рецептор для IgE выявлен на лейкоцитах, в том числе и на лимфоцитах. Низкоаффинный рецептор не принадлежит к иммуноглобулиновому суперссмейству, но в значительной степени гомологичен некоторым лектинам животных, например лектину, связывающему маннозу.
FcεRI - высокоаффинный клеточный рецептор к IgE. Молекула FcεRI образована 4 полипептидпыми цепями (см. рис. 6.20). Входящая в ее состав гликозилированная α-цепь (45 кДа) экспонирована над поверхностью клетки. Антитела к α-цепи способны блокировать связывание IgE с этим рецептором и самостоятельно индуцировать высвобождение гистамина из лейкозных базофилов крысы. Углеводные компоненты α-цепи, вероятно, защищают ее (как и в случае многих других белков клеточной поверхности) от действия сывороточных протеаз, но не имеют значения для связывания IgE и обусловленного IgE высвобождения гистамина.
Одна β-цепь (33 кДа) и две соединенные дисульфидной связью γ-цепи (9 кДа) — это важные компоненты αβγ2-рецепторной единицы. Они необходимы для экспрессии рецептора на поверхности клетки и, вероятно, для трансмембранной передачи сигнала.
Рецептор FсεRI взаимодействует с С-концевой частью тяжелых цепей IgE, а именно с Сε2- и/или Сε3-доменами. Это связывание высокоспецифично и характеризуется очень высокой константой (-1010 М-1). Однако ни взаимодействие рецептора с одновалентным IgE, ни связывание специфического лиганда одной молекулой IgE, по-видимому, не активирует тучные клетки или базофилы, поскольку при этом не происходит высвобождения гистамина. Для начала дегрануляции необходимо, чтобы несколько соединенных с клеточной поверхностью молекул IgE были перекрестно связаны антигеном или другими лигандами, вызывающими дегрануляцию.
Углеводные компоненты молекулы IgE, вероятно, не участвуют во взаимодействии с FсεRI; они важны для секреции IgE В-клетками.
Раньше считалось, что высокоаффшшыс рецепторы дпи IgE имеются только на тучных клетках и базофилах, но недавно установлено, что они могут присутствовать также на клетках Лангерганса и на стволовых клетках.
FcεRII - низкоаффинный клеточный рецептор для IgE. Лимфоцитарный FcεRII человека, или антиген CD23 (45 кДа), содержит типичный для мембраносвязанной молекулы трансмембранный домен, но расположен в мембране необычно «вверх ногами», т. е. С-концом снаружи клетки (рис. 6.20). В отличие от других Fc-рецепторов он относится не к иммуноглобулиновому суперсемейству молекул, а к филогенетически более древнему суперсемейству животных лектинов.
К настоящему времени идентифицированы, клонированы и секвенированы две формы FcεRII человека, одинаковые по структуре внеклеточных доменов, но различные в N-концевой, цитоплазматической области. Рецептор FcεRIIa постоянно присутствует в норме на В-клетках, тогда как экспрессия FcεRIIb индуцируется цитокином ИЛ-4 на Т-клетках. В-клетках, моноцитах и эозинофилах. Часто эта экспрессия бывает повышенной на В-клетках и моноцитах у больных экземой и на лимфоцитах при сенной лихорадке.