ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 7. Антигенраспознающие рецепторы Т-клеток и молекулы МНС
АНТИГЕНЫ ГЛАВНОГО КОМПЛЕКСА ГИСТОСОВМЕСТИМОСТИ (МНС)
Генетические локусы, ответственные за отторжение чужеродных (т. е. отличных от своих) тканей, образуют в хромосоме область, названную главным комплексом гистосовместимости (МНС, от англ. major histocompatibility complex). Высокополиморфные поверхностные клеточные структуры, которые принимают участие в реакциях отторжения, называются антигенами МНС, поскольку первоначально они были идентифицированы с использованием аллоантител, полученных при иммунизации мышей одной инбредной линии клетками мышей других линии, отличающихся только по генам МНС. Впоследствии (благодаря кроссинговерам в пределах МНС у мышей инбредных линий) удалось получить антитела, специфичные к продуктам разных областей этого комплекса, и применить эти антитела для его подробного картирования. Аналогичный серологический подход позволил выявить продукты генов МНС у человека, относящиеся к системе лейкоцитарных антигенов (HLA. от англ. human leucocyte antigens). Такое название продуктов МНС человека обусловлено способом их идентификации: они выявляются как антигены, связывание с которыми аллоантител вызывает комплемент-зависимое разрушение лейкоцитов. Хотя эти молекулы и названы антигенами, они проявляют антигенность только в том случае, когда распознаются иммунной системой не собственного, а генетически иного организма, например при аллотрансплантации органов.
Порядок расположения генов МНС человека и мыши схематично представлен на рис. 7.3. Колируемые этими генами молекулы относятся к трем классам (I, II и III). Между молекулами первых двух классов имеются выраженные структурные различия; но при этом по общему плану строения все они однотипны, несмотря на существование в МНС весьма значительного числа разных генов классов I и II. В то же время между продуктами генов класса III, с одной стороны, и классов I и II, с другой, не найдено никакого функционального или структурного сходства. Группа из более чем 20 генов класса III вообще функционально обособлена — некоторые из этих генов, например, кодируют белки системы комплемента (С4, С2, фактор В) и молекулы, участвующие в процессинге антигена. Поэтому в данной главе мы рассмотрим гены лишь тех локусов МНС, которые участвуют в активации Т-лимфоцитов, т. е. генов классов I и II, а также их продуктов.
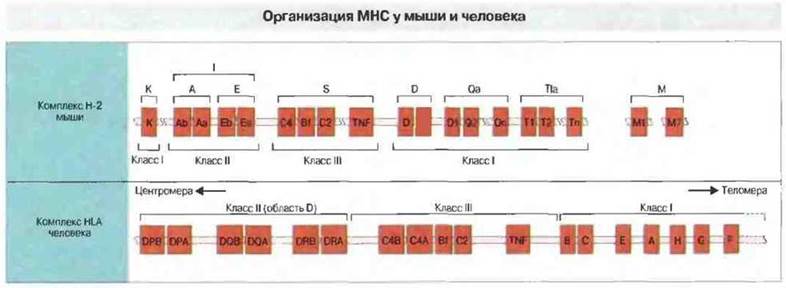
Рис. 7.3. Взаимное расположение областей МНС, а также их главных генов у мыши и человека. Характерное для человека расположение локусов, при котором гены класса II локализованы между центромерой и генами класса I, обнаружено у всех до сих пор изученных видов млекопитающих. МНС мыши и человека занимают в хромосоме области длиной 3000-4000 т.п.н.
Структура молекул МНС класса I
Схематичное изображение молекулы МНС класса I представлено на рис. 7.4. Она состоит из одной гликозилированной тяжелой цепи (45 кДа), нековалентно связанной с β2-микроглобулином (12 кДа) — полипептидом, который встречается также в свободной форме в сыворотке крови.
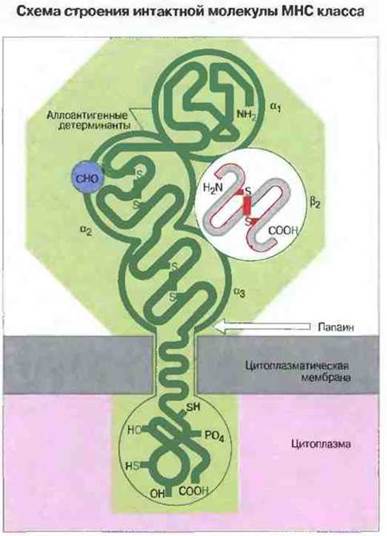
Рис. 7.4. Три внеклеточных глобулярных домена (α1, α2 и α3) показаны темно-зеленым цветом. С α3-доменом тесно ассоциирован β2-микроглобулин (белок, который кодируется геном, расположенным вне МНС). Трехмерная структура β2-микроглобулина (показана серым) стабилизирована внутрицепочечной дисульфидной связью (показана красным) и напоминает иммуноглобулиновый домен. Участки аминокислотной последовательности, специфичные для каждого индивида и поэтому несущие аллоантигенные детерминанты, имеются в α1 - и α2-доменах. В α2-домене к полипептидной цепи присоединен углеводный компонент (СНО). Папаин расщепляет молекулу вблизи наружной поверхности цитоплазматической мембраны.
Тяжелая цепь молекул МНС класса I имеет три внеклеточных домена. Тяжелая цепь молекул МНС класса I состоит из внеклеточной части (образующей три домена, которые обозначены, начиная с N-конца, α1, α2 и α3), трансмембранного сегмента и цитоплазматического хвостового домена. Каждый из трех внеклеточных доменов содержит примерно 90 аминокислотных остатков, и все их вместе можно отделить от клеточной поверхности путем обработки папаином (протеолиз). В α2- и α3-доменах имеется по одной внутрицепочечной дисульфидной связи, замыкающей петлю из 63 и 86 аминокислотных остатков соответственно. Домен α3 гомологичен по аминокислотной последовательности С-доменам иммуноглобулинов. В зависимости от вида и гаплотипа внеклеточная часть тяжелых цепей молекул МНС класса I в разной степени гликозилирована. Трансмембранный сегмент состоит из 25 преимущественно гидрофобных аминокислотных остатков и пронизывает липидный бислой, вероятнее всего, в α-спиральной конформации. Гидрофильный цитоплазматический домен из 30—40 остатков может быть фосфорилирован in vivo.
β2-Микроглобулин необходим для экспрессии молекул МНС класса I. У человека β2-микроглобулин (β2m) имеет неизменную последовательность, но у мыши встречается в двух формах, различающихся одной аминокислотной заменой в позиции 85. По структуре этот белок соответствует С-домену иммуноглобулинов. Молекула β2m способна также нековалентно взаимодействовать с неклассическими молекулами класса I. например с продуктами генов CDI (расположенных в хромосоме I) у человека и с рецепторами к Fc, которые служат для переноса IgG материнского молока через кишечный эпителий у новорожденных крысят. β2-Микро глобулин необходим для экспрессии на поверхности клеток всех молекул МНС класса I — у мутантных мышей, лишенных β2m, они не экспрессируются.
α1- и α2-домены тяжелой цепи класса I образуют полость для связывания процессированного антигена. По данным рентгеноструктурного анализа удалось установить трехмерную структуру внеклеточной части (домены α1, α2, α3 и β2m) нескольких молекул МНС класса I человека (рис. 7.5). Как и предполагалось, укладка α3- и β2m-доменов подобна иммуноглобулиновой. Однако взаимодействие β2m, при ею угловом расположении под доменами α1 и α2, с доменом α3 иное, чем между константными доменами в молекулах антител.
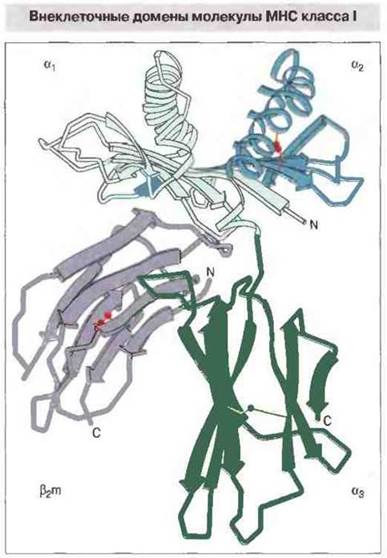
Рис. 7.5. Полипептидный остов внеклеточной части молекулы HLA-A2. Каждый из трех доменов тяжелой цепи взаимодействует с β2m. Ясно видна антигенсвязывающая полость, сформированная доменами α1 и α2.
Домены α1 и α2 вместе образуют платформу из восьми антипараллельных β-складок, поддерживающую две также антипараллельные α-спирали (рис. 7.6). Внутри α2-домена N-концевая β-складка соединяется с α-спиралью дисульфидной связью.
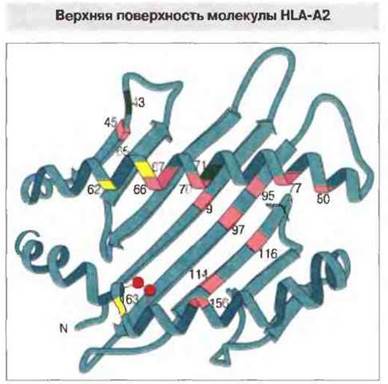
Рис. 7.6. Структура антигенсвязывающей полости в молекуле HLA-A2. Примерно с этой стороны ее «видит» Т-клеточный антигенраспознающий рецептор. Тяжелая цепь, свертываясь в домены α1 и α2, формирует в каждом из них по четыре антипараллельные β-складки и переходит в длинную α-спираль. Сблизившись, эти домены образуют один общий β-слой из восьми складок, покрытый сверху α-спиралями. Позиции наиболее вариабельных аминокислотных остатков выделены цветом. Пять таких остатков, выделенных розовым цветом на центральных β-складках в полости между двумя спиральными сегментами, могут образовывать контакт со связанными там антигенными пептидами. Шесть вариабельных остатков (также отмеченных розовым цветом) расположены на стороне спиралей, обращенной внутрь полости. Другие три вариабельных остатка (показаны желтым) находятся на стороне спиралей, обращенной кверху, и предположительно могут вступать в прямое взаимодействие с ТкР. Вариабельные остатки, показанные темно-зеленым, занимают позиции, не влияющие на связывание антигенных пептидов. (По Bjorkman et al., 1987, с изменениями.)
α-Спирали α1- и α2-доменов разделяет удлиненная полость. В первом исследовании методом рентгеноструктурного анализа в такой полости молекулы HLA-A2 была обнаружена диффузная «избыточная электронная плотность», указавшая на то, что эта полость служит местом связывания процессированного антигена. В пользу данной точки зрения говорит и то, что большинство вариабельных аминокислотных остатков, определяющих полиморфизм молекул класса I и входящих в структуру их Т-клеточных эпитопов, расположено именно в этой полости или поблизости от нее (см. рис. 7.6).
Изменение аминокислотной последовательности в молекулах МНС класса I разной специфичности сопровождается изменением формы антигенсвязывающей полости. Структурная основа связывания антигенных пептидов молекулами МНС класса I стала гораздо понятнее при сравнении молекул HLA-A2 и HLA-Aw68. Их аминокислотные последовательности различаются в 13 позициях: по шести замен имеет каждый из доменов а, и а2 и по одной — домены ач (в позиции 245, определяющей взаимодействие с CD8). Десять вариабельных остатков α1- и α2-доменов расположены в той части тяжелой цепи, которая образует дно и боковую стенку антигенсвязывающей полости (рис. 7.7). За счет различий в аминокислотной последовательности сравниваемые молекулы HLA существенным образом различаются между собой конфигурацией антигенсвязываюшей полости; соответственно различаются по строению и связываемые ими пептиды. Следует отметить, что данная полость — это не простое углубление с гладкими стенками, а структура сложной формы, имеющая на внутренней поверхности ряд субцентров связывания в виде складок и карманов, где возможно взаимодействие с боковыми цепями аминокислотных остатков (рис. 7.8). Например, боковые цепи или концы антигенных пептидов могут заполнить два кармана, которые открываются под спиралью α1-домена. В зависимости от аминокислотных замен в образующих полость полипептидных последовательностях пространственное расположение этих карманов может изменяться (см. рис. 7.8). Такими изменениями определяются различия между молекулами МНС класса I по аффинности связывания антигенных пептидов; от величины этой аффинности зависит, в свою очередь, произойдет ли иммунный ответ на данный антиген.
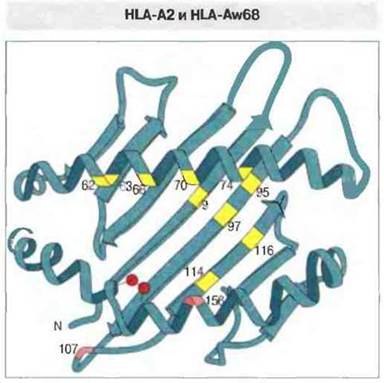
Рис. 7.7. Молекулы HLA-2A и HLA-Aw68 различаются по 13 аминокислотным остаткам, 12 из которых находятся в доменах α1 и α2. Десять вариабельных остатков, занимающих позиции на внутренних стенках антигенсвязывающей полости, показаны цветом (9 желтым, 1 розовым). (По Parham, 1989, с изменениями.)
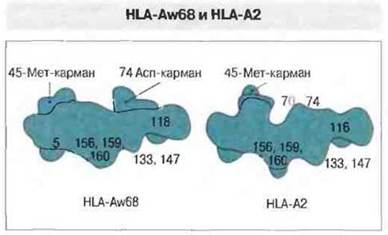
Рис. 7.8. Контурное изображение тех полостей, в которых происходит связывание пептидов чужеродного антигена молекулами HLA-A2 и HLA-Aw68. Показаны карманы, в которые предположительно погружаются аминокислотные остатки связанных антигенных пептидов.
Структура молекул МНС класса II
По общему строению молекулы класса II подобны молекулам класса I. Продукты МНС-генов класса II (А и Е у мыши и DR, DQ и DP у человека) — это гетеродимерные гликопротеины, состоящие из тяжелой (α) и легкой (β) полипептидных цепей. α-Цепи имеют мол. массу 30-34 кДа, β-цепи - от 26 ло 29 кДа в зависимости от локуса кодирующего их гена. Ряд фактов указывает на близкое сходство α- и β-цепей по общему строению.
Внеклеточная часть обеих цепей свернута в два домена (α1 и α2 или β1 и β2) и соединена коротким пептидом с трансмембранным сегментом (длиной примерно 30 аминокислотных остатков), который переходит в цитоплазматический домен, содержащий примерно 10-15 остатков.
Подобно α3-домену класса I и β2m, домены α2 и β2 класса II имеют структурные характеристики константных доменов иммуноглобулинов. Дисульфидная связь внутри β1-домена замыкает петлю из 64 аминокислотных остатков. Межцепочечные различия по мол. массе у продуктов МНС класса II обусловлены главным образом разной степенью гликозилирования: домены α1, α2 и β1 N-гликозилированы, а β2 нет.
С продуктами МНС класса II связаны корецепторные молекулы CD4. Результаты мутационного анализа HLA-DR1 указывают на то, что CD4 присоединяется к β3-домену. Предположительно ассоциация CD4 с ТкР-комплексом важна для мобилизации киназы р56Iск, которая связывается с цитоплазматическим сегментом CD4 и индуцирует тем самым активацию Т-клеток.
Антигенсвязывающая полость молекул МНС класса II вмещает более длинные пептиды. Трехмерная структура молекул HLA-DRI, установленная с помощью рентгеноструктурного анализа, оказалась подобной структуре молекул HLA класса I (рис. 7.9) при одном существенном отличии: антигенсвязывающая полость молекул HLA-DRI сформирована не двумя доменами одной α-цепи, как у молекул класса I, а двумя доменами разных цепей αβ-гетеродимера. Как и в случае молекул класса I, здесь антигенные пептиды связываются в развернутой конформации. Однако в структуре молекул класса II полость больше открыта, поэтому в ней могут поместиться более длинные пептиды (рис. 7.10 и 7.11) Структурные особенности антигенсвязывающего центра (полости) молекул класса II были выявлены путем рентгеноструктурного анализа комплексов HLA-DR1 с пептидом вируса гриппа (см. рис. 1.11). Внутри антигенсвязывающего центра ясно видны карманы, в которых размешаются пять боковых цепей связанного вирусного пептида; наличием этих карманов объясняется антигенсвязывающая специфичность молекул HLA-DR1.
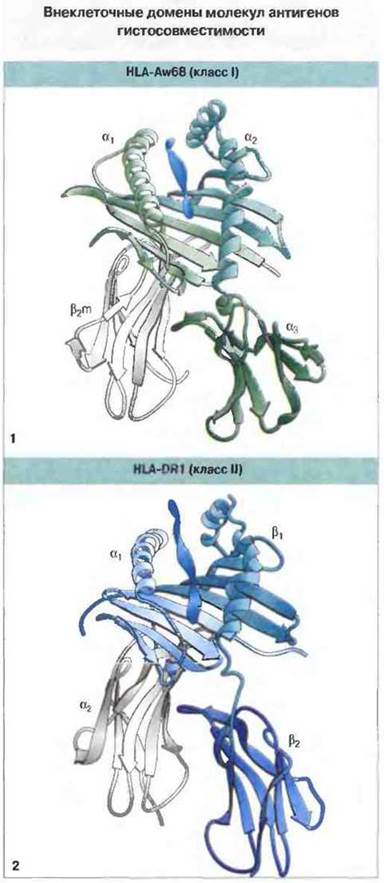
Рис. 7.9. «Ленточные» схемы внеклеточных доменов в молекулах антигенов гистосовместимости: 1) HLA-Aw68 (класс I). 2) HLA-DR1 (класс II). В антигенсвязывающей полости каждой молекулы виден занимающий ее антигенный пептид. Схемы отражают сходство трехмерной структуры молекул классов I и II. (С разрешения по Stern, Wiley, 1994.)
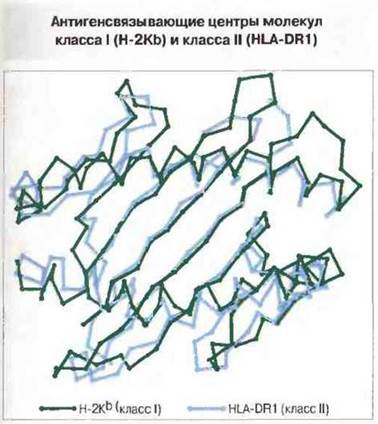
Рис. 7.10. Антигенсвязывающие полости (центры) молекул класса I (Н-2Кb) и класса II (HLA-DR1), показанные как диаграммы расположения α-углеродных атомов (вид сверху). Можно заметить явное сходство между центрами обеих молекул при наличии определенных различий, часть из которых касается предпочтительной длины связываемого антигенного пептида (8-10 аминокислотных остатков у молекул класса I и более 12 аминокислотных остатков у молекул класса II). (С разрешения по Stern, Wiley, 1994.)
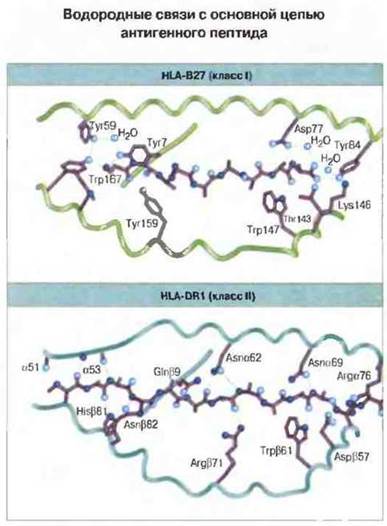
Рис. 7.11. Образование водородных связей между основной цепью антигенного пептида и молекулами класса I (HLA-В27) и класса II (HLA-DR1). (По характеру межмолекулярных взаимодействий подобного рода оба класса молекул МНС существенно различаются.) Главное различие между двумя классами состоит в том, что устойчивые водородные связи в случае молекул класса I сосредоточены на концах антигенного пептида, а в случае молекул класса II распределены по всей его длине. (С разрешения по Stern, Wiley, 1994.)