ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 7. Антигенраспознающие рецепторы Т-клеток и молекулы МНС
ГЕНОМНАЯ ОРГАНИЗАЦИЯ МНС
Локусы класса I у мыши
Дли МНС мыши принято обозначение Н-2. Области Н-2, в которых расположены гены классов I и II, обозначены буквами, например область локализации генов МНС класса I — Н-2К. Сами гены МНС, а также их локусы высокополиморфны разные линии мышей различаются как по структуре этих генов, так и но числу их аллелей в локусах. Поэтому различным комплексам Н-2 даются еще и надстрочные буквенные обозначения, например гаплотип мышей линии BALB/c обозначен H-2d.
МНС мыши (Н-2) содержит три локуса класса I, но разные гаплотипы различаются по числу генов класса I. Гаплоидный геном мыши содержи! около 30 генов класса I, но разные линии мышей могут различайся но числу этих генов. Гены класса I, кодирующие классические, выявляемые в серологических тестах антигены гистосовместимости, находятся в локусах Н-2К, H-2D и H-2L. Функциональное значение большинства остальных генов класса I, картированных в локусах Qa, TIa и М (рис. 7.12), остается пока неясным, хотя известно, что посредством молекул Qa можно вызвать активацию Т-клеток.
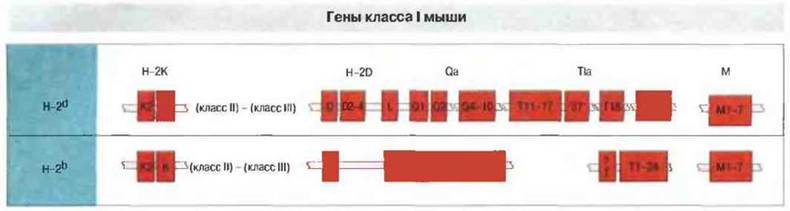
Рис. 7.12. Порядок расположения генов МНС класса I в хромосоме у мышей двух гаплотипов: BALB/c (H-2d) и В10 (Н-2b). Между областями Н-2К и H-2D расположены гены классов II и III. Чтобы аллели одного локуса разных гаплотипов расположить один под другим, на линейных картах произвольно сделаны разрывы, показанные фигурным краем. В области ТIа локализованы многочисленные гены класса I с неизвестной функцией.
Строение области Н-2К. одинаково у всех до сих пор изученных линий мышей. В ней расположены два гена класса I, названные К и К2 (см. рис. 7.12). Ген Н-2К кодирует антиген Н-2К, который экспрессируется и серологически выявлен на клетках большинства типов, тогда как характер экспрессии гена Н-2К2 варьирует в зависимости от линии.
В гаплотипах H-2d и Н-2b область H-2D/H-2L содержит разное число генов класса I (см. рис. 7.12). У мышей BALB/c (гаплотип H-2d) в этой области картированы пять таких генов. Два из них кодируют серологически выявляемые антигены H-2Dd и H-2Ld. Три остальных гена класса I локализованы в участке хромосомы между генами H-2Dd и H-2Ld (расположенными соответственно проксимально и дистально) и названы D2d, D3d и D4d. Функция их неизвестна. В то же время у мышей В10 (гаплотип Н-2b) в области Н 2D идентифицирован только один ген класса I.
Гены локусов Qa, TIa и М кодируют «неклассические» молекулы МНС класса I. Продукты генов, расположенных в локусах Qa, ТIа и М, по структуре сходны с описанными выше молекулами класса I, поэтому их называют иногда «неклассическими» молекулами класса I. Локус Qa занимает участок длиной примерно 200 т.п.н. дистальнее области H-2D/L (см. рис. 7.12) и содержит гены серологически выявляемых специфичностей Qa-2, 3, 4 и 5, а также кластер, включающий от 8 (BALB/c) до 10 (B10) генов класса I.
В локусе TIa, который первоначально считали местом расположения генов, кодирующих только антигены TL (от англ. thymus leukaemia), т. е. антигены клеток тимуса и Т-клеточных лейкозов, впоследствии было обнаружено множество генов класса I и большое число структурных различий между гаплотипами Н-2b и H-2d (линии В10 и BALB/c соответственно) (см. рис. 7.12). Расположенный между областями К и А район М содержит ряд идентифицированных недавно генов класса I, названных М1-М7, с низкой степенью полиморфизма.
МНС человека содержит три локуса класса I
У человека область генов класса I содержит три локуса, названных HLA-A, HLA-B и HLA-C, и занимает участок длиной более 1500 т.п.н. (рис. 7.13). Гены каждого локуса кодируют тяжелые цепи «классических» антигенов МНС класса I. При более детальном изучении данной области вне этих локусов были найдены многочисленные дополнительные гены, кодирующие белки МНС класса I. Это гены локусов HLA-E, HLA-F и HLA-G. Продукт гена HLA-G экспрессируется, как установлено, на клетках плаценты во вневорсиночном цитотрофобласте, защищая их предположительно от материнских НК-клеток (см. гл. 10). Другие гены класса I возможные аналоги мышиных генов Qa, TIa и М — локализованы вблизи локусов HLA-G и HLA-A.
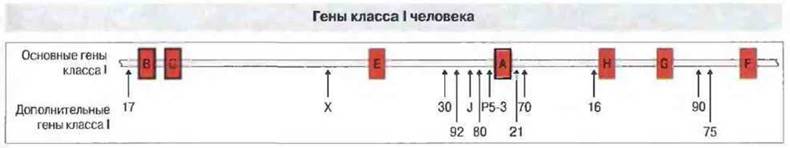
Рис. 7.13. В хромосоме человека гены класса I расположены ближе к теломере, чем гены классов II и III. В дополнение к генам классических трансплантационных антигенов (HLA-A, HLA-B и HLA-C) в этом участке идентифицировано несколько «класс I-подобных» генов, вероятно, эквивалентных мышиным генам области TIa/Qa. Здесь же содержится ряд других генов, отличных от генов класса I.
Гены класса II обнаружены в области Н-21
У мыши α- и β-цепи молекул класса II кодируются отдельными генами, расположенными в области I комплекса Н-2 (рис. 7.14). Так, цепи α и β молекулы А кодируются генами Аа и Аb, а те же цепи молекулы Е — генами Еа и Еb соответственно. (В обозначении гена сначала указывают локус, а затем кодируемую цепь.) Белковые продукты нескольких других клонированных генов а и bкласса II идентифицировать не удалось. Один из них, Рb, - это псевдоген, а два других, Оb и Еb2, возможно несут ту или иную функцию. Последние два гена проявляют низкую степень полиморфизма и определенно транскрибируются, но, неясно, происходит ли их трансляция.
Область Н-21 почти полностью картирована. Проксимально она соседствует в хромосоме с областью H-2Rk, гены которой кодируют молекулы класса I. У мышей гаплотипов b, s, f и q не наблюдается экспрессии молекул класса II, кодируемых генами субрайона I-Е. При гаплотипах b и s отсутствует транскрипция гена Еа, но определяется нормальная цитоплазматическая концентрация цепей Еβ. У мышей гаплотипов f и q не образуются цепи Еα и Еβ.
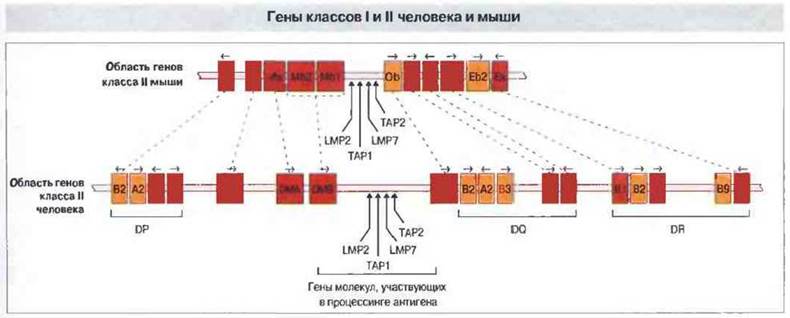
Рис. 7.14. Порядок расположения генов МНС у мыши и человека. Прерывистыми линиями соединены гомологичные гены. Экспрессируемые гены классов I и II отмечены оранжевым цветом, псевдогены - желтым.
Гены класса II человека расположены в области HLA-D
Гены области HLA-D кодируют не менее шести вариантов α- и десяти вариантов β-цепей, образуюших молекулы класса II (см. рис. 7.14). Эти гены занимают три локуса — DR, DQ и DP. К продуктам их экспрессии относится большинство молекул класса II у человека. Идентифицированы также дополнительные гены класса II, расположенные вне этих локусов. Локус DR содержит один ген α-цепи (DRA) и до девяти генов β-цепей (DRBI-9), включая псевдогены. Известно несколько вариантов расположения генов внутри этого локуса. В каждом из локусов DQ и DP имеется по одному экспрессируемому гену α- и β-цепей и дополнительная пара аналогичных генов, функциональных или нефункциональных.
Как и в аналогичных молекулах мыши, α-цепи DR, DQ и DP человека в составе молекулы связаны с β-цепями, кодируемыми преимущественно генами того же самого локуса. С помощью специфических антител обнаружено, что при образовании молекул HLA-DP класса II соединяются продукты генов DPAI и DPBI. Подобно этому, гены DQA1 и DQB1 кодируют антигены HLA-DQ.
Организация и протяженность области DRB варьирует в зависимости от гаплотипа (рис. 7.15), как и число экспрессируемых вариантов β-цепей. Локус DRB2 представляет собой псевдоген. Гены DRB1, DRB3 и DRB4 обычно функциональны, тогда как DPA2, DPB2 и DQB3 - это чаще всего псевдогены и поэтому они не экспрессируются. Гены DNA, DOB и DQA2 могут быть функциональными.
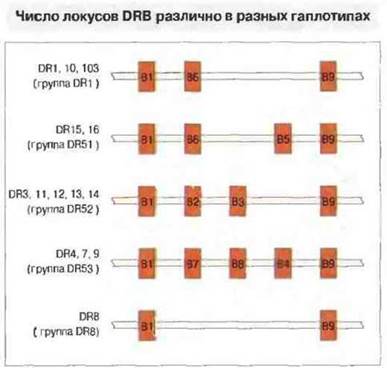
Рис. 7.15. Число локусов DRB различно в разных гаплотипах. Показано их расположение для гаплотипов DR1, DR10, DR103 (верхняя линия), DR15 и DR16 (вторая сверху линия) и т. д. Из этих локусов не все служат матрицами для синтеза мРНК DRβ-цепей.
Область HLA-D содержит также гены белков, участвующих в презентации антигена, но не экспрессируемых на клеточной поверхности. Эти гены и их продукты рассмотрены в гл. 9.
Методами картирования длинных участков ДНК удалось выяснить порядок расположения всех идентифицированных генов класса II в области HLA-D. Вся эта область составляет отрезок ДНК длиной примерно 1000 т.п.н. Линейное расположение и ориентация гомологичных локусов класса II у человека и мыши совпадают.
Полиморфные участки молекул МНС сосредоточены в основном в области антигенсвязывающего центра
Уникальная особенность МНС — это чрезвычайный полиморфизм (структурная вариабельность) кодируемых его генами молекул. Однако не все продукты МНС полиморфны в одинаковой степени. Антигены Qa, TIa и М, близкие по структуре к молекулам класса I, гораздо менее полиморфны, чем классические антигены классов I и II. Перечень специфичностей антигенов HLAклассов I и II, а также аллелей каждого локуса HLA приведен в приложении I.
Структурные различим между вариантами молекулы данного класса касаются в основном определенных участков полипептидных цепей; например, у молекул класса I они сосредоточены в доменах α1 и α2. Домен α3, по-видимому, более консервативен.
Степень изменчивости молекул класса II зависит от локуса и может различаться у разных цепей; например, исключительным полиморфизмом обладают пени DRβ, DQβ и в несколько меньшей степени DPβ. Цепи DQα вариабельны, тогда как DRα считаются инвариантными, a DPα имеют лишь две аллельные формы. В аутбредных популяциях у носителей двух гаплотипов МНС могут экспрессироваться гибридные молекулы класса II с цепями разных гаплотипов, что вносит дополнительное структурное разнообразие.
Большинство вариабельных аминокислотных остатков в антигенах МНС классов I и II сосредоточено в верхней части молекулы, где она образует глубокую полость для связывания чужеродного пептида. Более того, почти все позиции аминокислотных замен собраны вместе на дне этой полости или на обращенных внутрь полости сторонах α-спиралей. Функциональный смысл такого скопления вариабельных остатков (в отношении распознавания антигена Т-клетками) подробнее рассмотрен в гл. 9.
Вопросы для размышления
■ В антигенсвязывающую полость молекулы класса I помещается пептид из 8-9 аминокислотных остатков. Существует ли причина, по которой у человека не могло бы быть молекул МНС, вмещающих пептиды из 3 или 30 остатков?
■ Определение трехмерной структуры молекул классов I и II позволило понять механизм связывания ими антигенных пептидов. В связи с этим высказано предположение, что иммунный ответ можно усиливать или подавлять, вводя в организм пептиды, которые связываются с молекулами МНС. Каким образом знание механизма связывания могло бы помочь в создании лекарственных препаратов из таких пептидов?
■ В отличие от В-клеточного рецептора ТкР обычно обладает низким сродством к антигену и распознает его только в комплексе с молекулами МНС класса I или II. Во взаимодействиях Т-клетокс клетками-мишенями ключевая роль принадлежит также вспомогательным молекулам клеточной поверхности, выполняющим ряд функций. Какие процессы, кроме распознавания антигена, происходят в том случае, когда Т-клетка вступает в контакт с инфицированной вирусом клеткой-мишенью?
■ По сравнению с молекулами класса I антигенсвязывающая полость молекул класса II может вмещать пептид большей длины. Какое этим создается преимущество?
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Bentley G.A., Mariuzza R.A. 1996. The structure of the T cell antigen receptor. Anna. Rev. Immunol. 15: 563-590.
Bjorkman P.J., Parham P. 1990. Structure, function and diversity of Class I major histocompatibility complex molecules. Annu Rev Biochem 59 253-288.
Bjorkman P.J., Saper M A., Samraoui B. et al. 1987. The structure of the human Class I histocompatibility antigen HLA-A2. Nature 329: 506-512.
Bjorkman P.J., Samraoui B., Bennett W.S. et al. 1987. The foreign antigen binding site and T-ceil recognition regions of Class I histocompatibility antigens. Nature 329: 512-516.
Bodmer J.G., Marsh S.E., Albert E.D. et al. 1994. Nomenclature for factors of the HLA system, 1994. Tissue Antigens 44: 1-18.
Brenner M.B., MacLean J., Dialynas D.P. et al. 1986. Identification of a putative second T-cell receptor Nature 322 145-149.
Brown J.H., Jardetzky T.S., Gorga J.C et al. 1993. Three-dimensional structure of the human class II histocompatibility antigen HLA-DR1. Nature 364: 33-39.
Carosella E.D., Dausset J., Kirzenbaum H. 1996. HLA-G revisited. Immunol. Today 17: 407-409.
Clevers H., Alarcon B., Wileman T. et al. 1988. The T-cell receptor/CD3 complex: a dynamic protein ensemble. Annu. Rev. Immunol. 6: 629-662.
Garcia K.C., Degano M., Stanfield R.L. et al. 1996. An αβ T cell receptor structure at 2.5Å and its orientation in the TCR-MHC complex. Science 274: 209-219.
Garratl T.P.J., Saper M.A., Bjorkman P.J. et al. 1989. Specificity pockets for the side chains of peptide antigens in HLA-w68. Nature 342: 692-696.
Green N.M. 1991. The semiotics Of charge. Nature 351: 349.
Hass W., Pereira P., Tonegawa S. 1993. Gamma/delta cells. Annu. Rev. Immunol. 11: 637-685.
Koop B.F., Hood L. 1994. Striking sequence similarity over almost 100 kilobases of human and mouse T-cell receptor DNA. Nat. Genet. 7: 48-53.
Lefranc М.-P., Rabbitts T.N. 1989. The human T-cell receptor γ (TRG) genes. Trends. Biochem. Sci. 14: 214 218.
Madden D.R., Gorga J.C., Strominger L. et al. 1991. The structure of HUX-B27 reveals nonamer self-peptides bound in an extended conformation. Nature 353: 321-325.
Manolios N., Letourneur F., Bonifacino J.S. etal. 1991. Pairwise cooperative and inhibitory interactions describe the assembly and probable structure of the T-cell antigen receptor. EMBOJ. 10: 1643-1651.
Neefjes J.J., Momburg F., Hamerling B.J. 1993. Selective and ATP-dependent translocation of peptides by the МНС-encoded transporter. Science 261: 769-771.
Powis S.H., Trowsdale J. 1994. Human major histocompatibility complex genes. Behring Inst. Mitt. 94: 17-25.
Raulet D.H. 1994. How γδ T cells make a living. Curr. Biol. 4 246-251.
Salter R.D., Benjamin R.J., Wesley P.K. et al. 1990. A binding site for the T-cell co-receptor CD8 on the otg domain of HLA-A2. Nature 345: 41-46.
Sloan-Lancaster J., Allen P.M. 1996. Altered peptide-ligand induced partial T cell activation: molecular mechanisms and role in T cell biology. Annu. Rev. Immunol. 14: 1-27.
Stern L.J., Wiley D.C. 1994. Antigenic peptide binding by class I and class II histocompatibility proteins. Structure 2: 245-61.
Stern L.J., Brown J.H., Jardetzky T.S. et al. 1994. Crystal structure of the human class II MHC protein HLA-DR1 complexed with an influenza virus peptide. Nature 368: 215-221.
Weiss A., Liftman D.R. 1994. Signal transduction by lymphocyte antigen receptor. Cell 76: 263-274.
Williams A.F., Barclay A.N. 1988. The immunoglobulin superfamily - domains for cell surface recognition. Annu. Rev. Immunol. 6: 381-405.