ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 10. Реакции клеточного иммунитета
■ Цитокинам принадлежит центральная роль в положительной и отрицательной регуляции иммунного ответа, а также в его интеграции с физиологическими функциями других систем организма- эндокринной и гемопоэтической.
■ Распознавание микробных структур происходит в самом начале реакции организма на инфекцию, до развития специфического иммунного ответа. Тип последующего ответа зависит в основном от выделяемых цитокинов.
■ Регуляцию иммунного ответа осуществляют хелперные Т-клетки (Тх). Отвечая на антиген, они выделяют различные наборы цитокинов и тем самым инициируют разные эффекторные функции. Так, Txl-клетки активируют макрофаги, а Тх2-клетки способствуют образованию антител. Если активирована неадекватная эффекторная функция, элиминации возбудителя не происходит и развивается хроническая иммунопатология.
■ Иммунный ответ Тх1 -типа подавляет ответ Тх2-типа, и наоборот.
■ Большинство цитотоксических Т-клеток распознает антиген, презентированный в ассоциации с молекулами МНС класса I, тогда как НК-клетки реагируют на мишени, не экспрессирующие эти молекулы.
■ Цитотоксическая активность клеток-киллеров - это комбинированное воздействие на клетки-мишени путем прямого контакта, выделения цитокинов и экзоцитоза белков из гранул, в частности перфорина и гранзимов.
■ Активированные макрофаги уничтожают поглощенные ими микроорганизмы с помощью высокоактивных метаболитов кислорода и азота.
■ Когда реакции клеточного иммунитета не обеспечивают устранения инфекции или персистирующего антигена и поэтому не могут завершиться, в тканях возникает хронический деструктивный воспалительный процесс или образуются гранулемы. При этом непосредственное разрушение жизненно важных клеток или вторичные микрососудистые нарушения, обусловленные избыточным выделением цитокинов, могут стать причиной иммунопатологии.
Термин клеточный иммунитет (иммунитет, опосредованный клетками) первоначально служил для обозначения местных реакций (обычно на внутриклеточно локализующиеся возбудители), осуществляемых лимфоцитами и фагоцитами без участия антител - эффекторов гуморального иммунитета. Теперь этот термин часто используют в более широком смысле, для описания такого противоинфекционного или противоопухолевого иммунного ответа, в котором антителам принадлежит не ведущая, а вспомогательная роль.
Однако полностью разделить клеточный иммунитет и гуморальный невозможно: в инициации образования антител участвуют клетки, а в некоторых реакциях клеточного иммунитета важную связующую функцию выполняют антитела. Более того, не существует, по-видимому, клеточною иммунитета без образования антител, которые способны различными путями модифицировать опосредованный клетками иммунный ответ. Так, комплексы антиген—антитело вызывают высвобождение хемотаксических фрагментов комплемента, усиленно привлекающих лейкоциты в очаг воспаления, и, кроме того, благодаря Fc-рецепторам антитела могут принимать участие в связывании антигенов с клетками и тем самым влиять на реакции клеточного иммунитета, в частности обеспечивать прикрепление фагоцитов и цитотоксических Т-клеток к клеткам-мишеням. Вообще, при скоординированном иммунном ответе происходит многосторонний обмен сигналами между различными типами вступающих в него лейкоцитов и тканевыми клетками.
Межклеточная сигнализация в иммунной системе осуществляется путем непосредственного контактного взаимодействия клеток, в котором участвуют их поверхностные молекулы, или с помощью цитокинов, называемых «белками связи». Эти белки действуют как растворимые медиаторы межклеточных взаимодействий. Вместе с гормонами и нейромедиаторами они составляют основу языка химической сигнализации, путем которой в многоклеточном организме регулируется морфогенез, регенерация тканей и иммунный ответ. Наряду с сигналами, возникающими при взаимодействии клеток с антигеном или друг с другом, существует цитокиновая сигнальная сеть, регулирующая реакции врожденного и приобретенного иммунитета, в том числе воспаление, противовирусную защиту, клональную пролиферацию антигенспецифичных Т- и В-клеток и их функции.
ЦИТОКИНЫ И ИХ КЛЕТОЧНЫЕ РЕЦЕПТОРЫ
Цитокины - это небольшие белки (мол. масса от 8 до 80 кДа), действующие аутокринно (т. е. на клетку, которая их продуцирует) или паракринно (на клетки, расположенные вблизи). Образование и высвобождение этих высокоактивных молекул обычно происходят кратковременно и жестко регулируются. К настоящему времени у человека идентифицировано уже более ста различных цитокинов, и постоянно появляются сообщения об открытии новых. Цитокины воздействуют на клетку, связываясь со специфическими рецепторами на цитоплазматической мембране и вызывая этим каскадную реакцию, ведущую к индукции, усилению или подавлению активности ряда регулируемых ими генов.
Многие цитокины имеют по несколько названий. Это связано с тем, что они были независимо открыты в различных областях исследований — иммунологии, вирусологии, гематологии, клеточной биологии и онкологии. К цитокинам относятся интерлейкины (ИЛ), обозначаемые сейчас номерами от ИЛ-1 до ИЛ-18, интерфероны (ИФ), колониестимулирующие факторы (КСФ), факторы некроза опухолей (ФИО), факторы роста и хемокины (хемотаксические цитокины) (рис. 10.1). Причина многих недоразумений в номенклатуре цитокинов состоит в том, что они, по крайней мере in vitro, проявляют многообразные активности; примером может служить ИЛ-6, эффекты которого очень разнообразны (рис. 10.2). Кроме того, в ряде случаев один и тот же цитокин был выделен независимо в нескольких лабораториях при использовании совершенно разных экспериментальных систем. Путаницу с названиями усугубляет еще и частичное совпадение активностей у ряда цитокинов, создающее впечатление некоторой избыточности их функций. Дополнительные трудности в изучении цитокинов возникают из-за того, что эти медиаторы редко образуются по отдельности и редко действуют поодиночке. Одним слотом, для цитокинов характерен сложный сетевой характер функционирования, при котором продукция одного из них влияет на образование или проявление активности ряда других. In vivo отдельная клетка организма редко становится мишенью какого-либо одного цитокина. Гораздо чаще отдельные цитокины служат как бы буквами некоего алфавита, образующими целое цитокиновое «слово», и реакция клетки возникает в результате воздействия на ее поверхность именно такого «слова».
Наиболее важные функции цитокинов и их рецепторов в иммунном ответе будут рассмотрены ниже; вначале необходимо остановиться на основных аспектах молекулярной биологии этих белков.
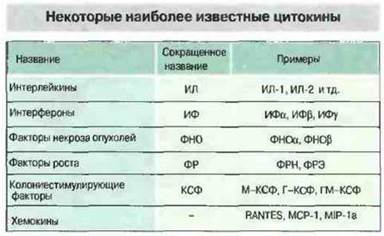
Рис. 10.1. Номенклатура цитокинов отчасти отражает ту функциональную активность, по которой каждый из них был впервые обнаружен, а также очередность их обнаружения.
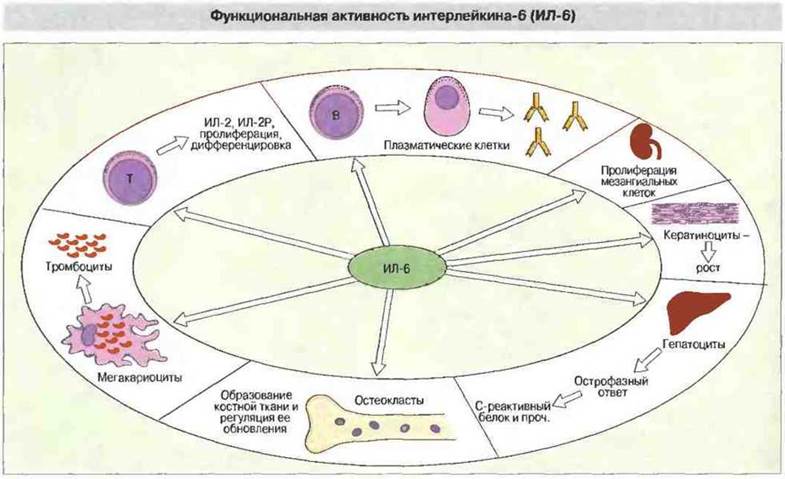
Рис. 10.2. Цитокин ИЛ-6 оказывает типичное для цитокинов разноплановое воздействие на многие системы органов. В частности, он стимулирует образование и активность остеокластов, особенно после падения концентрации эстрагенов.
Цитокины и их рецепторы подразделяются на ряд семейств
Между индивидуальными цитокинами или их группами существует лишь небольшое сходство на уровне ДНК и аминокислотной последовательности, но все же они распределяются по гомологии на несколько больших семейств. Из них наиболее значительны три семейства: первое состоит из не менее чем 15 α-интерферонов (ИФα), второе из более чем 50 хемокинов (по данным анализа генома) и третье включает цитокины, которые связываются с рецепторами для ФHО. Гораздо легче, однако, сгруппировать цитокины не по функциям, а по характеру их трехмерной структуры, и такое подразделение четко отражает внутригрупповое сходство (по конформации и аминокислотной последовательности) клеточных цитокиновых рецепторов. Наиболее крупное семейство — суперсемейство — цитокиновых рецепторов характеризуется наличием в составе молекул внеклеточных участков с гомологичной последовательностью длиной примерно 200 аминокислотных остатков. К этому суперсемейству относятся рецепторы к ИЛ-2, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-7, ИЛ-9, ИЛ-12, гранулоцитарному колониестимулирующему фактору (Г-КСФ) и гранулоцитарно-макрофагальному колониестимулируюшему фактору (ГМ-КСФ). В него же входят рецепторы для гуморальных факторов, действующих преимущественно вне иммунной системы, — гормона роста и пролактина. Второе по величине семейство объединяет рецепторы к интерферонам всех типов, а также рецепторы к ИЛ-1α, ИЛ-1β и макрофагальному колониестимулирующему фактору (М-КСФ). Это семейство входит как составная часть в суперсемейство иммуноглобулин-подобных молекул.
Цитокиновые рецепторы третьего семейства связывают ФНОα и ФНОβ, лимфотоксин и ряд родственных цитокинов, в том числе фактор роста нервов (ФРН). К этому же рецепторному семейству относится молекула Fas (CD95), связывание которой с лигандом FasL служит сигналом клеточной гибели.
Большинство цитокиновых рецепторов — это мембранные гликопротеины 1 типа, состоящие из одного-единственного трансмембранного домена. Однако действительно функциональные рецепторы, как правило, состоят из двух или большего числа субъединиц, которые могут иметь одинаковую структуру даже у различных по специфичности рецепторных комплексов. Обычно рецептор содержит «частную» высокоспецифичную субъединицу, способную связывать определенный цитокин, и «общую» субьединицу, которая встречается в рецепторах для других цитокинов. Например, рецепторный комплекс для ИЛ-2 состоит из трех субъединиц (α, β и γ). Субъединица ИЛ-2Рβ встречается также в рецепторе для ИЛ-15, а ИЛ-2Рγ — в рецепторах для ИЛ-4, ИЛ-7 и ИЛ-9 (рис. 10.3). Подобным же образом ИЛ-6Рβ (известный как gp130) содержится в качестве субъединицы в рецепторах дли таких цитокинов, как LIF (от англ. leukaemia inhibitoryfactor — фактор подавления лейкемии), онкостатин М и ИЛ-11. Сходная функциональная активность некоторых цитокинов отчасти объясняется, возможно, наличием одинаковых субъединиц в их клеточных рецепторах. Поэтому, видимо, ИЛ-6, ИЛ-11 и онкостатин М одинаково действуют на гепатоциты, мегакариоциты и остеокласты, а дублирующий эффект ИЛ-2 и ИЛ-4 в качестве факторов роста Т-клеток обусловлен, по всей вероятности, присутствием в рецепторах для того и другого цитокина идентичной ИЛ-2Рγ-цепи. В то же время благодаря дифференциальной экспрессии частных рецепторных субъединиц каждый цитокин обладает и уникальной активностью в отношении клеток определенного типа. Например, LIF может задерживать дифференцировку эмбриональных стволовых клеток, тогда как ИЛ-6 такой активностью не обладает, поскольку эти клетки не экспрессируют соответствующего рецептора.
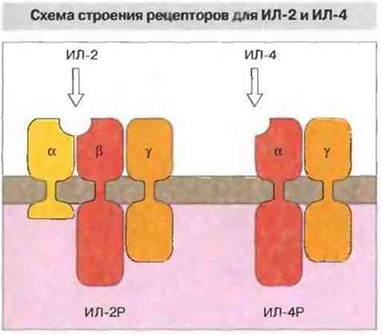
Рис. 10.3. Высокоаффинный рецептор для ИЛ-2 образован тремя полипелтцдными цепями; α-цепь и β-цепь обеспечивают связывание цитокина, γ-цепь передает возникающий при этом сигнал внутрь клетки. Рецептор для ИЛ-4 имеет уникальную α-цепь, специфически распознающую именно этот цитокин, и сигнальную γ-цепь, идентичную γ-цепи рецептора для ИЛ-2.
Все хемокины связываются рецепторами отдельного класса, объединенными на основе их уникальной структуры под общим названием семь трансмембранных гликопротеинов. Некоторые из них настолько специфичны, что связывают только один определенный хемокин, тогда как другие обладают сродством к ряду хемокинов. Существует также один рецептор (он известен как групповой эритроцитарный антиген Даффи), который «без разбора» связывает многие хемокины и, вероятно, принимает участие в ликвидации образующегося в очаге воспаления избытка этих медиаторов. Хемокины связываются также с β-адренорецепторами. Это еще одно свидетельство перекрывания системы цитокинов и других сетевых сигнальных систем, образуемых растворимыми медиаторами.
Связывание цитокиновых рецепторов активирует механизм внутриклеточной передачи сигналов
Современные представления о биологической роли цитокинов основаны на данных структурного анализа их молекул и изучении механизмов внутриклеточной передачи вызываемых ими сигналов. Благодаря таким исследованиям сейчас можно уже довольно детально проследить эту цепь последовательных событий белок-белкового распознавания, от момента связывания цитокина с клеточной поверхностью до мобилизации различных факторов транскрипции в ядре клетки. Как известно, первая стадия цитокиновой сигнализации - это вызванная присоединением цитокина агрегация субъединиц рецептора. Цитоплазматические «хвосты» этих субъединиц, взаимодействуя между собой, запускают нисходящий каскад сигнализации. В самом простом случае одинаковые субъединицы рецепторной молекулы, связавшись с цитокином, образуют гомодимер, в другом случае «частная» субъединица после присоединения цитокина вызывает гетеро- или гомодимеризацию «общих» субъединиц, передающих сигнал внутрь клетки (рис. 10.4).
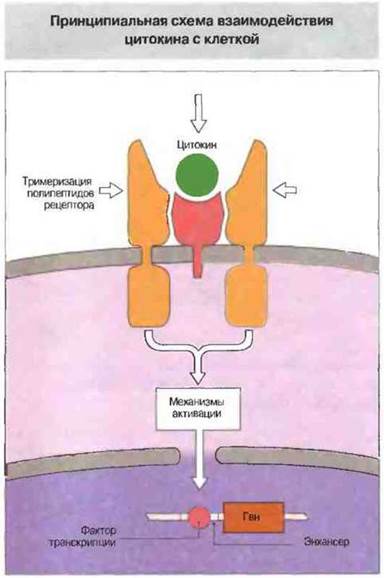
Рис. 10.4. Упрощенная схема активации клетки цитокином. (Представлено взаимодействие ИЛ-6 с его рецептором.) Связавшись с рецептором на поверхности клетки, цитокин вызывает димеризацию или полимеризацию его полипептидных цепей, в результате которой активируются механизмы внутриклеточной сигнализации (например, киназные каскады). Это приводит к образованию активных факторов транскрипции, которые мигрируют в ядро и связываются с энхансерами - нуклеотидными последовательностями, усиливающими транскрипцию генов, активируемых данным цитокином.
Все цитокииовые рецепторы, относящиеся к первому семейству (суперсемейству), как и представители некоторых других рецепторных семейств, ассоциированы с молекулами, названными Янус-киназами (Jaks, от англ. Janus kinases). Активация цитокиновых рецепторов вызывает активацию Jaks, в частности киназ, фосфорилирующих тирозин (Туk, от англ. tyrosine kinases). Большая часть (если не все) функции цитокиновых рецепторов осуществляются с обязательной активацией Jaks. Выполняя свою главную функцию, т. е. агрегируя субъединицы рецептора, цитокин одновременно вызывает агрегацию Jaks. Затем под действием этих Янус-киназ происходит сопряженное с присоединением цитокина фосфорилирование остатков тирозина в составе различных сигнальных белков, в том числе переносчиков сигнала и активаторов транскрипции (Stats, от англ. signal transducers and activators of transcription). Димеры белков Statsперемещаются к ядру клетки и связываются непосредственно с ДНК. Этот вид сигнализации изображен па рис. 10.5 на примере связывания ИФα с его клеточным рецептором.
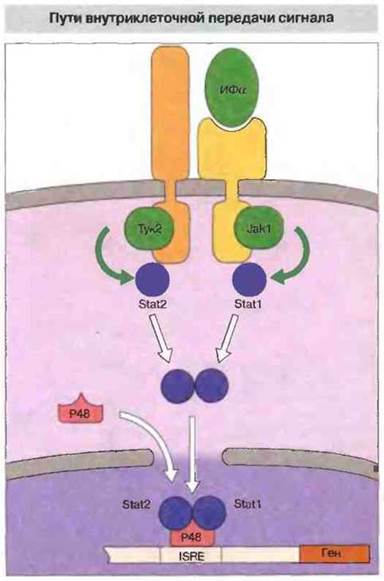
Рис. 10.5. Схема активируемых ИФα механизмов внутриклеточной передачи сигнала. Связывание с ИФα вызывает агрегацию двух субъединиц клеточного рецептора. В результате происходит активация и фосфорилирование Jak-киназ — Jak1 и Туk2, которые затем фосфорилируют молекулы Stat1 и Stat2. Эти факторы транскрипции образуют комплекс с белком р48, который связывается с ДНК. Образовавшийся комплекс достигает ядра клетки и индуцирует транскрипцию генов, несущих регуляторный элемент ответа на интерферон (ISRE, от англ. interferon response element).
Каждый цитокин индуцирует различные механизмы внутриклеточной передачи сигнала в зависимости от того, какую из активностей он проявляет — общую с другими цитокинами или специфическую, индивидуальную. Например, в Т-клетках каждый из трех интерлейкинов - ИЛ-2, ИЛ-4 и ИЛ-9, взаимодействуя с субъединицей ИЛ-2Рγ, активирует Jak1 и Jak3; в то же время ИЛ-10 вызывает активацию Jak1 и Туk2, а ИЛ-12 таким же образом действует на Jak2 и Туk2. Дополнительная вариабельность ответа клеток на цитокины возникает на этапе фосфорилирования Stats, поскольку каждый цитокин активирует «свой» набор этих переносчиков сигнала и активаторов транскрипции. В ответе на цитокины, вероятно, и состоит главная функция Stats. Другие пути сигнализации, в первую очередь с активацией Ras/MAP-киназы, ведут к пролиферации клеток под действием соответствующих цитокинов, однако некоторые цитокины могут активировать механизм сигнализации, ведущий к апоптотической гибели клетки. Функциональная гибкость сигнальных систем возрастает еще больше благодаря тому, что активировать Stats могут не только Jaks, но и киназы иного происхождения. Например, в случае цитокинов ФНОα и ИЛ-1β действует механизм внутриклеточной сигнализации с участием не Jaks и Stats, а MAP-киназ; в результате с ДНК связываются такие активаторы транскрипции, как AP-1, NFkB и NFIL-6.
Как специфическое, так и плейотропное действие хемокинов в конечном итоге влияет на перемещение клетки, но это сложный эффект: вслед за присоединением хемокинов к рецепторам происходит передача сигнала на G-белки, затем мобилизация вторых, внутриклеточных посредников, реорганизация цитоскелета, образование ограниченных адгезивных контактов, прилипание и отлипание клеточной поверхности, вытяжение и сокращение псевдоподий - все эти этапы необходимы для направленной миграции. Хемокины, подобные RANTES и М1Р-1α, могут также активировать Stats, образуя шунт между путями сигнализации с участием G-белков и Stats. Итак, постепенно область исследований цитокинов превращается из запутанного клубка множественных активностей во все более понятную систему белков-регуляторов со своими рецепторами и четкими путями сетевой внутриклеточной сигнализации.
Дифференцировка Т-хелперов на субпопуляции составляет важный этап в определении эффекторных механизмов иммунного ответа
Как теперь установлено, существуют две субпопуляции Тх-клеток CD4+, различающихся но набору (профилю) синтезируемых ими цитокинов, и от этого профиля зависит, какой из двух основных типов иммунного ответа будет реализован (рис. 10.6). У человека Тх1-клетки, как правило, продуцируют ИФγ, ФНОβ и ИЛ-2 и участвуют в опосредованных клетками воспалительных реакциях. Некоторые из цитокинов, выделяемых Тх1, обладают провоспалительной активностью, а также стимулируют цитотоксические клетки и Т-эффекторы гиперчувствительности замедленного типа. В противоположность Tx1-клеткам клетки Тх2 синтезируют ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-9, ИЛ-10 и ИЛ-13 и усиливают образование антител, особенно класса IgE. В результате они стимулируют гиперпродукцию антител и аллергические реакции. Помимо всего прочего, цитокины, выделяемые Тх1-клетками, подавляют активность Тх2-клеток, и наоборот. Таким образом, любой иммунный ответ развивается в направлении либо Тх1-, либо Тх2-типа (рис. 10.7).
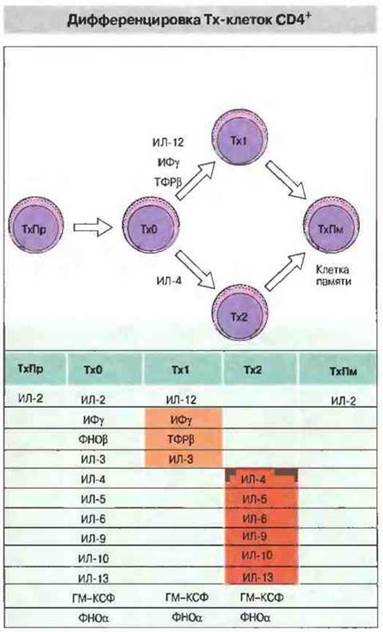
Рис. 10.6. Схема дифференцировки Т-хелперов мыши с образованием субпопуляций клеток с разными профилями выделяемых цитокинов. Цитокины ИЛ-12. ИФγ и ФНОβ способствуют появлению клеток Тх1, а ИЛ-4 стимулирует созревание Тх2. От профиля выделяемых Т-хелперами цитокинов зависит тип и, следовательно, функции активируемых эффекторных клеток.
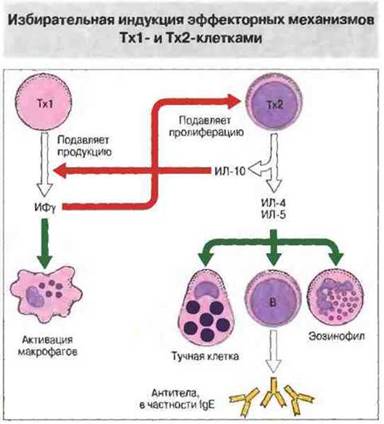
Рис. 10.7. Выделяя разные наборы цитокинов, Tx1- и Тх2-клетки не только стимулируют различные зффекторные механизмы иммунного ответа, но и взаимно подавляют иммунорегуляторную активность друг друга.
Недавно выявлены различия между Tx1- и Тх2-клетками по маркерам поверхности. Для клеточной мембраны Tx1 характерно наличие LAG-3 — антигена, относящегося к суперсемейству иммуноглобулин-подобных молекул. Клетки Тх2 экспрессируют в гораздо большем количестве по сравнению с Тх1-клетками маркер CD30, относящийся к семейству рецепторов для ФНО.
Определение (выбор) типа ответа — Tx1 или Тх2 — имеет принципиальное значение для развития эффективного иммунитета и, по-видимому, зависит от многих взаимодействующих между собой факторов. Среди них на характер дифференцировки Тх-клеток CD4+и тем самым на профиль цитокинов, определяющих тип ответа, могут влиять следующие:
✵ профиль и количественное соотношение цитокинов, выделяемых под действием антигена. Например, ИЛ-12 служит мощным стимулом продукции Т- и НК-клетками γ-интерферона и, следовательно, дифференцировки Тх-клеток в Tx1. В то же время α-интерферон, синтезируемый в ранней фазе вирусной инфекции, способен не только индуцировать повышенную экспрессию ИЛ-12, но и переключать Тх-клетки с синтеза Тх2-набора цитокинов на Тх1. Напротив, ранняя продукция ИЛ-4 способствует появлению клеток Тх2;
✵ доза антигена;
✵ антигенпрезентирующие клетки и выделяемые ими цитокины;
✵ генотип организма-хозяина и
✵ активность костимулирующих молекул и гормонов в месте взаимодействия антигена с Тх-клетками.
Из перечисленных факторов дифференцировки Тх-клеток особый интерес представляет последний. Например, глюкокортикоидные гормоны, концентрация которых нарастает в условиях физического или психологического стресса (такие, как кортизол), могут направить развитие иммунного ответа по Тх2-типу. Этому эффекту противодействуют производные дегидроэпиандростерона (ДГЭА), способствующие иммунному ответу Tx1-типа. Концентрации обоих этих гормонов надпочечника регулируются на системном уровне, а также зависят от местного метаболизма в тех органах, где происходит встреча антигена с Тх-клетками. Поэтому соотношение концентраций кортизола и ДГЭА в лимфоидной ткани или в очаге патологии может служить фактором, определяющим тип иммунного ответа.
Иммунный ответ не всегда строго поляризован по Tx1- или Тх2-типу, так как, возможно, имеются и другие субпопуляции Т-хелперов. Тем не менее роли этих двух типов ответа как в формировании протективного иммунитета, так и в иммунопатологии принципиально различны. К настоящему времени установлено, что для многих заболеваний характерно функционирование определенной субпопуляции Т-хелперов. Так, органоспецифическая иммунопатология, острое отторжение аллотрансплантата, рецидивирующие спонтанные аборты и рассеянный склероз связаны с иммунным ответом Tx1-типа. При этих заболеваниях из крови больных легко удается выделить и клонировать Tx1-клетки. Напротив, все клоны Т-клеток от больных атопической бронхиальной астмой, сенсибилизированных к пыльце растений, синтезируют, как и клоны больных системной красной волчанкой, цитокиныТх2-профиля.
Т-клетки CD8+также дифференцированы на субпопуляции с различными профилями выделяемых цитокинов
Многие цитотоксические Т-клетки CD8+выделяют тот же набор цитокинов, что и клетки Тх1. Существуют также Т-клетки CD8+, выделяющие цитокины Тх2-типа. Эта субпопуляция выполняет регуляторные и супрессорные функции. На дифференцировку Т-клеток CD8+может влиять цитокиновый профиль Т-клеток CD4+. Например ИФγ и ИЛ-12 способствуют дифференцировке Т-клеток CD8+в субпопуляцию Тц1-клеток, а ИЛ-4 — в субпопуляцию Тц2. Однако клетки обеих этих субпопуляций обладают цитотоксической активностью и поражают свои мишени главным образом путем высвобождения содержимого гранул (см. ниже).