ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 9. Распознавание антигена
ОБРАЗОВАНИЕ И СТРОЕНИЕ КОМПЛЕКСА АНТИГЕННЫЙ ПЕПТИД-МОЛЕКУЛА МНС
Полость в молекуле МНС, где происходит связывание антигенных пептидов, имеет разнообразные карманы и щели, а также выступающие и утопленные участки поверхности. Их тонкая топология отчасти зависит от «выстилающих» эту полость аминокислотных остатков и поэтому различается у молекул МНС разных гаплотипов. Параметры связывания пептида с молекулой МНС зависят от природы его боковых цепей и от взаимной комплементарности контактирующих участков обоих партнеров ассоциации. Определенная часть боковых цепей пептида не участвует во взаимодействии с молекулой МНС и предназначена для контакта с ТкР (см. гл. 7).
Образование комплексов из антигенных пептидов и молекул МНС происходит в специализированных внутриклеточных органеллах, при этом взаимодействие с молекулами класса I и класса II происходит в различных участках клетки.
Пептиды удерживаются в предназначенной для их связывания полости молекулы МНС особыми якорными аминокислотными остатками
Пептидные фрагменты, появившиеся в результате процессинга антигена и экспонируемые затем АПК в ассоциации с молекулами МНС, можно получить в виде очищенных препаратов и секвенировать. Среди них встречаются не только пептиды из поглощенного клеткой чужеродного антигена (например, вирусных частиц), но и собственные пептиды организма, отщепившиеся в АПК или эндоцитированные ею из внеклеточной жидкости. Анализ (путем очистки и секвенирования) этих собственных пептидов, элюированных из комплексов с молекулами МНС класса I, показал, что они состоят из девяти аминокислотных остатков; при этом удалось точно установить структуру ряда таких пептидов и идентифицировать характерные аминокислотные остатки - один на С конце и другой ближе к N-концу. Этими характерными структурными мотивами различаются пептиды, связываемые молекулами класса I разных гаплотипов (рис. 9.22).
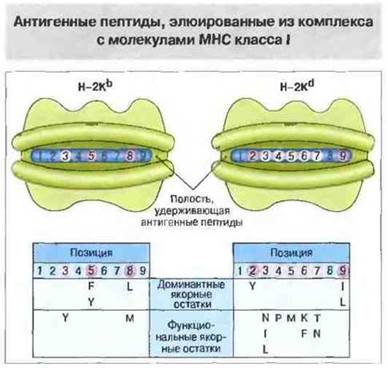
Рис. 9.22. Аллоспецифичные структурные мотивы в молекулах пептидов, элюированных из комплексов с молекулами МНС класса I гаплотипа Н-2Кb или Н-2Кd. Молекулы МНС выделяли методом иммунопреципитации. Связанные с ними пептиды были очищены и секвенированы. «Якорные» аминокислотные остатки, наиболее часто встречающиеся в определенных позициях, определены как доминантные, а встречающиеся лишь относительно часто - как функциональные. В позициях без указания определенной аминокислоты с равной вероятностью встречается несколько различных остатков. Для обозначения аминокислот использован однобуквенный код. Вверху изображены пептидсвязывающие полости (вид сверху) двух молекул МНС класса I разных гаплотипов. Позиции якорных остатков в составе пептида, связанного с молекулой МНС каждого гаплотипа, выделены цветом.
Значение этих консервативных остатков стало очевидным при анализе трехмерной структуры некоторых молекул МНС класса I, позволившем составить довольно ясную картину расположения антигенною пептида в пептидсвизываюшей полости. Установлено, что края этой полости смыкаются в ее торцах и пептид в виде развернутой (не образующей α-спирали) цепи из девяти аминокислотных остатков своими N-концом и С-концом упирается в тот и другой торец. Часть боковых групп антигенного пептида погружается в карманы, образованные вариабельной областью тяжелой цепи молекулы МНС класса I, и между аминокислотными остатками этой молекулы и пептида по всей его длине образуются многочисленные водородные связи. Например, остатки тирозина, часто встречающиеся на N-конце пептида, взаимодействуют подобным образом с консервативным остатком лизина молекулы МНС класса I, стабильно удерживая антигенный пептид в ее пептидсвязывающей полости. При этом центральная часть пептида выступает из полости, презентируя свои эпитопы Т-клеточным рецепторам. Эти данные согласуются с тем фактом, что характерные структурные мотивы, связываемые молекулами МНС класса I, найдены на концах антигенных пептидов.
При анализе трехмерной структуры молекул МНС класса II была обнаружена почти такая же, как у молекул класса I (но расположенная иногда иначе), пептидсвязывающая полость с рядом карманов. Главное ее отличие от пептидсвязывающей полости молекул класса I — это открытые торцевые концы. За счет такого несмыкания краев концы связанного пептида выступают из полости, и он содержит больше 15 аминокислотных остатков, т. с. превышает подлине пептиды, элюируемые из комплексов с молекулами МНС класса I. Удалось идентифицировать консервативные «якорные» аминокислотные остатки в составе пептидов, элюируемых из комплекса с молекулами МНС класса II. Это было труднее сделать, чем в случае пептидов, связываемых молекулами класса I, так как в молекулах класса II концы пептида выступают за пределы полости и распределение формирующих комплекс связей более равномерное (рис. 9.23). Функции торцевых частей пептидсвязывающей полости у молекул МНС класса I и класса II существенно различны: в первом случае связывание N- и С-концов пептида в торцах удерживает его в полости, а во втором открытые торцы позволяют пептидам выступать концами за ее пределы.
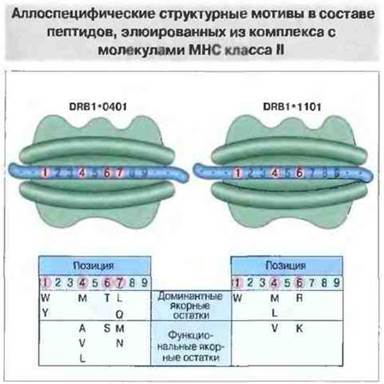
Рис. 9.23. Очищенные препараты HLA-DR двух гаплотипов (DRB1*0401 и DRB1*1101) были проинкубированы с библиотекой пептидов, клонированных в бактериофаге М13. После многочисленных этапов селекции были идентифицированы и секвенированы пептиды, эффективно связываемые молекулами МНС класса II. Аминокислотные остатки в составе этих пептидов, встречающиеся в одних и тех же позициях с частотой выше 20%, определены как якорные доминантные. Другие остатки, встречающиеся лишь относительно часто, названы якорными функциональными. (По Hammer et al., 1993). Обратите внимание, что в пептидсвязывающую полость молекул класса II помещается более длинный пептид по сравнению со связываемым в полости молекул МНС класса I.
Молекулы МНС класса I образуют комплексы с эндогенно синтезированными пептидами
Неоднократно продемонстрировано, что Т-клетки, рестриктированные в отношении распознавания антигена молекулами МНС класса I (например, Тц), распознают синтезированные клеткой-мишенью эндогенные антигены, тогда как Т-клетки, рестриктированные молекулами МНС класса II (в частности, Тх), распознают экзогенные антигены. Произвольно меняя локализацию белка, можно вызвать иммунный ответ, рестриктированный молекулами МНС либо класса I, либо класса II. Например, гемагглютинин вируса гриппа (НА), представляющий собой гликопротеин, ассоциированный с мембранами клеток организма, вызывает лишь слабый Тц-ответ. Однако, если из гена НА (кДНК) вырезать последовательность, кодирующую N-концевой сигнальный пептид, а затем ввести этот модифицированный ген в клетку в соответствующем векторе, будет синтезироваться цитоплазматическая форма НА, вызывающая весьма сильный Тц-ответ анти-НА. Подобным образом, введение овальбумина в цитоплазму клетки-мишени с применением метола осмотического шока вызывает появление Тц, тогда как обычная иммунизация этим экзогенным антигеном вызывает исключительно Тх-ответ.
Протеазомы - клеточные органеллы, разрушающие цитоплазматические белки. Образование комплексов антигенных пептидов с молекулами МНС класса I происходит в шероховатом эндоплазматическом ретикулуме (ЭР), но сами эти (эндогенные) пептиды образуются из белков цитозоля. На первом этапе процесса действуют органеллы, названные протеазомами. Они представляют собой комплексы из 12-15 различных субъединиц, которые обеспечивают основную протеолитическую активность цитозоля. Протеазомы содержат, например, набор эндопеитидаз, расщепляющих денатурированные или отмеченные убиквитином белки до пептидов, насчитывающих от 5 до 15 аминокислотных остатков. (Убиквитин — это полипептид, который присоединяется к белкам в качестве метки, предопределяющей их расщепление.) Две субъединицы протеазом кодируются входящими в МНС генами LMP2 и LMP7. γ-Интерферон индуцирует экспрессию этих генов, и их продукты вытесняют конститутивные (неиндуцибельные) компоненты протеазомы. Целый ряд доказательств, включая результаты направленной модификации генов и опытов с ингибиторами протеазом, свидетельствует об участии LMP2 и LMP7 в процессинге всех пептидов, образующих комплексы с молекулами МНС класса 1.
В полость ЭР образующиеся в цитозоле под действием протеазом пептиды попадают с помощью гетеродимерных транспортных белков из суперсемейства «АВС», кодируемых двумя генами - ТАР1 и ТАР2. Эти гены картированы вблизи генов LMP2 и LMP7 (рис. 9.24). Установлено, что перенос антигенных пептидов в ЭР способны осуществлять выделенные из клеток микросомы, но микросомы из клеток, дефицитных но генам ТАР1 и ТАР2, такой способностью не обладают. Наиболее эффективный перенос происходит в том случае, если пептиды содержат 8—15 аминокислотных остатков. Пептиды именно такой длины предпочтительно связываются с молекулами МНС класса I, однако перед комплексированием они, возможно, подвергаются дополнительному процессингу.
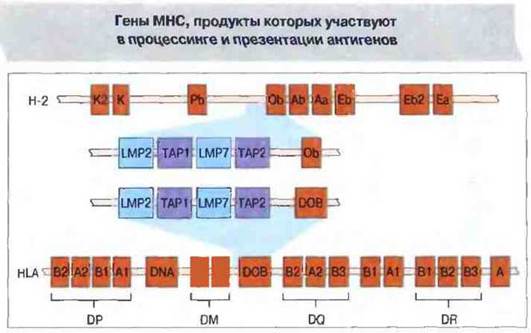
Рис. 9.24. Гены транспортных белков (ТАР) и компонентов протеазом (LMP) расположены у мыши в комплексе Н-2, у человека - в комплексе HLA.
Как установлено недавно, при процессинге эндогенных антигенов партнеры взаимодействия могут и физически, и функционально ассоциировать друг с другом. Например, новосинтезированные комплексы из молекул МНС класса I и β2-микроглобулина ассоциируют с ТАР в ЭР и диссоциируют после переноса из ЭР на цис-сторону комплекса Гольджи. Компартментация различных продуктов процессинга способствует, предположительно, наиболее эффективному накоплению антигенных пептидов в антигенпрезентирующей клетке.
Антигенные пептиды, перенесенные в ЭР, образуют комплексы с молекулами МНС класса I (рис. 9.25). Образование таких комплексов — это сложный процесс, в котором принимают участие белки-«шепероны» (т. е. спутники, помощники), такие как кальнексин. Шепероны инициируют и организуют сборку стабильного, транспортируемого на поверхность клетки комплекса, состоящего из тяжелой цепи класса I, β2-микроглобулина и антигенного пептида. В отсутствие антигенного пептида такие комплексы нестабильны, поэтому Т-клеткам могут быть представлены (презентированы) только комплексы, полностью функционально активные.
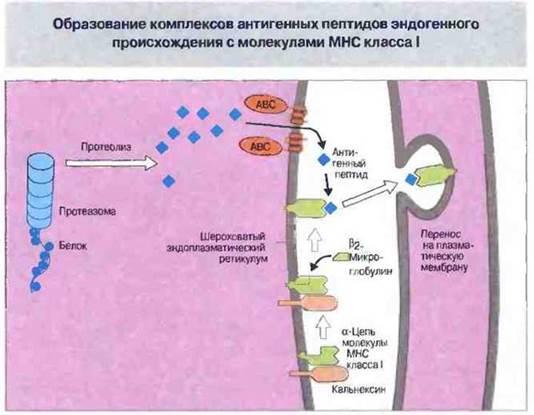
Рис. 9.25. Предполагаемая последовательность образования комплексов антигенный пептид - молекула МНС. Цитоплазматические антигены процессируются протеазомами, две субъединицы которых кодируются генами LMP2 и LMP7 из комплекса МНС. Перенос пептидов осуществляют два транспортных белка (из суперсемейства «АВС»), кодируемых генами ТАР1 и ТАР2, также относящимися к МНС. Антигенные пептиды образуют комплекс с тяжелыми цепями молекул МНС класса I и β2-микроглобулином в эндоплазматическом ретикулуме (ЭР). Молекулярные шепероны, такие как кальнексин, присоединяются к еще не полностью готовым комплексам антигенный пептид - молекула МНС класса I. После этого готовые комплексы транспортируются на поверхность клетки (рис. 9.26).
Молекулы МНС класса II образуют комплексы с антигенными пептидами экзогенного происхождения в эндосомах
α- и β-цепи молекул МНС класса II найдены в ЭР в виде комплексов с полипептидом, который был назван инвариантной цепью (Ii); этот бело к кодируется геном, не относящимся к МНС. Комплекс αβ-Ii транспортируется через аппарат Гольджи в эндосому или лизосому, где В кислой среде происходит освобождение Ii. На основании экспериментальных данных можно предполагал, что диссоциация Ii из αβ-комплекса позволяет антигенному пептиду занять ею место. Комплекс молекул МНС класса II с антигенным пептидом находится в эндосоме/лизосоме 1—3 ч, прежде чем поступает на клеточную поверхность.
Каким образом пептиды экзогенных антигенов встречаются с молекулами класса II в соответствующих клеточных органеллах? Для ответа на этот вопрос нужно рассмотреть пути внутриклеточных перемещений молекул МНС. После сборки комплексов в ЭР оба класса молекул МНС проходят через комплекс Гольджи — молекулы класса I в ассоциации с антигенными пептидами эндогенного происхождения и молекулы класса II, связанные с инвариантной цепью (Ц). Молекулы МНС одного класса отделяются от молекул другого на транс-стороне комплекса Гольджи. Затем молекулы класса II на пути к плазматической мембране попадают в особые эндосомы или лизосомы, которые отличаются от обычных тем, что, по-видимому, специально предназначены для накопления и транспорта этих молекул (рис. 9.26).
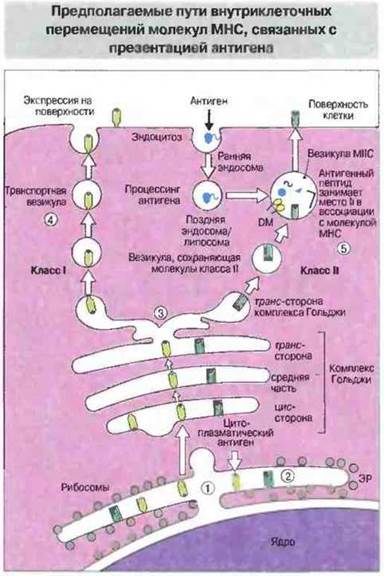
Рис. 9.26. Новосинтезированные молекулы класса I ассоциируют с антигенным пептидом (1). Молекулы класса II присоединяют цепи Ii в полости ЭР (2). Белок Ii препятствует ассоциации молекул класса II с антигенными пептидами и содержит последовательности, которые позволяют этим молекулам выйти из ЭР. Молекулы класса I и класса И разделяются после прохождения через комплекс Гольджи (3). Молекулы класса I направляются непосредственно к клеточной поверхности (4). Молекулы класса II поступают в кислотный компартмент - везикулы МНС, где образуют комплекс с пептидами антигенов экзогенного происхождения, после того как инвариантный пептид CLIP покинет пептидсвязывающую полость (5).
Главным достижением исследований последних лет стала идентификация клеточных органелл (везикул), в которых молекулы МНС класса II ассоциируют с антигенными пептидами. Эти везикулы, названные МПС, имеют сложную мембранную структуру (при электронной микроскопии она выглядит наподобие луковой кожуры) и обладают одновременно свойствами эндосом и лизосом.
Ключевая роль в образовании комплексов с антигенными пептидами принадлежит, как выяснилось, молекуле HLA-DM, сходной с молекулами класса II. Эта молекула состоит из α-цепи и β-цепи, кодируемых генами DMA и DMB (область класса II комплекса HLA). У линий мутантных клеток, лишенных этих генов, молекулы класса II нестабильны, а сами эти клетки не способны процессировать и презентировать белковые антигены. Когда из таких мутантных клеток были выделены молекулы класса II, а затем проанализированы связанные с ними пептиды, оказалось, что в основном это инвариантный полипептид, CLIP (от англ. class II associated invariant peptide). Как установлено, HLA-DM катализирует диссоциацию CLIP из комплекса с молекулой класса II в кислой среде in vitro, открывая возможность связывания с ней пептидов экзогенного происхождения.
По всей вероятности, экзогенный антиген попадает в антигенпрезентирующие клетки путем опосредованного рецепторами или жидкофазного эндоцитоза. Ферментативное расщепление эндоцитированных белков происходит в эндосомах или лизосомах, и образовавшиеся пептиды связываются с молекулами класса II при участии HLA-DM в качестве катализатора. После этого новообразованный комплекс направляется к поверхности клеток.
Вопросы для размышления
■ Что означает термин эпитоп? Каковы размеры эпитопа? Могут ли эпитопы перекрывать друг друга? В какой части молекулы белкового антигена вероятнее найти эпитопы? Какие типы аминокислотных остатков обычно входят в состав эпитопов?
■ Если имеются моноклональные антитела к антигену известной структуры, как можно определить ту часть антигена, которую эти антитела распознают?
■ Представляет ли собой специфичность антител точно измеряемую характеристику для данного образца или она зависит от физиологических и экспериментальных условий, в которыхвыявляется действие антител?
■ Большей ли специфичностью к антигену обладают моноклональные антитела по сравнению с поликлональной антисывороткой?
■ Презентируется ли антигенный пептид в комплексе с молекулами МНС класса I или класса II, зависит не от его структуры, а от типа внутриклеточных органелл, в которых он встречается с соответствующей молекулой МНС. Каковы преимущества такого механизма презентации антигена для функционирования иммунной системы?
■ Каким образом знание механизмов презентации антигена может помочь при конструировании пептидных вакцин?
■ Какое влияние на процесс презентации антигена могут оказывать мутации или модификации генов ТАР или LMP?
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Amigorena S., Drake J. R., Webster P. et al. 1994. Transient accumulation of new class II MHC molecules in a novel endocytic compartment in В lymphocytes. Nature 369: 113-120.
Benaroch P., Villa M., Raposo G. etal., 1995. How MHC class II molecules reach the endocytic pathway. EMBOJ. 14: 37-49.
Burton D. R. Structure and function of antibodies. In: Calabi F. Neuberger M.S., eds. Molecular Genetics of Immunoglobulin. Amsterdam: Elsevier Science Publishers: 1987: 1-50.
DeFranco A. L. 1993. Structure and function of the В cell antigen receptor. Annu. Rev. Cell Biol. 9: 377-410.
Demotz S., Grey H. M., Appella E. et al. 1989. Characterization of naturally processed MHC class II-restricted T-cell determinant of hen egg lyzosym. Nature 9: 377-410.
Denzin L. K., Creswell P. 1995. HLA-DM induces CLIP dissociation from MNC class II αβ dimers and facilitates peptide loading. Ce//82: 155-165.
Falk K., Rotzschke O., Stevanovic S. et al. 1991. Allele-specific motifs revealed by sequencing of selfpeptides eluted from MHC molecules. Nature 351: 290-296.
Fling S. P., Arp B., Pious D. 1994. HLA-DMA and -DMB genes are both required for MHC class II/peptide complex formation in antigen-presenting cells. Nature 368: 544-558.
Germain R. N. 1994. МНС-dependent antigen processing and peptide presentation providing ligands for T lympocyte activation. Cell 76: 287-299.
Getzoff E. D., Tainer J. A., Lerner R. A. 1988. The chemistry and mechanism of antibody binding to protein antigens. Adv. Immunol. 43: 1-98.
Hammer J., Valsasnim P. Tolba K. et al. 1993. Promiscuous and allele-specific anchors in HLA-DR-binding peptides. Cell 74: 197-203.
Hemmels M. T., Ploegh H. 1995. Generation, translocation and presentation of MHC class I-restricted peptides. Annu. Rev. Biochem. 64: 463-91.
Hunt D. G., Henderson R.A., Shabanowitz J. etal. 1995. Characterization of peptides bound to the class I MHC molecule HLA-A2. 1 by mass spectrometry. Science 255: 1261-1263.
Jardetzky T. S., Lane W. S. Robinson R. A. et al. 1991. Identification of self-peptides bound to purified HLA- B27. Nature 353: 326-329.
Madden D. 1995. The three dimensional structure of peptide-MHC complexes. Anna. Rev. Immunol. 13: 587-622.
Miyazaki T., Wolf P., Tourne S. etal. 1996. Mice lacking H2-M complexes: enigmatic elements of the MHC class II peptide-loading pathway. Cell 84: 531-541.
Morris P., Shaman J., Attaya M. et al. 1994. An essential role for HLA-DM in antigen presentation by class II major histocompatibility molecules. Nature 368: 551-554.
Neefjes J. J., Stollorz V., Peters P. J. et al. 1990. The biosynthetic pathway of MHC class II but not class I moleculws intersects the endocytic route. Cell 61: 171-183.
Roy S., Scherer M. T., Briner T. J. et al. 1989. Murine MHC polymorphism and T cell specificities. Science 244: 572-575.
Rudensky A., Preston H. P., Hong S. C. et al. 1991. Sequence analysis of peptides bound to MHC class II molecules. Nature 353: 660-662.
Tulp A., Verwoerd D., Dobberstein B. et al. 1994. Isolation and characterization of the intracellular MHC class II compartment. Nature 369: 120-126.
Wiliams D. B., Vassilakos A., Suh W. K. 1996. Peptide presentation by MHC class l molecules. Trends Cell. Biol. 6: 267-273.
York I. A., Rock K. L., 1996. Antigen processing and presentation by the class I major histocompatibility complex. Annu. Rev. Immunol. 14: 369-396.