ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 10. Реакции клеточного иммунитета
СЕТЕВЫЕ ВЗАИМОДЕЙСТВИЯ ЦИТОКИНОВ
Цитокины вступают в сложные сетевые взаимодействия
Как можно разобраться в сложной сети взаимодействий одних цитокинов с другими и понять роль каждого из них в организме? Наиболее эффективным инструментом для этого служит применяемый на мышах молекулярно-генетический метод «генного нокаута» — разрушения гена того или иного цитокина либо его рецептора. В таблице на рис. 10.27 перечислены важнейшие факты, полученные благодаря использованию этого метода, в частности для анализа механизмов иммунитета и воспаления. Так, он позволил выяснить, что определенные цитокины, например ИЛ-7. ФНОα и ФИОβ (называемый также лимфотоксином), существенно важны для формирования иммунной системы в период внутриутробного развития. Последствия устранения других цитокинов, в частности ИЛ-2, ИЛ-4, ИЛ-12 и ИФγ, проявляются ярче всею, когда животное испытывает вызванный инфекцией «стресс». На мышах, лишенных гена ИЛ-12. было установлено значение этого цитокина для продукции ИФγ и развития реакций гиперчувствительности замедленного типа (ГЗТ). Разрушение некоторых цитокиновых генов вызывает у мышей поражения, напоминающие воспалительные заболевания слизистой оболочки кишечника у человека, еще раз подтверждая тот факт, что она представляет собой ту ткань организма, которая с наибольшим постоянством испытывает антигенные воздействия. Доказательством противовоспалительной роли ТФРβ служит то, что у лишенных его мышей образуется множество очагов воспаления. Выраженная иммунологическая недостаточность у мышей, не экспрессирующих γ-цепь рецептора к ИЛ-2, свидетельствует, что эта цепь служит обшей сигнальной субъединицей в составе ряда цитокиновых рецепторов.
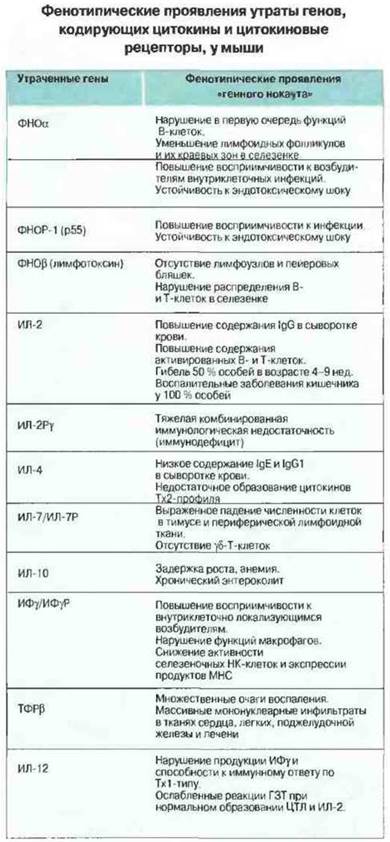
Рис. 10.27. Результаты экспериментов на мышах, избирательно лишенных соответствующих генов (генный нокаут). ЦТЛ - цитотоксические Т-лимфоциты; ГЗТ- гиперчувствительность замедленного типа, представляющая собой преимущественно Тх1-регулируемую воспалительную реакцию на антиген, введенный внутрикожно.
Все эти факты следует интерпретировать с известной осторожностью. Так, нельзя правильно оценить роль конкретного цитокина в организме зрелой особи, если его отсутствие в период развития иммунной системы привело к иммунологической недостаточности. Однако представляется вполне вероятным, что каждый цитокин при всем многообразии своих функций имеет среди них одну или несколько специфических, в связи с которой он сохранился в промессе эволюции.
На мышах, лишенных соответствующих генов, можно также выяснить функциональное значение ферментов Jak и Slat (см. выше). Например, дефицитные по Star-1 мыши чрезвычайно восприимчивы к вирусным инфекциям; у них нарушено образование ИФα и ИФγ, а также оксида азота NО в макрофагах, и противоинфекционной иммунный ответ развивается по Тх2-типу. Мыши, гомозиготные по делении гена Jak-1, в отличие от Stat-дефицитных, погибают сразу после рождения. Они не способны питаться, у них нарушен ответ клеток на ИЛ-7 и не образуются лимфоциты всех популяций. Фенотипически это состояние напоминает тяжелый комбинированный иммунодефициту мыши и человека.
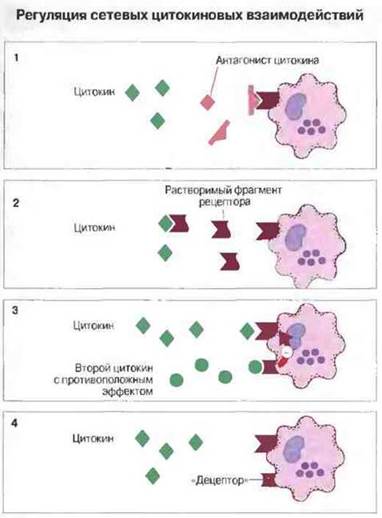
Рис. 10.28. Регуляция взаимодействий в цитокиновой сети.
1. Молекулы, гомологичные данному цитокину и способные связываться со специфическим клеточным рецептором, не вызывая передачи сигнала внутрь клетки, действуют как его конкурентные ингибиторы. Уже клонирован ген такого ингибитора - антагониста ИЛ-1. Ингибиторами могут быть и гликозилированные варианты некоторых цитокинов.
2. Внеклеточные домены рецепторов для ФНО и ИЛ-1 могут отщепляться и связываться с соответствующими цитокинами вне клеток, предотвращая тем самым их связывание с рецепторами на клеточных мембранах.
3. Одни цитокины, взаимодействуя со своими рецепторами, могут оказывать на клетку действие, противоположное эффектам других цитокинов, также взаимодействующих со своими специфическими рецепторами (см. рис. 10.7).
4. Некоторые клетки экспрессируют молекулы-децепторы, которые связывают цитокины, но без эффекта клеточной активации.
Регуляция сетевых цитокиновых взаимодействий in vivo имеет ряд особенностей (рис. 10.28).
✵ Образование индивидуальных цитокинов происходит кратковременно и находится пол жестким контролем.
✵ Разные цитокины действуют как синергисты или антагонисты.
✵ Каждый из цитокинов может индуцировать или ингибировать продукцию других цитокинов.
✵ Каждый из цитокинов способен регулировать экспрессию клеточных рецепторов для самого себя и для других цитокинов.
✵ Антагонисты цитокинов связываются со специфическими клеточными рецепторами, но не вызывают передачу внутриклеточного сигнала.
✵ «Децепторы» специфически связывают лиганд, но не передают сигнал внутрь клетки.
✵ Благодаря ферментативному отщеплению внеклеточные домены цитокиновых рецепторов могут покидать поверхность клетки и связываться со свободными молекулами многих цитокинов (рис. 10.29): их можно обнаружить в сыворотке и моче.
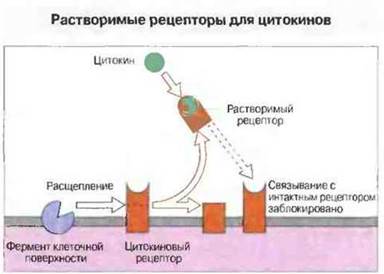
Рис. 10.29. Растворимый рецептор, связывающийся с цитокином, - это отщепленный ферментом внеклеточный домен мембранного рецептора, например для ФНО (ФНОР-1 [р55]), ИФγ, ИЛ-6 или ИЛ-2. Растворимые рецепторы для ФНО (и, возможно, для других цитокинов) сохраняют высокую аффинность в отношении своих лигандов и благодаря этому способны нейтрализовывать ФНО, препятствуя его доступу к интактным мембранным рецепторам, Если же ФНО свяжется с одним из неспецифических растворимых рецепторов (например, с фрагментом ИЛ-6Р), возникший комплекс может затем связаться с каким-то другим мембранным рецептором и все же вызвать сигнальный эффект.
Интенсивность синтеза цитокинов до и после его стимуляции может быть также запрограммирована на генетическом уровне. Например, носители определенных аллелей генов ФНОα и ИЛ-1β часто страдают некоторыми хроническими воспалительными заболеваниями, что, возможно, обусловлено наследственными особенностями продукции цитокинов.
Сетевыми взаимодействиями цитокинов обусловлено множество физиологических эффектов
В путях эволюции и функционировании иммунной и нервной систем можно найти много общего. Например, обе эти системы за счет межклеточной коммуникации обладают способностью к обучению и хранению памяти; кроме того, среди их компонентов много общих медиаторов, рецепторов и антигенов. Для функционирования обеих систем требуется внутренняя коммуникационная сеть, а также сеть, которая обеспечивает регуляцию и взаимодействие с другими органами. Посылая сигналы на периферию, центральная нервная система непосредственно «телеграфирует» по нервным стволам и волокнам почти во все органы и ткани, а также использует ось гипоталамус—гипофиз—надпочечники. В противоположность этому иммунная система, состоящая главным образом из подвижных, свободных клеток, осуществляет внутрисистемные связи на основе взаимодействия этих клеток между собой. В то же время с другими органами и тканями она связана прежде всего посредством цитокинов, но следует подчеркнуть, что эти ее регуляторные воздействия всегда локальны, а не системны. Интеграция иммунной системы с нервной и эндокринной увеличивает ее влияние на организм (см. гл. 13). Например, такие цитокины, как ИЛ-1, ФНОα и ИЛ-6, непосредственно воздействуют на гипоталамус или гипофиз. Наряду с этим различные клетки иммунной системы экспрессируют рецепторы для нейромедиаторов, опиатов и нейропептидов.
Функциональные свойства биохимически охарактеризованных цитокинов приведены в приложении 3. Не следует, однако, забывать, что в тех случаях, когда функциональная активность цитокинов выявлена только в экспериментах in vitro, она необязательно осуществляется в физиологических условиях in vivo.
Вопросы для размышления
■ Каким образом от первичного распознавания возбудителя зависит тип эффекторного механизма в реализуемом позже иммунном ответе?
■ Как эпитопы, презентированные молекулами МНС класса I, которые экспрессированы на поверхности почти всех содержащих ядро клеток, распознаются большинством цитотоксических Т- клеток?
■ Каким образом цитотоксические Т-клетки CD8+ и НК-клетки функционально дополняют друг друга?
■ Может ли дисбаланс соотношения Тх1/Тх2 вызывать в тканях опосредованное клетками хроническое повреждение иммунопатологического характера?
■ Применяемый на мышах метод генного нокаута - избирательного разрушения генов определенных цитокинов - полезен для расшифровки цитокиновой сети и выявления молекул, участвующих во внутриклеточной сигнализации. Каковы его недостатки?
■ Индукция цитокинами каскадной внутриклеточной передачи сигнала возможна, по-видимому, в результате как их специфического, так и плейотропного действия. Может ли при этом каждыйиз цитокинов проявить свою собственную уникальную функцию или для этого дополнительно требуется экспрессия специфичного к нему клеточного рецептора?
■ Цитокины относятся по меньшей мере к трем крупным молекулярным семействам: представители первого специфически связываются с молекулами суперсемейства ФНО-рецепторов, второе семейство - это альфа-интерфероны, третье - хемокины. Возможно ли, что существование столь крупных семейств цитокинов - это просто результат эволюции без отбора, или их многочисленность имеет функциональное значение?
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Akira S., Taga Т., Kishimoto Т. 1993. Interleukin-6 in biology and medicine. Adv. Immunol. 54: 1-78.
Bannaga M. Life-death balance within the cell. 1996. Science 274: 724.
Bazan J.F. 1990. Structural design and molecular evolution of a cytokine receptor superfamily. Proc. Natl. Acad. Sci. USA 87 6934-6938.
Bretscher P.A.. Wei G., Menon J.N. et al. 1992. Establishment of stable, cell-mediated immunity that makes «susceptible» mice resistant to Leishmania major. Science 257: 539-542.
Carter L.L., Dutton R.W. 1996. Type 1 and type 2 a fundamental dichotomy for all T cell subsets. Curr. Opin. Immunol. 8: 336- 342.
Cerami A., Beutler B. 1988. The role of cachectin/TNF in endotoxin shock and cachexia. Immunol. Today 9: 28-31.
Cohen M.C., Cohen S. 1996. Cytokine function. Astudy in biologic diversity. Am. J. Clin. Pathol. 105: 589-598.
Cooper A M., Dalton D.K., Stewart T.A. et al. 1993. Disseminated tuberculosis in interferon gamma gene-disrupted mice. J. Exp. Med. 178: 2243-2247.
Grzych J.M., Pearce E., Cheever A. et al. 1991. Egg deposition is the stimulus for production of Th2 cytokines in murine schistosomiasis mansoni. J. Immunol. 146: 1322-1340.
Horuk R. 1994. The interleukin-8-receptor family: from chemokines to malaria. Immunol. Today 15: 169-174.
Ihle J.N. 1995. Cytokine receptor signalling. Nature 377. 591-594.
Kagi D., Ledermann B., Burki K. et al. 1994. Cytotoxicity mediated by T cells and natural killer cells is greatly impaired in perforin-deficient mice. Nature 369: 31-37.
Kaufmann S.H. 1993. Immunity to intercellular bacteria. Annu. Rev. Immunol. 11: 129-163.
Kishimoto T., Taga T., Akira S. 1994. Cytokine signal trancduction. Cell 76: 253-262.
Lanier L.L., Phillips J.H. 1996. Inhibitory MHC class I receptors on NK cells and T cells. Immunol. Today 17. 86-91.
Lukacs N.W., Boros D.L. 1993. Cytokine regulation of granuloma formation in murine schistosomiasis mansoni. Clin. Immunol. Immunopathol. 68: 57-63.
Male D.K. 1996. Cytotoxic cells. In: Male D.K., Cooke A., Owen M. et al. (eds). Advanced Immunology, 3rd edn. Ch 15: London: Mosby. 15: 1-13.
Minami Y., Kono T., Miyazaki T. et al. 1993. The IL-2 receptor complex: its structure, function, and target genes. Annu. Rev. Immunol. 11: 245-268.
Mosmann T.R., Coffman R.L. 1989 Different patterns of cytokine secretion lead to different functional properties. Annu. Rev. Immunol. 7: 145-173.
Mosmann T.R., Sad S. 1996. The expanding universe of T-cell subsets: Th1, Th2 and more. Immunol. Today 17: 137-146.
Nathan C.F., Murray H.W., Wiebe M.E. et al. 1983. Identification of interferon-yes the cytokine that activates human macrophage oxidative metabolism and antimicrobial activity. J. Exp. Med. 158: 670-689.
Romagani S. 1995. Biology of human Th1 and Th2 cells. J. Clin. Immunol. 15: 121-129.
Rook G.A.W., Hernandez-Pando R., Ughtman S. 1994. Hormones, peripherally activated prohormones, and regulation of the Th1/Th2 balance. Immunol. Today 15: 301-303.
Seder R.A., Paul W.E. 1994. Acquisition of lymphokine-producing phenotype by CD4+T cells. Annu. Rev. Immunol. 12: 635-673.
Smith H.R., Karlhofer F.M., Yokoyama W.M. 1994. Ly-49 multigene family expressed by IL-2-activated NK cells. J. Immunol. 153: 1068-1079.
Trinchieri G. 1993. Interleukin-12 and its role in the generation of Th1 cells. Immunol. Today 14. 335-338.
Vassalli P. 1992. The pathophysiology of tumour necrosis factor. Annu. Rev. Immunol. 10. 411-452.
Wells J.A., de Vos A M. 1996. Hematopoietic receptor complexes. Annu. Rev. Biochem. 65: 609-634.