ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 11. Взаимодействие клеток при гуморальном иммунном ответе
■ Иммуноактивация, необходимая для синтеза антител, включает взаимодействие между Т-клетками и АПК и затем между этими гримированными Т-клетками и В-клетками.
■ Активация клеток осуществляется путем антигенспецифичного взаимодействия с участием молекул клеточной адгезии и цитокинов. Наиболее сильным костимулирующим сигналом служит молекула В7 (CD80 или CD86). В отсутствие соответствующей костимуляции распознавание антигена может привести к развитию клональной анергии.
■ Пролиферация лимфоцитов происходит опосредованно, т. е. зависит от индукции рецепторов для факторов роста лимфоцитов, которую вызывает активация. Факторы роста лимфоцитов(например ИЛ-2) синтезируются главным образом Т-клетками.
■ Существуют два типа антигенов, вызывающих гуморальный иммунный ответ - Т-зависимые и Т-независимые. Т-зависимые антигены индуцируют вторичный иммунный ответ, характеризующийся образованием IgG и повышением аффинности антител.
■ Для первичного иммунного ответа на Т-зависимые антигены характерно образование низкоаффинных IgM-антител. При вторичном иммунном ответе продуцируется большее количество антител и происходит переключение изотипов с образованием IgG, IgA и IgE. Одновременно с этим возрастает аффинность антител.
■ Переключение изотипа и повышение (созревание) аффинности антител происходят в центрах размножения внутри вторичных лимфоидных тканей.
Гуморальный иммунный ответ (образование антител) представляет собой кульминацию ряда клеточных и молекулярных взаимодействий, происходящих в определенной последовательности:
✵ Т-клетки распознают антиген, представленный им антигенпрезентируюшими клетками (АПК), и в результате переходят в активированное состояние;
✵ Тх-клетки взаимодействуют с В-клетками, которые презентируют им антигенные фрагменты;
✵ активированные В-лимфоииты пролиферируют и дифференцируются в антителообразующие клетки;
✵ начинается синтез антител и от их класса зависит характер последующего иммунного отпета.
В настоящей главе рассмотрены процессы презентации антигенов и взаимодействия Т- и В-клеток, некоторые наиболее важные из участвующих в этом молекул, а также вызванные этими взаимодействиями события, в том числе переключение класса иммуноглобулинов, повышение (созревание) аффинности антител и развитие иммунологической памяти.
ПРЕЗЕНТАЦИЯ АНТИГЕНА Т-КЛЕТКАМ
Процессинг антигена
В пионерских исследованиях Эйде и Носсела было установлено, что лишь очень небольшая доля молекул (<1%) введенного антигена принимает участие в индукции иммунного ответа, а основное его количество быстро разрушается и выводится из организма. Эти данные позволяют предполагать, что презентация антигена является этапом, лимитирующим скорость иммунной реакции.
Проникшие в организм антигены подвергаются внутриклеточному процессингу — расщеплению на пептидные фрагменты, которые затем связываются с молекулами МНС класса I или II (см. гл. 9). Эти фрагменты определяют антигенспецифичную активацию Т-клеток: рецепторы Т-клеток распознают аминокислотные последовательности этих фрагментов, связываемых в полости молекул МНС (в отличие от этого антитела распознают конформационные детерминанты).
Взаимодействие с антигенпрезентирующими клетками крайне важно для активации Т-лимфоцитов
Взаимодействие между Т-лимфоцитами и клетками, составляющими гетерогенную группу так называемых «антигенпрезентируюших клеток», - это наиболее детально изученный пример клеточной кооперации в иммунной системе. Взаимодействие Т-клеток и АПК после введения антигена открывает всю последовательность дальнейших событий и в основном определяет их конечный результат: если активируется достаточное число хелперных Т-клеток (Тх) CD4+, то почти всегда происходит активация В-клеток или развитие реакций клеточного иммунитета; если же стимуляция Тх-клеток отсутствует, может возникнуть та или иная форма иммунологической толерантности (см. гл. I4), при которой дальнейшие иммунные реакции не развиваются.
Существуют различные типы АПК
Презентировать антигены могут самые разнообразные клетки, в зависимости от того, как и где происходит первичное взаимодействие антигена с иммунной системой (рис. 11.1). Наиболее эффективно начальную активацию покоящихся Т-клеток CD4+обеспечивают интердигитатные дендритные клетки (ИДК), присутствующие в изобилии в Т-клеточных зонах лимфатических узлов и селезенки. Дня ИДК характерен высокий уровень экспрессии МНС-антигенов класса II, которые взаимодействуют с Т-клеточным рецептором (ТкР) и молекулой CD4 на поверхности Тх CD4+. Однако макрофаги и В-клетки также могут экспрессировать МНС-антигены класса II, поэтому объяснить большую эффективность ИДК в презентации антигенов только этим свойством невозможно.
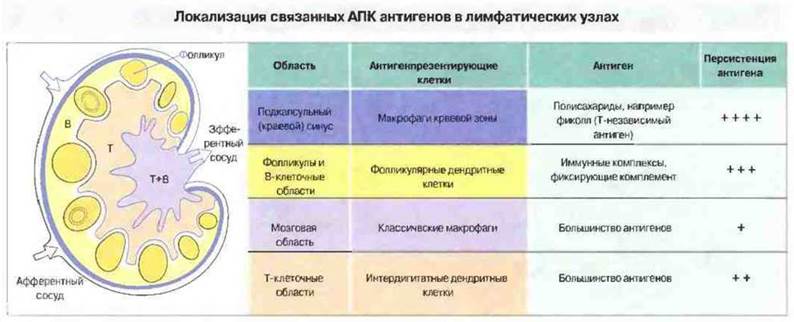
Рис. 11.1. Схема строения лимфатического узла. Показаны афферентный (приносящий) и эфферентный (выносящий) лимфатические сосуды, наружная кортикальная В-клеточная область и паракортикальная Т-клеточная область. В этих областях преобладают различные антигенпрезентирующие клетки (хотя граница не является абсолютной), избирательно захватывающие антигены разных типов, которые персистируют на клеточной поверхности в течение того или иного периода. Так, многие полисахаридные антигены захватываются преимущественно макрофагами краевой зоны; эти антигены могут присутствовать на макрофагах месяцы и годы. В отличие от этого антигены на рециркулирующих макрофагах мозгового слоя сохраняются лишь несколько дней или недель. Следует отметить, что рециркулирующие клетки Лангерганса, первичным источником которых служит кожа, в лимфатических узлах изменяют свою морфологию, становясь интердигитатными дендритными клетками. Как и фолликулярные дендритные клетки, они имеют длинные отростки, тесно контактирующие с лимфоцитами.
Как предполагается, интердигитатные клетки это главный тип антигенпрезентируюших клеток, действующих при первичном иммунном ответе, поскольку они индуцируют пролиферацию Т-клеток эффективнее АПК всех других типов. Именно клеточная пролиферация служит ключевым этапом в развитии иммунного ответа, обеспечивая увеличение числа антигенспецифичных Т-клеток, однако это лишь одна сторона эффективной активации Т-лимфоцитов. Способностью индуцировать и пролиферацию, и хелперную функцию Т-клеток обладают также моноциты крови (наиболее изученные АПК у человека).
В качестве АПК могут действовать и В-клетки — они способны связывать, интернализовать и расщеплять специфический антиген на пептиды, которые образуют комплекс с молекулами МНС класса II. При очень низкой концентрации антигена В клетки с высокоаффинными антигенными рецепторами (IgM или IgD) служат наиболее эффективными АПК, поскольку другие типы АПК просто не могут захватить достаточное для презентации количество антигенного материала. При вторичном иммунном ответе (протекающем с участием большого числа антигенспецифичных В-клеток). В-клетки могут стать главным типом АПК. Свойства и функции АПК представлены на рис. 11.2 и 11.3.
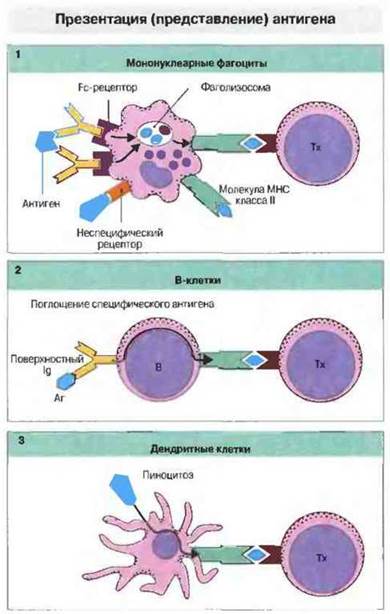
Рис. 11.2. Мононуклеарные фагоциты (1), В-клетки (2) и дендритные клетки (3) могут презентировать антиген хелперным Т-клеткам (Тх), рестриктированным по антигенам МНС класса II. Макрофаги поглощают антиген с помощью неспецифических рецепторов или в виде иммунных комплексов и процессируют его, после чего образующиеся антигенные фрагменты возвращаются на поверхность клетки в ассоциации с молекулами класса II. Активированные В-клетки могут захватывать антиген посредством своих поверхностных иммуноглобулинов, затем поглощать его и презентировать в комплексе с молекулами класса II. Дендритные клетки конститутивно экспрессируют молекулы класса II и поглощают антиген путем пиноцитоза.
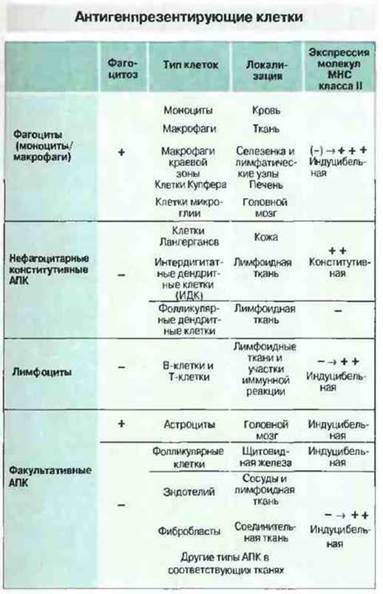
Рис. 11.3. Многие АПК не способны фагоцитировать антиген, однако могут поглощать его другими способами, например путем пиноцитоза. Эндотелиальные клетки, которые обычно не рассматриваются как АПК, под действием ИФγ экспрессируют молекулы класса II и могут презентировать антигены, как и некоторые эпителиальные клетки. Другим подобным примером служат фолликулярные клетки щитовидной железы, функционирующие как АПК в аутоиммунном процессе при болезни Грейвса.
Презентацию антигена Т-клеткам обеспечивает взаимодействие множества молекул клеточной поверхности
Т-клеточный рецептор (ТкР) - димер, состоящий из α-цепи и β-цепи, — распознает специфический пептид, находящийся в пептидсвязывающей полости молекулы МНС. Это связывание является определяющим для иммунологическом специфичности, так как пептид, ассоциированный с МНС-молекулой определенного гаплотипа, образует уникальную структуру, распознаваемую ТкР. Однако в презентации участвуют и другие молекулы. Доказательство этого получено в экспериментах с трансфекцией комплементарной ДНК (кДНК), кодирующей молекулы МНС человека, в мышиные фибробласты. Клетки мыши, экспрессируя молекулы МНС человека, приобретали способность функционировать как АПК человека, но менее эффективно по сравнению с клетками, которые экспрессировали также и другие связанные с презентацией молекулы. Одной из таких молекул служит молекула 1 межклеточной адгезии (ICAM-I, от англ. intercellular adhesionmolecule-1), взаимодействующая с функциональным антигеном I лимфоцитов (LFA-I, от англ. lymphocyte functional antigen-1), имеющимся у вcex клеток иммунной системы. Если в мышиные клетки трансфицировать гены как МНС, так и ICAM-I человека, способность этих клеток действовать в качестве АПК человека возрастает. Обнаружены и другие эффективные костимулирующие молекулы, взаимодействующие с лигандами на поверхности Т-клеток (рис. 11.4).
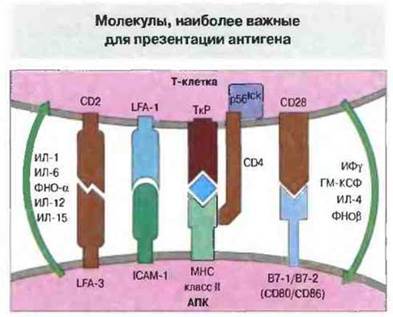
Рис. 11.4. Молекулы, принимающие участие во взаимодействии между Т-клетками и АПК. Показаны также различные цитокины и направленность их действия.
Наиболее эффективные костимулирующие молекулы из числа известных - это B7-1 (CD80) и В7-2 (CD86). Они конститутивно экспрессируются ИДК, но возможна также стимуляция их экспрессии на моноцитах, В-клетках и, вероятно, других АПК. Обе молекулы служат лигандами для антигена CD28 и его гомолога CTLA-4, экспрессию которого вызывает Т-клеточная активация. Стимулирующий эффект CD28 состоит в продлении и усилении продукции ИЛ-2 и других цитокинов; эта стимуляция, по-видимому, имеет также существенное значение для предотвращения индукции толерантности. Несмотря на то что взаимодействие CD28-B7 крайне важно, нокаутные (см. гл. 10) мыши, лишенные гена CD28, все же реагируют на антиген, хотя для этого требуется большее его количество. Следовательно, стимуляция CD28 не обязательна для активации лаже непримированных Т-клеток. Возможно, у лишенных CD28 мышей роль CD28/B7 в качестве костимулируюшего сигнала выполняют другие сигнальные молекулы.
Альтернативным лигандом для В7 служит CTLA-4 - ингибирующий рецептор, который ограничивает Т-клеточную активацию. Таким образом, вначале молекула CD28, экспрессируемая конститутивно, взаимодействуете В7, что ведет к активации Т-клеток, однако вызванная активацией экспрессия молекулы CTLA-4, обладающей более высокой аффинностью, лимитирует степень активации, так как имеющийся антиген В7 взаимодействует теперь с CTLA-4 (рис. 11.5). О значении этой молекулы свидетельствует тот факт, что у лишенных CTLA-4 мышей развивается агрессивное лимфопролиферативное расстройство. обусловленное отсутствием эффективной инактивации делящихся Т-клеток.
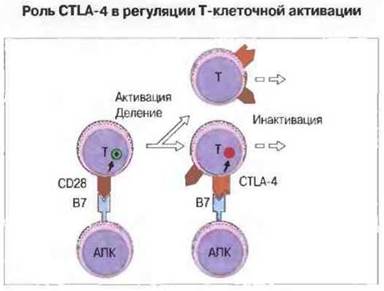
Рис. 11.5. Неактивированные Т-клетки экспрессируют молекулу CD28, которая связывается с В7-1 и В7-2 на антигенпрезентирующих клетках (например, В-лимфоцитах). После активации Т-клетки начинают экспрессировать альтернативный высокоаффинный лиганд для В7 - CTLA-4. Этот лиганд связывает В7, после чего Т-клетки уже не принимают сигнал активации.
В активации Т-клеток наряду с ТкР участвует молекула CD2 Т-клеточной поверхности — рецептор функционального антигена 3 лимфоцитов (LFA-3), который несут многие клетки и все АПК. Присутствием LFA-3 на эритроцитах барана обусловлена реакция розеткообразования (Е-розетки), которую широко использовали для получения очищенной фракции Т-клеток до того, как в практику исследований были введены моноклональные антитела.
Сигнал, индуцируемый молекулами, подобными В7, которые усиливают сигнал от ТкР и индуцируют положительную активацию Т-клеток, получил наименование «второй сигнал». Без такого сигнала покоящиеся Т-клетки не могут реагировать оптимально и. если распознают специфический антиген в отсутствие второго сигнала, инактивируются: возникает состояние иммунологической толерантности. Эта толерантность специфична, поскольку выпадает функция только тех Тх-клеток, которые реагируют на данный антиген. Толерантность, не связанная с гибелью, известна как «клональная анергия».
Помимо молекул, экспрессированных на поверхности клеток, в Т-клеточной активации участвуют действующие локально цитокины. Особый интерес представляют ИЛ-1 и ИЛ-6 — цитокины, продуцируемые АПК, в том числе макрофагами. Стимуляция Т-клеток этими агентами не всегда бывает необходимой, как например в том случае, если Т-клетки уже делятся. Действуя на покоящиеся Т-лимфоциты, ИЛ-1 и ИЛ-6 индуцируют экспрессию рецепторов для фактора роста Т-клеток, ИЛ-2. Большое значение для Т-клеточной активации имеет также ИЛ-12, который способствует повышению продукции ИФγ, направляя тем самым развитие «необученных» Т-клеток по пути превращения их в Тх1-лимфоциты. Антигенпрезентирующие клетки продуцируют ИЛ-15, также способный индуцировать Т-клеточную пролиферацию и весьма важный в тот период, когда еще не начался синтез ИЛ-2.
Взаимодействие между Т-клетками CD4+и АПК изучено довольно подробно, тогда как сведений об аналогичном процессе с участием Т-лимфоцитов CD8+и АПК еще мало. Известно, что клетки CD4+ функционируют как хелперные при активации Т-клеток CD8+. Поскольку одна интердигитатная дендритная клетка может связываться со многими Т-лимфоцитами, было высказано предположение, что активация происходит в кластерах, образуемых клетками CD4+и СD8+ на поверхности ИДК.
Презентация антигена влияет на последующее развитие иммунного ответа
Антигенпрезентирующие клетки могут быстро активироваться в самом начале иммунного ответа, например микробными продуктами или некоторыми вирусами, которые иммуногенны сами по себе, либо под влиянием адъювантного компонента вакцины. Осуществляемая ими презентация антигена не является однонаправленным процессом. Как только Т-клетки активируются, они выделяют цитокины, в частности ИФγ и ГМ-КСФ, которые наряду с сигнальными молекулами клеточной поверхности, такими как лиганд CD40, усиливают антигенпрезентирующую функцию. У активированных АПК повышается экспрессия молекул МНС классов I и II, Fc-peцепторов и костимулируюших молекул адгезии, включая В7-1, В7-2, CD11a/b/c, ICAM-1 и IСАМ-3. Они продуцируют также многочисленные цитокины (например ИЛ-1, ИЛ-6, ФНОα), ферменты и другие медиаторы.
Активация лимфоцитов ведет к возникновению двух частично конкурирующих процессов: клеточной пролиферации и дифференцировки в клетки-эффекторы. На конечной стадии дифференцировки клетки (например, плазматические) становятся настолько специализированными, что утрачивают поверхностные молекулы, например МНС класса II, и способность отвечать на регуляторные сигналы или пролиферировать.
Судьба лимфоцитов, реагирующих на антиген, может быть разной. Некоторые из них персистируют в течение длительного времени как клетки иммунологической памяти. Возможная продолжительность их жизни у человека превышает 40 лет, что было установлено по хромосомным аномалиям клеток крови (например, по наличию перекрестных сшивок ДНК, препятствующих митозу) у людей, переживших атомную бомбардировку Хиросимы. Срок жизни других лимфоцитов невелик, и этим объясняется тот факт, что умеренная антигенная стимуляция не приводит к гипертрофии лимфоидной ткани. Тем не менее такой срок жизни реагирующих на антиген лимфоцитов достаточен для развития эффективных клеточных и гуморальных иммунных ответов. Накапливается все больше данных о том, что элиминация клеток, уже не нужных после завершения иммунного ответа, происходит путем апоптоза.