ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 14. Иммунологическая толерантность
ТОЛЕРАНТНОСТЬ, ИСКУССТВЕННО ВЫЗВАННАЯ IN VIVO
Толерантность in vivo можно индуцировать различными способами
Химеризм, ассоциированный с толерантностью. У реципиентов, нe обладающих иммунокомпетентностью, например у новорожденных животных или у взрослых особей, подвергнутых иммуносупрессивной обработке (путем общего облучения, введения лекарственных препаратов, в частности циклоспорина, или антилимфоцитарных антител — антилимфоцитарного глобулина, антител анти-СD4 и т. д.), толерантность можно вызвать введением атлогенных клеток. Для сохранения такой толерантности необходимо поддерживать определенный уровень химеризма (т. е. сосуществования генетически различающихся клетокдонора и реципиента). Наилучшим способом достижения этой цели служит пересадка трансплантата из клеток, способных к самообновлению (например, клеток костного мозга).
Если в атлогенном инокуляте имеются зрелые Т-клетки, они могут реагировать против антигенов гистосовместимости реципиента, индуцируя тяжелое и часто смертельное расстройство, известное как реакция трансплантат против хозяина.
Антитела против В-клеточных корецепторов индуцируют толерантность к трансплантату. Толерантность к трансплантированным тканям можно индуцировать при помощи моноклональных антител, направленных против Т-клеточных молекул CD4 и CD8 (антитела могуч быть двух типов — элиминирующие или не элиминирующие Т-клетки). В этом случае толерантность к аллогенному кожному трансплантату может быть получена в отсутствие клеточного химеризма.
Индукцию толерантности вызывают растворимые антигены. Толерантность можно индуцировать и у новорожденных и у взрослых животных, если применить растворимый белковый антиген в дезагрегированной форме. Существуют различия в чувствительности Т- и В-клеток к толерогенному действию таких антигенов. Так, толерантность Т-клеток селезенки и тимуса возникает уже через несколько часов после введения очень низких доз антигена. Толерантность В-клеток селезенки вызывают значительно более высокие дозы антигена и развивается она существенно медленнее (рис. 14.14). Концентрация антигена, необходимая для индукции В-клеточной толерантности у новорожденных, примерно в сто раз ниже его концентрации, требуемой для получения толерантности у взрослых особей.
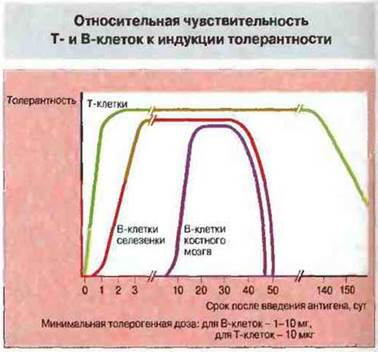
Рис. 14.14. Мышам вводили Т-зависимый антиген (глобулин человека) в толерогенных (вызывающих толерантность) дозах и определяли продолжительность толерантности. Т-клеточная толерантность развивалась быстрее и сохранялась дольше, чем В-клеточная. Состояние толерантности у В-клеток костного мозга возникало позднее, чем у В-лимфоцитов селезенки. Как правило, толерогенные дозы антигена для Т-клеток были значительно ниже, чем те же дозы для В-клеток - 10 мкг и 1-10 мг соответственно, что составляет 1000- кратное различие.
Иммунологическую толерантность индуцирует пероральное введение антигенов. Механизм возникновения толерантности при таком способе введения антигенов может быть различным. Высокие дозы антигенов могут вызывать анергию или делецию; здесь термин анергия означает состояние паралича клеток, предшествующее их гибели (см. выше). При более низкой дозе введенный таким способом антиген может примировать Т-клетки кишечника. Поскольку для эффективного антителообразования в кишечнике должно произойти переключение синтеза иммуноглобулинов на продукцию IgA, неудивительно, что пероральное введение антигена индуцирует появление Т-клеток, поддерживающих образование IgA-антител. Эти Тх2-подобные клетки секретируют цитокины, включая ИЛ-10 и ТФРβ (трансформирующий фактор роста β), и угнетают воспалительные реакции, опосредуемые Тх1-лимфоцитами. ТФРβ ингибирует пролиферацию и функции В-клеток, цитотоксических Т-клеток и НК-клеток, подавляет продукцию цитокинов лимфоцитами и противодействует эффектам ФИО. Хотя индукция Тх2-клеток в слизистой оболочке представляет собой антигенспецифичный процесс, супрессивное действие цитокинов, например ТФРβ, неспецифично. Поэтому индукция так называемой оральной толерантности к одному антигену может подавлять иммунный ответ на второй, ассоциированный с первым, антиген. Этот эффект «подавления свидетеля», оказываемый Тх2-лимфоцитами слизистой оболочки, позволяет осуществлять лечебное воздействие при комплексных органоспецифических аутоиммунных заболеваниях путем перорального введения какого-либо антигена из пораженной ткани.
Слизистые оболочки других органов, как установлено, столь же эффективно обеспечивают антигенспецифическую толерантность. Интраназальное применение пептидов, рестриктированных по антигенам МНС класса II, было использовано для модуляции и гуморального, и клеточного иммунных ответов. Кроме того, для подавления аллергических реакций на чужеродные антигены или аутоиммунного ответа на собственные антигены могут быть использованы соответствующие антигены, вдыхаемые в легкие в форме аэрозоля. Поскольку таким способом удается подавлять и аутоиммунные, и аллергические реакции, обусловленные соответственно Тх1- и Тх2-клетками, механизм толерантности в этом случае, по-видимому, не относится к феномену иммунного отклонения. Возможно, за супрессию иммунного ответа после введения белковых антигенов в виде аэрозоля ответственны клетки других типов, включая CD8+.
Направленное действие антигена на нестимулированные В-клетки индуцирует иммунное отклонение. Иммунное отклонение можно вызвать путем воздействия на непримированные В-клетки антигеном, соединенным с моноклональными антителами к IgD (иммуноглобулину, присутствующему на поверхности В-клеток). При таком способе пептидный антиген презeнтируется В-клетками и возникает иммунное отклонение ответа в сторону Тх2-типа. Этот подход может быть использован для модуляции воспалительной реакции на пептидные антигены при экспериментально индуцированных аутоиммунных процессах, каким является, например, экспериментальный аутоиммунный энцефаломиелит ОАЭ).
Интенсивная клональная пролиферация может привести к истощению клона и развитию толерантности. Толерантность Т-лимфоцитов (и в меньшей степени В-клеток) может быть обусловлена так называемым клональным истощением, которое наступает в конечной стадии сильного иммунного ответа. Повторное введение антигена способно стимулировать дифференцировку всех антигенреактивных клеток в короткоживущие клетки эффекторы, в результате чего в организме уже не остается клеток, которые могли бы обеспечить ответ на последующее введение антигена.
С толерантностью может быть связан антиидиотипический ответ. Связывающий участок антител может действовать как антиген и вызывать образование «анти- идиотипических антител» (см. гл. 13). Перекрестно связывая иммуноглобулины на поверхности В-клеток, эти антитела способны блокировать их реактивность. У некоторых животных большая часть антител, продуцируемых против некоторых антигенов, имеет соответствующий идиотип и поэтому супрессия этого идиотипа антиидиотипическими антителами может существенным образом изменить ответ. Однако такая толерантность будет частичной, так как она затрагивает только те В-клетки, которые несут данный идиотип.
У Т-клеток идиотип представлен полиморфными областями α- и β-цепей ТкР. Специфичные к ТкР регуляторные клетки, возникающие после вакцинации аутореактивными Т-лимфоцитами, пептидами, полученными из ТкР, или даже ДНК, кодирующей ТкР, как установлено, предотвращают развитие аутоиммунного процесса.
Поддержание толерантности in vivo. Для поддержания толерантности in vivo важна персистенция антигена: когда концентрация антигена в организме падает ниже определенного порога, реактивность восстанавливается. Если толерантность возникла в результате клональной делеции, восстановление способности к иммунному ответу зависит по времени от образования новых лимфоцитов из клеток-предшественников. В этом случае состояние толерантности удается сохранить путем применения тимэктомии. Если же механизмом толерантности служит супрессия, как это имеет место, например, при иммунном отклонении, толерантность может сохраняться относительно долгое время.