ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 18. Иммунитет к паразитарным инвазиям
ЭФФЕКТОРНЫЕ МЕХАНИЗМЫ
Для того чтобы успешно внедриться в нового хозяина, до того как его иммунная система сформирует специфический иммунитет, паразиту необходимо преодолеть уже действующие защитные механизмы хозяина. Определенную роль среди таких механизмов выполняет комплемент, поскольку некоторые паразиты, включая половозрелых червей и способных к инвазии личинок Т. spiralis и шистосомул Schislosoma mansoni, имеют в составе поверхностной оболочки определенные молекулярные структуры, которые запускают альтернативный путь активации комплемента.
Первую линию защиты формируют макрофаги, нейтрофилы, эозинофилы и тромбоциты
Антитела и цитокины, специфически продуцируемые при развитии иммунного ответа на паразитарные антигены, стимулируют антипаразитарную активность всех указанных выше эффекторных клеток. Однако тканевые макрофаги, моноциты и гранулоциты обладают и определенной предсуществующей активностью.
Тип защитной реакции зависит, очевидно, от того, каким путем паразит проникает в организм.
✵ Церкарии S. mansoni проникают через кожу — экспериментальное удаление макрофагов, нейтрофилов и эозинофилов из кожи мышей увеличивает восприимчивость к инвазии.
✵ Трипаносомы и малярийные паразиты, проникающие в кровь, удаляются из циркуляции фагоцитарными клетками в селезенке и печени.
✵ Сравнение линий мышей с различными иммунологическими дефектами показало, что устойчивость к инфицированию Trypanosoma rhodesiense обеспечивают макрофаги. На более поздней стадии инфекции они захватывают трипаносом, опсонизированных антителами и фрагментом комплемента С3b, еще быстрее в печени.
До того как макрофаги начнут функционировать в качестве антигенпрезентирующих клеток, инициирующих иммунный ответ, они действуют как эффекторные клетки, чтобы подавить размножение паразитов или даже разрушить их. Кроме того, макрофаги секретируют вещества, регулирующие воспалительную реакцию. Некоторые из них — ИЛ-1, ИЛ-2, ФНОα и колониестимулирующие факторы (КСФ) — усиливают иммунитет, активируя другие клетки или стимулируя их пролиферацию. Такие цитокины, как ИЛ-10, простагландины и ТФРβ, могут проявлять противовоспалительные и иммуносупрессивные свойства.
Макрофаги способны уничтожать внеклеточных паразитов
Фагоцитоз, осуществляемый макрофагами, обеспечивает важную линию защиты против мелких по размерам паразитов; помимо этого макрофаги секретируют многие цитотоксические факторы, позволяющие уничтожать паразитов без их поглощения. После активации цитокинами макрофаги способны уничтожать как относительно мелких внеклеточных паразитов, например малярийных на эритроцитарной стадии жизненного цикла, так и крупных по размерам паразитов, например шистосом на стадии развития шистосомул.
Макрофаги функционируют также как клетки-киллеры в реакции антителозависимой клеточной цитотоксичности (АЗКЦ). Под действием специфических IgG и IgE, например, усиливается способность макрофагов уничтожать шистосомул (молодые особи шистосом). Кроме того, макрофаги секретируют цитокины, такие как ФНОα и ИЛ-1, которые взаимодействуют с другими типами клеток; например, они придают гепатоцитам устойчивость к малярийным паразитам.
После фагоцитоза, например Т. cruzi, Т. gondii, Leishmania spp. и малярийных паразитов, в макрофагах и гранулоцитах образуются высокоактивные метаболиты кислорода; филярии и шистосомы также стимулируют вспышку клеточного дыхания. Активированные цитокинами макрофаги выделяют больше супероксидных кислородных радикалов и пероксида водорода, чем тканевые оседлые макрофаги. Активизируются также и их O2-независимые механизмы уничтожения чужеродных клеток.
Один из эффективных O2-независимых токсинов - это оксид азота NО, продукт метаболизма L-аргинина. Образование его индуцируют цитокины ИФα и ФНОα, причем оно значительно усиливается при их совместном действии. Оксид азота могут также продуцировать эндотелиальные клетки. Эффект NO вносит определенный вклад в устойчивость к лейшманиозу, шистосомозу и малярии и предположительно важен для подавления большинства паразитарных инвазий (рис. 18.7). Например, врожденная устойчивость к заражению Т. gondii, утрачиваемая при нарушениях иммунитета, по-видимому, обусловлена подавлением размножения паразита посредством такого О2-независимого механизма.
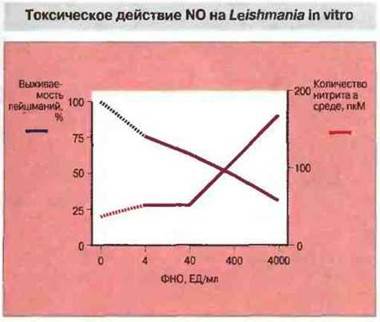
Рис. 18.7. Доказательство того, что уничтожение Leishmania major активированными макрофагами коррелирует с выделением ими оксида азота. Культивируемые макрофаги были активированы различными дозами рекомбинантного ФНОα; при использовании наиболее высоких доз выживаемость паразитов снижалась примерно на треть по сравнению с контролем. С этим коррелировало увеличение количества выделяемого макрофагами N0 (измерение по концентрации нитрита в культуральной жидкости). При подавлении образования NО выживаемость паразитов не снижалась (По Liew et al. 1990. Immunol. 71: 556.)
Активация макрофагов характерна для ранних стадий инвазии
После заражения быстро усиливаются все эффекторные функции макрофагов. Специфическую активацию этих клеток вызывают цитокины, выделяемые Т-клетками (например, ИФγ, ГМ- КСФ, ИЛ-3 и ИЛ-4), но макрофаги могут активироваться и независимо от Т-клеток, например:
✵ нормальные клетки-киллеры (НК) секретируют ИФγ при стимулировании ИЛ-12, который выделяют макрофаги;
✵ макрофаги секретируют ФНОα в ответ на некоторые паразитарные антигены (например, фосфолипид-содержащие антигены малярийных паразитов и отдельные антигены Т. brucei); затем этот цитокин активирует другие макрофаги.
Хотя ФНОα могут секретировать и некоторые другие типы клеток, активированные макрофаги служат наиболее важным источником этого фактора, необходимого для протективного ответа на инвазию некоторых простейших (например, Leishmania spp.) и гельминтов. Так, ФНОα активирует макрофаги, эозинофилы и тромбоциты для уничтожения шистосомул S. mansoni, причем его действие усиливается в присутствии ИФγ.
Следует отметить, что ФНОα может оказывать при инвазии как благоприятный, так и неблагоприятный эффект, в зависимости от его количества и от того, находится он в свободной циркуляции или сосредоточен локально. Так, содержание этого цитокина в сыворотке крови при малярии, вызванной Plasmodium falciparum, коррелирует с тяжестью заболевания. Введение ФНОα мышам чувствительной линии, инфицированным возбудителем малярии грызунов Р. chabaudi, оказывает терапевтический эффект, но у животных генетически устойчивой линии вызывает гибель. Возможно, мыши этой линии уже вырабатывают достаточное количество ФНОα, которое препятствует размножению паразита, и введение дополнительного количества данного фактора приводит к токсическому эффекту.
Нейтрофилы способны уничтожать крупных и мелких паразитов
Эффекторные свойства, проявляемые макрофагами, характерны и для нейтрофилов — они обладают фагоцитарной активностью и способны уничтожать паразитов с помощью как O2-зависимых, так и O2-независимых механизмов, в том числе посредством NO. При этом для нейтрофилов характерна более интенсивная вспышка дыхания по сравнению с макрофагами, а их секреторные гранулы содержат чрезвычайно цитотоксичные белки (см. гл. 2). Активацию нейтрофилов могут вызывать цитокины, например ИФγ, ФНОα и ГМ-КСФ. Внеклеточное разрушение паразитов нейтрофилы осуществляют посредством выделяемого ими Н2O2; внутриклеточное же уничтожение поглощенных паразитов происходит под действием компонентов гранул. Нейтрофилы присутствуют в очагах воспаления, вызванных внедрением паразитов, и, вероятно, способствуют уничтожению паразитов, высвобождающихся из разрушаемых ими клеток. Подобно макрофагам, нейтрофилы имеют Fc-рецепторы и рецепторы комплемента и могут участвовать в антителозависимых цитотоксических реакциях, например уничтожении шистосомул S. mansoni. Обладая такой активностью, они в большей степени способны к разрушению некоторых видов нематод, в том числе Т. spiralis, чем эозинофилы, хотя относительная эффективность указанных двух типов клеток может зависеть от изотипа и специфичности антител.
Активность эозинофилов обычно ассоциирована с гельминтозами
Эозинофилы, как предполагается, эволюционно возникли специально для зашиты против тканевых стаций развития паразитов, слишком крупных, чтобы их можно было уничтожить путем фагоцитоза. Согласно этой гипотезе, локализацию эозинофилов около паразитов и усиление их антипаразитарных функций обеспечивают IgE-зависимые реакции тучных клеток, предназначенные в первую очередь именно для этого.
Важная роль эозинофилов in vivo установлена в экспериментах с использованием специфичной к ним антисыворотки. У мышей, зараженных Т. spiralis и получавших такую антисыворотку, в мышцах образовывалось больше цист по сравнению с контрольными животными: в условиях инактивации эозинофилов организм-хозяин не мог уничтожать паразитов и обезвреживал их, насколько возможно, путем инкапсулирования.
Однако недавно проведенные исследования показали, что хотя эозинофилы и способны участвовать в борьбе организма с гельминтами, в частности ограничивая перемещения паразитов в тканях, они не всегда делают это. Например, удаление эозинофилов нe ослабляет иммунитет у мышей, зараженных S. mansoni, и не уменьшает количество паразитов при заражении ленточными червями.
Эозинофилы способны уничтожать гельминтов с помощью O2-зависимых и O2-независимых механизмов
Эозинофилы обладают меньшей фагоцитарной активностью по сравнению с нейтрофилами. Дегрануляция эозинофилов происходит в ответ на изменения в их поверхностной мембране, и активность усиливается под действием цитокинов, например ФНОα и ГМ-КСФ. Однако большинство функций эозинофилов зависит от антиген- специфических механизмов. Так, при связывании эозинофилов in vitro с личинками гельминтов (например, S. mansoni и Т. spiralis) интенсивность дегрануляции на поверхность паразитов повышается, если личинки нагружены IgE или IgG. Повреждение шистосомул может быть обусловлено действием главного основного белка (МBР, от англ. major basic protein) кристаллоидного ядра эозинофилов. МBР не специфичен к какой-либо определенной мишени, но не вызывает существенных повреждений близлежащих собственных клеток организма-хозяина, поскольку локализуется в небольшом пространстве между эозинофилом и шистосомой.
Эозинофилы и тучные клетки действуют совместно
Уничтожение шистосомул S. mansoni эозинофилами усиливается под действием продуктов тучных клеток, и в экспериментах in vitro эозинофилы от больных шистосомозом обнаруживают большую активность, чем эозинофилы от здоровых индивидов. Выделяемые паразитом антигены вызывают локальную IgE-зависимую дегрануляцию тучных клеток с выбросом медиаторов, которые избирательно привлекают эозинофилы к определенному участку и усиливают их активность. Другие продукты эозинофилов позднее блокируют реакции тучных клеток. То, что указанные эффекторные механизмы могут функционировать in vivo, установлено в экспериментах на обезьянах; уничтожение шистосом у них связано с накоплением эозинофилов (рис. 18.8).
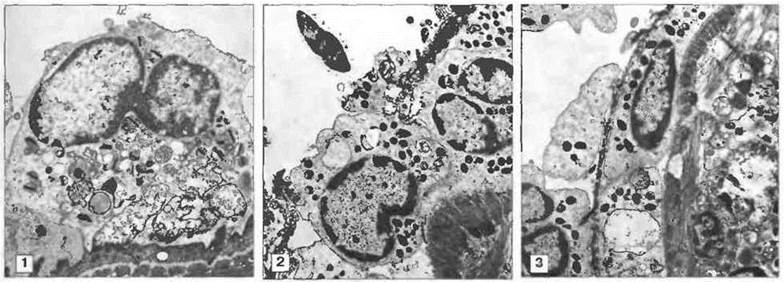
Рис. 18.8. Уничтожение шистосомулы эозинофилами. Эозинофилы способны прикрепляться к шистосомулам и уничтожать их путем дегрануляции с высвобождением содержимого гранул на поверхность паразита. Эта серия электронных микрофотографий демонстрирует прикрепление эозинофилов, дегрануляцию и высвобождение содержимого гранул на поверхность паразита (1), а также стадии разрушения его тегумента и миграции эозинофилов через поврежденные участки (2 и 3). (Фото любезно предоставлены д-ром D. McLaren.)
Тромбоциты способны уничтожать различных паразитов
Потенциальные мишени тромбоцитов — молодые особи трематод, а также Т. gondii и 7. cruii. Как и у других эффекторных клеток, их цитотоксическая активность усиливается при обработке цитокинами (например, ИФγ и ФНОα). У крыс, зараженных S. mansoni, тромбоциты приобретают способность уничтожать паразитов одновременно с появлением в сыворотке компонентов острой фазы, но до того, как в пей обнаруживаются антитела. Инкубирование нормальных тромбоцитов в такой сыворотке может способствовать их активации. Тромбоциты, подобно макрофагам и другим эффекторным клеткам, обладают поверхностными Fcε-рецепторами, с участием которых осуществляется их антителозависимое цитотоксическое действие, ассоциированное с IgE.