Эволюция вирусов - Жданов В. М. 1990
Специальная часть
Вирусы гриппа
На примере гриппа наглядно иллюстрируется ранее высказанное соображение о том, что эволюция структур РНК происходит в миллион раз быстрее, чем структур ДНК. Действительно, за 10 лет эволюция вирусов гриппа проделывает такой же, если не больший путь, какой прошла эволюция приматов за 10 млн лет, завершившаяся становлением человека. Для понимания темпов эволюции, однако, надо добавить, что за 10 млн лет приматы прошли примерно 500 000 генераций, а вирусы гриппа за 10 лет — около 5000 генераций, поэтому на самом деле скорость их эволюции оказывается всего 10-кратной. Из громадного по объему материала, относящегося к ортомиксовирусам, мы вкратце напомним лишь об основных данных, необходимых для понимания путей эволюции вирусов гриппа [Кильбурн Э., 1978; Burnet F., 1979].
Вирусы гриппа (Orthomyxoviridac) образуют два рода: Influenzavirus (вирусы гриппа А и В) и род вируса гриппа С. Известны также ортомиксовирусы, выделенные от членистоногих, которые не классифицированы. Вирионы имеют сферическую (в нативных препаратах нередко нитеобразную и неправильную) форму, диаметр 80—120 нм. Нуклеокапсид представляет собой туго свернутую спираль диаметром 7нм, длиной 50—130; нм для разных 8 его фрагментов. Он окружен внутренней мембраной (матриксом), образуя сердцевину вириона. Наружная липидная оболочка содержит тримеры гемагглютинина и тетрамеры нейраминидазы — поверхностных гликопротеидов. Молекулы гемагглютинина имеют длину 14 нм, диаметр 4 нм. Молекулы нейраминидазы имеют головку размером 4X8,5 нм и стебель размером 10X4 нм.
Геном вирусов гриппа состоит из 8 сегментов однонитевой РНК с негативной полярностью и размерами: РВ1 — 2341 нуклеотид, РВ2 — 2341, РА — 2233, НА — 1778, NP — 1565, NA — 1413, М— 1027 и NS — 890 нуклеотидов. Число нуклеотидов и молекулярная масса их колеблются у разных штаммов вирусов и существенно различаются у вирусов А и В. Вирусы С имеют 7 сегментов РНК, у них отсутствует ген нейраминидазы. Названные белки имеют молекулярную массу: 96 000 (РВ1), 87 000 (РВ2), 85 000 (РА), 50 000 — 60 000 (NP), 48 000 — 63000 (МА); субъединицы гемагглютинина (в скобках указана дополнительная молекулярная масса углеводов) — 36 000 (11 500) и 27 000 (1300). Два гена кодируют по два белка: Ml (27 000) и М2 (15000), NS1 (25 000) и NS2 (12 000). Естественно, что у разных вирусов эти величины варьируют.
Таблица 8. Сегменты генома и белки вируса гриппа А
Номер сегмента генома |
Кодируемый белок |
Число нуклеотидов всего 1 кодирующих |
Молекулярная масса, X106 |
Примечание |
|
1 |
РВ2 |
2341 |
2277 |
||
2 |
РВ1 |
2341 |
2271 |
81—94 |
|
3 |
РА |
2273 |
2148 |
||
4 |
НА |
1742—1772 |
1686—1701 |
75—80 |
НА1 49 000— |
58 000 |
|||||
НА2 25 005— |
|||||
30 000 |
|||||
5 |
Р |
1565 |
1494 |
55—65 |
|
6 |
NA |
1409—1465 |
1359—1407 |
55—70 |
|
7 |
Ml |
1027 |
756 |
21—27 |
|
М2 |
1027 |
291 |
15 |
||
8 |
NS1 |
890 |
690—711 |
25 |
|
NS2 |
830 |
363 |
12 |
||
Таким образом, 8 фрагментов РНК кодируют синтез 10 белков (табл. 8) [Жилинская И. Н., 1983; McCouley Y., Mahy В., 1983].
Все гены вирусов гриппа неоднократно секвенированы, а для гемагглютинина и нейраминидазы получены модели трехмерных структур. Данные о нуклеотидных последовательностях приведены в ряде работ, посвященных изучению генов полимеразного комплекса [Winter G., Fields S., 1982; Fields S., Winter G., 1983], гемагглютинина [Hauptmann R. et al., 1983], нуклеопротеида [Steuler H. et al., 1985], нейраминидазы [Fields S. et al., 1981], мембранного [Winter G., Fields S., 1980] и неструктурного [Lamb R. et al., 1980] белков.
Трехмерная структура молекулы гемагглютинина оказалась сложной (рис. 24) [Wilson Y. et al., 1981; Wiley D. et al., 1981]. Как видно из рис. 24, две антигенные детерминанты размещены по бокам рецепторного мешка, первая из них является петлей (аминокислотные остатки 140—146), вторая — спиралью (остатки 187—196), третья находится у основания глобулярной части молекулы гемагглютинина в области дисульфидной связи аминокислотных остатков Cys 52 — Cys 277, и наконец, четвертая образуется на стадии глобулярных структур. Мутации в этих сайтах и обеспечивают антигенный дрейф гемагглютинина. Гликозилйрование происходит также в строго определенных местах. Естественно, антигенные сайты гемаглютининов различных серогрупп расположены по-разному. Кроме того, антигенными свойствами обладает олигопептид малой субъединицы молекулы гемагглютинина (аминокислотные остатки 1—11 с NН2-конца), который играет важную роль в проникновении вирионов в клетку [Atassi М., Webster R., 1983].

Рис. 24. Структура тримера гемагглютинина.
cho — сайты прикрепления углеводных цепочек, Ab site — антигенные сайты Прерывистая линия указывает гидрофобный пептид, отщепляемый бром-лайном.
Аналогичные исследования нейраминидазы [Varghese J. et al., 1983; Colman P. et al., 1983] показали, что этот гликопротеид является тетрамером с глобулярной частью, напоминает четырехлепестковый цветок, погруженный тонким стеблем в липидный бислой внешней оболочки. В центре каждого Лепестка находится активный центр фермента, два антигенных сайта расположены вблизи него и два — в некотором отдалении. С антителами взаимодействуют 7 сегментов.
Проникновение вирионов в восприимчивые клетки происходит после прикрепления к рецепторам. При этом не только разные типы ортомиксовирусов (соответственно А, В и С) имеют различные рецепторы, но они отличаются у вирусов гриппа А человека и животных [Rogers G., Paulson J., 1983]. Это обусловлено разным составом сиалоолигосахаридов и липидных компонентов клеточных мембран, а также соответственно разной конформацией «рецепторного кармана» молекулы гемагглютинина. Прикрепление к рецепторам клеточных мембран происходит путем взаимодействия с ними этого «рецепторного кармана», образуется эндоцитарная вакуоль, и вирионы оказываются внутри клетки. Здесь завершается частичная депротеинизадия вириона и его сердцевина транспортируется к ядру. На ядерной оболочке происходит второй этап депротеинизации — удаление белка М, и в ядро проникает (функционально активный нуклеокапсид (рибонуклеопротеид).

Рис. 25. Модель функционирования, взаимодействия и движения трех белков Р на начальных стадиях синтеза мРНК вируса гриппа. Последовательности вРНК и мРНК относятся к гену NP. Верхняя часть показывает связывание РВ2 с кэп-клеточной РНК и нарезание в месте пурина (обычно А), затем РВ1 катализирует продолжение затравки на матрице вРНК. Все три белка движугси вместе вдоль матрицы.
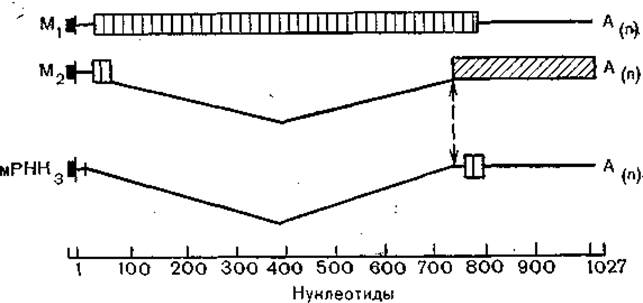
Рис. 26. Структура трех мРНК 7-го гена вируса гриппа типа А. Тонкими линиями обозначены некодирующие области, изогнутыми — интроны. Начальная структура — кэп-затравка клеточного происхождения.
Здесь же начинается транскрипция генов, в которой участвует полимеразный комплекс (белки PA, РВ1—РВ2) вместе с белком NP (рис. 25). Вирус индуцирует синтез и процессинг клеточных мРНК, от молекул которых белок РВ2 «откусывает» кэп-структуру и прилегающие 10—13 нуклеотидов. Они и являются праймером для синтеза мРНК- Матричная РНК транспортируется в цитоплазму и кодирует синтез соответствующего белка на рибосомах.
Транскрипция фрагментов генома происходит своеобразно. В отличие от их репликации, когда синтезируется полная комплементарная нить, а затем дочерние нити каждого фрагмента, при транскрипции синтезируется лишь кодирующая часть нити. При этом белки полимеразного комплекса и NP мигрируют в ядро [Briedis D. et al., 1981], где формируются дочерние рибонуклеопротеиды [Davey J. et al., 1985]. При транскрипции сегментов 7 и 8 (соответственно М и NS), как уже упоминалось, образуется по два белка (рис. 26). Формирование вирусных частиц происходит на клеточных мембранах, в которые встроены гемагглютинины и нейраминидаза, а выход из клетки — путем типичного для оболочечных вирусов механизма почкования.
Для понимания происхождения вирусов гриппа их следует рассматривать вместе с другими вирусами с негативно-полярным геномом: парамиксо-, рабдо-, бунья- и аренавирусами. Все они, за исключением рабдовирусов, поражают теплокровных животных, многие переносятся кровососущими членистоногими. Рабдовирусы поражают как животных, так и растения. Стратегия геномов этих вирусов в, общем сходна. Их геном неинфекционен и для своего функционирования нуждается в полимеразе, которая должна быть в вирионах. Эти свойства присущи всем 5 группам рассматриваемых вирусов. Наиболее близки между собой но морфологии орто- и парамикоовирусы, но строение их генома различное: линейный у парамиксо- и фрагментарный у ортомиксовирусов. В этом смысле к последним ближе бунья- и аренавирусы, но архитектура их вирионов различна, как и архитектура пулевидных рабдовирусов. Вирусы всех 5 групп поражают высших животных и высшие растения, причем переносчиками нередко бывают насекомые. В отличие от вирусов с двунитевой РНК, среди которых имеются как бы переходные формы, здесь таких нет. Поэтому остается неясным, имели ли в прошлом эти вирусы общего предка, а затем дивергировали на сохранившиеся и процветающие ныне 5 групп или же каждая группа возникла заново и независимо от других. Наличие зприонных полимераз у вирусов всех рассматриваемых групп вроде бы свидетельствует в пользу общности происхождения. Об этом также свидетельствует сходство — субъединичное строение — оболочечных гликопротеидов у орто- и парамиксовирусов, хотя именно у них полимеразы весьма различны. Отметим также, что вирусы всех 5 групп имеют внешние оболочки, а их рибонуклеопротеид построен по спиральному типу симметрии. Метод изучения гомологии нуклеиновых кислот в данном случае мало пригоден, так как за миллионы, десятки и даже, может быть, сотни миллионов лет эволюции РНК могла настолько дивергировать, что не сохранились сколько-нибудь заметные следы гомологии для многих вирусов даже в пределах одной и той же группы вирусов. Поэтому необходимы специальные исследования, чтобы решить вопрос о возможной общности происхождения вирусов с негативным геномом. И совcем уже неясно, какие субклеточные структуры дали начало вирусам с негативным геномом.
При репликации, которая происходит также в ядрах клеток, транскрибируется вся нить сегмента РНК, причем сначала образуется плюс-нить, а затем на матрице — минус-нити дочерних РНК. Сборка нуклеокапсида осуществляется в ядре, а гликопротеид после сборки транспортируется к клеточной мембране, встраиваясь в нее. В формировании вирионов участвует белок М, и образовавшиеся вирионы покидают клетку посредством механизма почкования.
Грипп представляет собой уникальную инфекцию, не имеющую аналогов среди других инфекционных болезней. Ежегодно с наступлением холодов начинается рост заболеваемости. Число возбудителей приближается к 200. Среди них — адено-, парамиксо-, корона-, рино-, рео- и энтеровирусы, микоплазмы, хламидии, стрептококки, стафилококки, пневмококки и др. На этом «фоновом шуме» обычно в декабре, но иногда раньше (ноябрь) или позже (январь, февраль) возникают эпидемии гриппа, охватывающие от 6—8% до 30—35% населения города в течение 3—4 нед, страны — в течение 17г — 2 мес и полушария — в течение 2—3 мес. В настоящее время эпидемии гриппа возникают почти ежегодно, перекатываясь, подобно гигантской волне, из северного полушария в южное (май — август) из южного — в северное (ноябрь — февраль). В настоящее время грипп является подлинно глобальной инфекцией не только потому, что он распространен во всех странах, но главным образом и потому, что это — инфекция человечества в целом.
Причиной такой своеобразной эпидемиологии гриппа является уникальная изменчивость поверхностных антигенов вируса — гемагглютинина и нейраминидазы, с которыми связан иммунитет к гриппу. Такая изменчивость в свою очередь во многом зависит от фрагментарности генома вируса гриппа.
Известны 3 серологических варианта вирусов гриппа: A, В и С. Из них только вирус гриппа А имеет пандемическое распространение. Вирус гриппа В вызывает более ограниченные эпидемии, вирус гриппа С — спорадические заболевания. Все дальнейшее изложение будет относиться к вирусу гриппа А, и лишь вкратце будет обсуждаться вопрос о возможном происхождении вируса гриппа В и С. Фактический материал о гриппе можно найти в монографиях и руководствах [Жданов В. М. и др., 1957; Жданов В. М., Гайдамович С. Я., 1982].
Об иммунитете при гриппе еще недавно существовали противоречивые мнения. С одной стороны, частая повторная заболеваемость гриппом и почти ежегодное повторение эпидемий, вызванных одним и тем же типом вируса, как будто свидетельствовали о непрочности приобретенного иммунитета. С другой стороны, уже давно был известен «феномен первородного антигенного греха» при гриппе — пожизненное сохранение иммунологической доминанты к серологическому варианту вируса, с которым произошла первая «встреча» в раннем детстве. Как будет показано ниже, на основании изучения этого феномена удалось установить этиологию эпидемий гриппа, которые имели место в прошлом, до открытия вируса гриппа в 1933 г. Окончательный вывод о прочности приобретенного иммунитета позволили сделать наблюдения 1977—1978 гг., когда после 20-летнего отсутствия «вернулся» вирус гриппа A (H1N1). Возникшая эпидемическая волна охватила почти исключительно лид моложе 20 лет. Таким образом, иммунитет к гриппу достаточно прочен, и не его «слабость», а необычайная, не имеющая аналогов среди других вирусов изменчивость вируса гриппа является причиной повторных заболеваний и эпидемий.
Эти изменения бывают двух видов: антигенные шифты, когда появляется вирус с новыми антигенами гемагглютинина и(или) нейраминидазы, и антигенный дрейф, при котором постепенно изменяется антигенная структура гемагглютинина и нейраминидазы. Антигенные шифты происходили несколько раз и каждый раз сопровождались пандемическим распространением гриппа. В 1918 г. появился вирус «испанского» гриппа (H1N1), вызвав наиболее опустошительную пандемию, унесшую за 11/2 года около 20 млн жизней. Никогда до и после этого заболевания гриппом не сопровождались такой высокой смертностью. В 1957 г. возник новый, «азиатский» вирус гриппа (H2N2), который начал стремительно распространяться, вызвав пандемию, поразившую около 2 млрд человек. Перед его появлением «исчез» его предшественник (вирус H1N1), перестав циркулировать среди населения. Новый, «гонконгский» вирус (H3N2) появился через 11 лет и вызвал пандемическую «волну», поразившую около 1,5 млрд человек; одновременно перестал циркулировать его предшественник (вирус H2N2). В 1977 г., как уже указывалось, возвратился вирус H1N1 и распространился по всему земному шару. Хотя эпидемия, вызванная этим вирусом (как и все предшествовавшие эпидемии), началась в Китае, вирус получил название СССР/1977, поскольку он был впервые идентифицирован советскими учеными, когда эпидемия гриппа была занесена в СССР из Китая через Японию. В отличие от предыдущих шифтов на этот раз вирус H3N2 не перестал циркулировать среди населения и оба вируса циркулируют и в настоящее время (1988 г.), ежегодно вызывая эпидемические «волны».
Начав циркулировать среди населения, новый «щифтовый» вирус претерпевает постепенные изменения антигенной структуры, которые называются антигенным дрейфом. Этот дрейф может быть весьма выраженным. Так, вирус H1N1, появившийся в 1918 г., в течение 39 лет проделал настолько выраженный дрейф, что исходные по старой номенклатуре (Нsw 1N1) промежуточные (H0N1) и конечные (H1N1) его члены считались шифтовыми вариантами. Вирусы гонконгского ряда проделали примерно такую же эволюцию за 11— 12 лет (табл. 9), что свидетельствует о более выраженном прессе коллективного иммунитета, лежащего на основе отбора мутантов вируса с измененной антигенной структурой, чем это было 50 лет назад. В табл. 9 показаны титры сывороток, нейтрализующие соответствующие вирусы, выделенные с 1968 по 1981 г. Как видно, сыворотки против исходных вирусов не нейтрализуют конечные вирусы соответствующих рядов и то же происходит с сыворотками против конечных вирусов, которые не реагируют с исходными вирусами.
Таблица 9. Антигенный дрейф вирусов H3N2 с 1968 по 1981 г.
Вирус |
Титр сыворотки |
||||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
А (Гонконг) 68 |
1280 |
320 |
160 |
20 |
20 |
0 |
0 |
А (Англия) 72 |
320 |
1280 |
640 |
80 |
20 |
10 |
0 |
А (Порт Чалмерс) 75 |
160 |
160 |
2560 |
240 |
160 |
0 |
10 |
А (Виктория) 75 |
80 |
320 |
480 |
2560 |
320 |
40 |
160 |
А (Техас) 77 |
20 |
40 |
80 |
960 |
1280 |
80 |
320 |
А (Гонконг) 79 |
10 |
10 |
20 |
20 |
480 |
1280 |
640 |
А (Индия) 81 |
0 |
0 |
0 |
10 |
320 |
320 |
5120 |
Примечание. Приведены обратные значення титров.
Секвенирование генов М и NS вирусов гриппа свиней А (swine) Iowa 15130 и человека A/PR 8/34 с общей антигенной формулой H1N1 и оценка скорости эволюции (замен нуклеотидов) позволили экстраполировать время появления общего предшественника между 1915 и 1920 гг., что совпадает со временем пандемии 1918 г. [Nakajima К. et al., 1984].
Если причины антигенного дрейфа более или менее понятны, механизмы антигенных шифтов стали проясняться после того, как были изучены многочисленные вирусы гриппа животных, которые вое принадлежат к группе вируса А. Эти вирусы были выделены от домашних животных (свиньи, лошади, верблюды, телята, куры), многочисленных видов диких млекопитающих и особенно птиц. В последние годы их также изолировали из открытых водоемов. Ранее вирусы животных обозначались соответствующими индексами — sw (свиньи), eq (лошади), av (птицы), но поскольку все вирусы человека также были выделены от животных, новая номенклатура вирусов (точнее гемагглютинина и нейраминидазы) предусматривает сплошную нумерацию без обозначения их происхождения — от человека или животных (табл. 10) [World Health Organization, 1980].
Ясно, что в биосфере идет интенсивный обмен между вирусами гриппа А, циркулирующими среди животных и людей. В то же время результаты серологических исследований показали, что прекращение циркуляции «исчезающих» вирусов означает полный исход их из человеческой популяции и весьма часто выход в животную популяцию. Так, в частности, случилось с вирусом «испанского» гриппа, сохранившегося среди свиней (отсюда прежнее его обозначение Hsw1N1).
Таблица 10. Номенклатура подтипов гемагглютининов и нейраминидаз-вирусов гриппа А
Номенклатура 1980 г. |
Номенклатура 1971 ґ. |
Номенклатура 1980 г. |
Номенклатура 1971 г. |
|
Гемагглютинины |
Heйpаминидазы |
|||
H1 |
Н0, H1, Hsw1 |
N1 |
N1 |
|
Н2 |
Н2 |
N2 |
N2 |
|
Н3 |
Н3, Heq2, Hav7 |
N3 |
Nav2, Nav3 |
|
Н4 |
Hav4 |
N4 |
Nav4 |
|
Н5 |
Hav5 |
N5 |
Nav5 |
|
Н6 |
Hav6 |
N6 |
Nav1 |
|
Н7 |
Heq1, Hav1 |
N7 |
Neq1 |
|
Н8 |
Hav8 |
N8 |
Neq2 |
|
Н9 |
Hav9 |
N9 |
Nav6 |
|
Н10 |
Hav2 |
|||
Н11 |
Hav3 |
|||
Н12 |
||||
Н13 |
||||
Уже отмечалось, что вирусы гриппа имеют фрагментарный геном, а это в свою очередь лежит в основе феномена рекомбинации, или пересортировки, генов при заражении клетки двумя разными вирусами. Например, если заразить клетки или куриные эмбрионы двумя вирусами с антигенными формулами H1N1 и H3N2, то в потомстве появляются не только исходные родительские вирусы H1N1 и H3N2, но и их рекомбинанты H1N2 и H3N1. Рекомбинанты между всеми вирусами гриппа человека и животных не только легко воспроизводятся в эксперименте, но и широко распространены в природе. Так, после появления вируса H1N1 в 1977 г. в течение 2 лет были обнаружены рекомбинанты (реассортанты) между ним и вирусом H3N2, в частности, вирусы, содержавшие гены НА, NA, М и NS вируса H1N1 и гены P1, Р2, Р3 и NP вируса H3N2. В нескольких случаях были даже выделены рекомбинанты с антигенной формулой H3N1. Важно также отметить, что «эволюция» гемагглютинина в 1950—1957 гг. и 1977—1983 гг. шла совершенно разными путями [Raymond F. et al., 1986], хотя исходным в обоих случаях был один и тот же ген.
Как указывалось, вирус «гонконгского» гриппа появился в 1968 г. За 5 лет до этого от уток на Украине и от лошадей в штате Майами были выделены вирусы, содержащие антигены Н3 (по номенклатуре 1971 г. антигены Hav7 и Heq2). Анализ с применением современных методов исследования (секвенирование генов, моноклональные антитела, олигопептидное картирование и др.) позволил установить большое сходство антигенов Н3 и Hav7 (при секвенировании генов), Н3 и Heq2 (при использовании моноклональных антител). Если учесть, что эти вирусы были выделены в 1963 г., т. е. за 5 лет до появления вируса «гонконгского» гриппа, то с большой долей вероятности можно заключить, что источником появления новых шифт-вариантов являются процессы рекомбинации генов вирусов гриппа человека и животных. И даже вирус СССР/1977, который по антигенным свойствам наиболее близок к вирусам, циркулировавшим в 50-х годах (штамм А/Fort Warren/50), оказался близким к этому вирусу, а 8-й (М) — совершенно отличным.
Была исследована молекулярная эволюция вирусов гриппа С в период между 1947 и 1983 гг. Эволюция генов NS и НА оказалась разной и независимой, что свидетельствует о пересортировке генов в эпидемическом процессе. По сравнению с вирусами гриппа А у вирусов гриппа С частота замен нуклеотидов в гене NS была большей [Buonagurio D. et al., 1986]. При сравнительном исследовании генов NS вируса гриппа и VP1 вируса полиомиелита было показано, что у первого частота мутаций равнялась 1,5х10-5, а у второго менее 2,1х10-6. Таким образом высокая частота мутаций у вируса гриппа может быть причиной его быстрой эволюции [ParvinJ. et al., 1986].
Характер мутаций отличается тем, что доминирующие штаммы являются не этапами «столбовой дороги», а вариантами разветвленной изменчивости, при которой их предшественники могут быть утеряны, создавая впечатление магистрального пути эволюции.
Изучение генов вирусов гриппа, выделенных от человека и животных методами олигопептидного и олигонуклеотидного картирования и секвенирования нуклеиновых кислот, позволило, во-первых, заключить, что эти вирусы представляют собой единую, хотя и крайне гетерогенную популяцию вирусов с защищенным генофондом (способность к пересортировке генов); во-вторых, построить генеалогическое древо для генов гемагглютинина. Эти гены образуют две подгруппы. В одну из них входят гены Н1 и Н2 и 6 других генов вирусов гриппа, выделенных от птиц; в другую — гены Н3 и 3 других гена вирусов гриппа, также выделенных от птиц [Air G., 1981]. Дивергенция между этими двумя группами произошла, по- видимому, давно, и в то же время гены вирусов гриппа человека остаются близкими ко многим генам вирусов гриппа птиц (рис. 27). На рис. 28 представлены результаты более подробного анализа вариантов гемагглютинина вируса гриппа A [Webster R. et al., 1982]. Эта дендрограмма показывает различие даже в пределах субтипов гемагглютинина, подтверждая сложность эволюции «укоренившегося» штамма Н3.
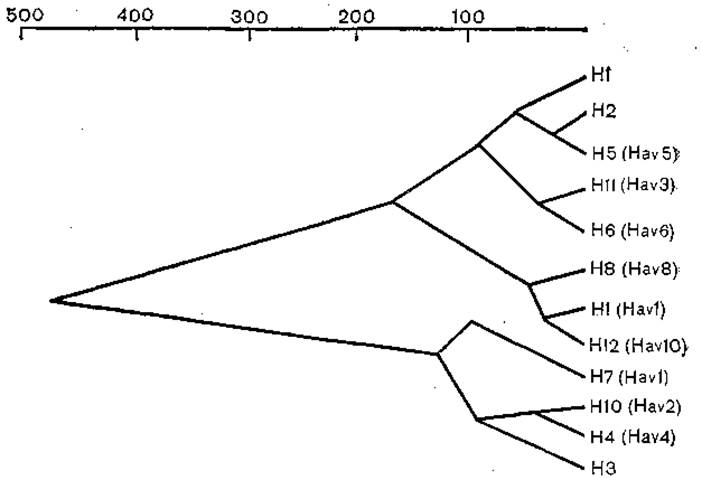
Рис. 27. Дендограмма эволюционных связей гемагглютининов вирусов гриппа типа А. По оси абсцисс — относительные величины.
Итак, можно предположить, что источником происхождения вирусов гриппа человека являются вирусы гриппа птиц. У птиц грипп протекает как кишечная инфекция, вирус размножается в слизистой оболочке кишечника, нередко вызывает септический процесс и передается алиментарным путем через содержимое клоаки. Циркуляция вирусов гриппа птиц осуществляется особенно интенсивно у перелетных колониальных видов, в силу обмена разными вирусами может происходить и интенсивная рекомбинация. В эпизоотический процесс могут вовлекаться и млекопитающие. Так, в 1980 г. на атлантическом побережье Северной Америки было обнаружено несколько сотен трупов тюленей, погибших от заражения вирусом гриппа птиц, который для птиц был маловирулентен. Не так ли произошло в 1918 г., когда маловирулентный для животных рекомбинант оказался губительным для человека? И может быть знаменитая «английская потница» XVIII в. была также аналогом смертельного гриппа для тюленей или «испанского» гриппа для людей? К сожалению, об этом можно лишь догадываться.
В эпизоотический процесс гриппа диких птиц нередко вовлекается и домашняя птица. Показательны результаты исследования пекинских уток, экспортируемых в Гонконг из КНР. Было выделено несколько сотен штаммов вирусов гриппа А почти всех известных вирусов гриппа, а также вирусов с ранее неизвестными антигенными формулами.
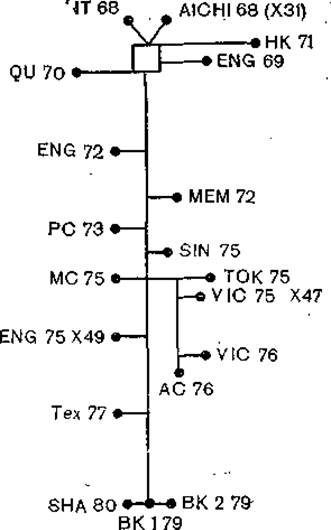
Рис. 28. Взаимоотношения штаммов подтипа Гонконг в зависимости от минимальных мутационных расстояний между кодирующими областями НА1. Число мутаций определяется по отношению к расстоянию NT68-BK179 (73 мутации).
Надо полагать, что грипп человека стал формироваться как антропоноз с момента образования крупных поселений и развития миграционных процессов. Как для многих других антропонозов, формирование гриппа человека сопровождалось переменой механизма передачи заразного начала: грипп сразу становился инфекцией с воздушно-капельным путем передачи. Вероятно, местом формирования его явилась Юго-Восточная Азия, так как все известные пандемии с 1889 г. начинались в Китае. Здесь на сравнительно ограниченной территории проживает более трети человечества, через Юго-Восточную Азию пролегают миграционные пути колониальных перелетных птиц, здесь они контактируют с домашними птицами и млекопитающими и здесь, наконец, белковое голодание повышает восприимчивость организма людей к вирусам гриппа.
Ставши антропонозной инфекцией, грипп человека типа А не «оторвался» окончательно от природных резервуаров, и каждая большая эпидемия гриппа, особенно в наше время, когда численность населения земного шара превысила 4 млрд человек, сопровождается массивным выбросом части вирусной популяции в популяции домашних и диких животных. Здесь вирус «консервируется» (по антигенной структуре) вследствие отсутствия давления коллективного иммунитета, который не формируется в пестрых биоценозах животных и в то же время подвергается постоянным рекомбинациям. В результате этого могут возникнуть такие сочетания генов, которые делают возможной реинтродукцию вируса в человеческую популяцию. Это и лежит в основе шифтов и следующих за ними пандемий.
Что касается вирусов гриппа В, то данные молекулярно-биологического анализа показывают около 30% гомологии (табл. 11) его генома с геномом вируса гриппа A [Kemdirimea A., 1986J. В отличие от последнего у вируса гриппа В
Таблица 11. Гомология разных генов вирусов гриппа А и В
Номер сегмента РНК |
Белок |
Гомология, % |
1; 2; 3 |
Полимераза (РВ1) |
61 |
4 |
Гемагглютинин |
|
НА1 |
24 |
|
НА2 |
39 |
|
5 |
Нуклеопротеид (NP) |
37 |
6 |
Нейраминидаза (NA) |
35 |
7 |
Мембранный |
|
M1 |
25 |
|
М2 |
14 |
|
8 |
Неструктурный |
|
NS1 |
9,7 |
|
NS2 |
16,2 |
снизилась способность заражать животных, а следовательно, вирус потерял истопники шифтов, сохранив способность к дрейфу антигенов. Этим, вероятно, объясняются более умеренное его распространение и отсутствие пандемий, вызванных этим вирусом. О происхождении вируса гриппа С трудно что-либо сказать, тем более что дискутируется вопрос о принадлежности его к ортомиксовирусам, к которым относятся вирусы гриппа А и В.
Здравоохранение в настоящее время вооружено многими средствами борьбы с гриппом — вакцинами, препаратами иммуноглобулинов, химиотерапевтическими средствами (ремантадин, виразол), интерфероном и его индукторами, а также антибиотиками, применяемыми для лечения и профилактики бактериальных осложнений. Тем не менее применение всех этих средств не обеспечивает радикальной профилактики гриппа и инфекция пока остается неконтролируемой. Можно предположить два возможных пути радикального решения проблемы: либо создание универсальной антигриппозной вакцины, либо получение комплекса химиотерапевтических веществ, обеспечивающих не только эффективное лечение, но и ликвидацию инфекционного начала, а следовательно, и ликвидацию источников инфекции. Универсальная антигриппозная вакцина должна содержать не только дрейф-варианты вирусов, циркулировавших среди людей ранее (H1N1, H2N2 и H3N2), но и детерминанты известных вирусов гриппа животных и возможные будущие антигенные детерминанты. Объем предстоящей работы огромен и его выполнение потребует не одно десятилетие. Такая вакцина должна быть создана генно-инженерными методами. Не меньший путь придется пройти, прежде чем будет создан универсальный набор химиотерапевтических веществ. Но может случиться и другое — будет найдено неожиданное и необычное решение проблемы, как это произошло в случае с полиомиелитом в начале 50-х годов, когда была разработана техника однослойных культур тканей, сделавшая возможным культивирование вирусов полиомиелита и получение инактивированных и живых вакцин. Пока же этого нет, следует продолжать выполнять громадный объем работы для того, чтобы найти решение традиционными путями (вакцины, химиотерапия). И решению этой труднейшей проблемы не помогут ни административное нетерпение, ни волюнтаристские наскоки. Впереди много труда и терпения.
В заключение — несколько слов об ортомиксовирусах, выделенных от клещей [Львов Д. К., 1982; Clerk J. et al., 1983]. Как и вирусы гриппа, они имеют 7—8 сегментов РНК, их З'-конец имеет характерные последовательности UGGUUG UAUUGUUGобщая молекулярная масса генома такая же, как и у вирусов гриппа. Более того, даже белки имеют сходную молекулярную массу. Мы слишком мало знаем о них, чтобы пытаться понять их происхождение и связь с классическими ортомиксовирусами. Широкое распространение вирусов гриппа среди теплокровных животных, особенно птиц, делает вполне возможным включение клещей в циркуляцию этих вирусов. Вирус Thogoto, выделенный от клещей в Африке, Азии и Европе, сходен с ортомиксовирусами. Его геном содержит 7 сегментов однонитевой РНК. С ним сходен вирус, выделенный в Португалии. При введении мышам он вызывает поражения в легких, сходные с поражениями при вирусном гриппе [Filipe А., 1986].