Эволюция вирусов - Жданов В. М. 1990
Специальная часть
Гепаднавирусы
В семейство гепаднавирусов (hepar + DNA — словообразование: печень, которая поражается этими вирусами, и ДНК — тип генетического материала вируса) входят достаточно изученные вирусы гепатита В человека (HBV), гепатита лесных сурков (WHV), земляных белок (GSHV), пекинских уток (DHV). Позже были обнаружены и другие вирусы этой группы: вирус гепатита змей на острове Тайвань, древесной белки [Feitelson М. et al., 1986], сурков северной Украины и Казахстана, серой крысы, полевок Apodemus sylvaticus, грызунов Micromys minutus, насекомоядных Croccidura snaveelans и Talpa europea [Krivanec К. et al., 1984]. Данные о вирусах гепатита насекомоядных получены пока при серологических анализах. Если учесть, что до сих пор изученные вирусы имеют узкий круг «хозяев», часто ограниченный одним видом, то в целом это семейство уже сейчас охватывает возбудителей заболеваний млекопитающих, птиц, пресмыкающихся. Мы еще раз нарушим общий стиль книги и начнем с истории открытия гепаднавируса человека — возбудителя гепатита В.
История открытия и изучения вируса гепатита В человека началась в прошлом веке, когда была описана вспышка гепатита в Германии среди фабричных рабочих, получивших прививку против оспы гуманизированной, т. е. проведенной через организм человека, вакциной. Хотя эта вспышка не привлекла к себе особого внимания, но уже в то время стало ясно, что не следует использовать такую вакцину, поскольку были известны случаи передачи и других болезней, в частности сифилиса.
Возможность парентерального заражения гепатитом привлекла к себе внимание в 30-е и 40-е годы в связи с применением некоторых вакцин (против желтой лихорадки, москитной лихорадки), а также в связи с массовым лечением больных сифилисом, преимущественно армейских контингентов. Более подробно эти наблюдения уже описаны [Жданов В. М., 1948], поэтому мы ограничимся краткими сведениями. Отметим, что к этому времени стали складываться суждения о том, что инфекционный гепатит, выделенный еще в прошлом столетии С. П. Боткиным в самостоятельную нозологическую единицу, стал трактоваться как вирусная инфекция.
Обширные вспышки гепатита В, который тогда еще не был выделен как самостоятельная нозологическая единица, наблюдались в связи с массовыми прививками против желтой лихорадки. Обстоятельный анализ, проведенный G. Findlay и F. McCallum (1937), позволил прийти к совершенно правильному выводу, что вирус был занесен в вакцинный препарат вместе с входящей в его состав человеческой сывороткой. Аналогичная вспышка гепатита была выявлена после иммунизаций против москитной лихорадки [Сергиев П. Г. и др., 1940]; в состав этой вакцины также входила человеческая сыворотка. К этому же времени стали накапливаться данные о заражении гепатитом лиц, получавших переливание крови или парентеральное введение препаратов крови. Таким образом, была несомненно установлена возможность заражения гепатитом при парентеральном введении человеческой крови, плазмы, сыворотки и других ее препаратов, причем вероятными источниками инфекции являлись люди — латентные носители вируса. В этих наблюдениях обращал на себя внимание длительный инкубационный период. Если при обычном инфекционном гепатите, который, встречаясь в мирное время, особенно часто сопутствовал войнам, инкубационный период в среднем равнялся 3—4 нед, то в описанных случаях заражения кровью или ее дериватами инкубационный период чаще всего составлял 3 мес. с колебаниями от 1 1/2 до 6 мес. Обращали на себя внимание более тяжелое течение болезни и некоторые отличия симптоматологии парентерально передаваемого гепатита от инфекционного гепатита.
Для понимания нозологической самостоятельности болезни большое значение имели наблюдения над заболеваемостью желтухой лиц преимущественно армейских контингентов в период Второй мировой войны (в основном в Англии и США), получавших многократные инъекции сальварсановых и других препаратов. Заболевания развивались также через несколько месяцев после начала повторных инъекций. Обследование этих больных позволило исключить сифилитические поражения печени, а специально поставленные эксперименты показали, что заражение происходит через ничтожные количества крови или лимфы, остающейся не только в иглах, но и в шприцах. Поэтому смена игл не предотвращала заражение получавших парентеральное введение антилюэтических препаратов, если в шприц попадали даже ничтожные количества крови. Было примерно оценено, что введение даже 0,01 мл крови от предполагаемого носителя вируса достаточно для заражения. На основе этих наблюдений были разработаны правила тщательной стерилизации шприцев и игл, что позволило быстро приостановить инструментальное распространение гепатита.
Поскольку наблюдения над гепатитом, передаваемым через препараты крови и инструменты, содержащие кровь, наводили на вывод, что речь идет о самостоятельной болезни, имеющей своего возбудителя, отличного от предполагаемого вируса инфекционного гепатита, были поставлены эксперименты на волонтерах с целью установить наличие или отсутствие перекрестного иммунитета. Некоторые из этих экспериментов дали не совсем четкие данные, но последующие неоднократно и тщательно поставленные опыты дали совершенно определенные результаты: обе болезни не вызывали перекрестного иммунитета и, следовательно, их возбудители различны.
Попытки воспроизвести парентерально передаваемый гепатит на лабораторных животных позволили в 70-е годы выявить, что лишь одно животное — шимпанзе — является восприимчивым к этой болезни. До самого последнего времени также не удавалось культивировать вирус как в тканевых, так и органных культурах.
Для изучения этиологии болезни важное значение имели исследования В. Blumberg и соавт. (1964, 1967). Изучая антигены, циркулирующие в крови, они обнаружили у аборигенов Австралии ранее неизвестный антиген, который в течение нескольких лет обозначался как австралийский антиген. Однако вскоре было показано, что этот антиген широко распространен в разных странах, в различных этнических группах и частота его носительства колеблется в разных регионах от долей до десятков процентов у обследованного населения. «Австралийский антиген» имеет определенную морфологию и выявляется не только серологически, но и с помощью электронной микроскопии. Он представляет собой сферы диаметром 22 нм или нитеобразные структуры разной длины, но с тем же диаметром. Наряду с этим в препаратах крови больных и носителей антигена встречаются более крупные образования частицы [Dane D., 1970] диаметром 42 нм. Это и есть вирус данной формы гепатита. Морфологически он состоит из сердцевины (нуклеоида) в виде икосаэдра, внутри которого упакована ДНК. Наружная оболочка состоит из липидов и белковых молекул поверхностного антигена, который сокращенно обозначается как HBsAg. Антиген Blumberg («австралийский антиген») представляет собой плотно упакованные в липиды молекулы HBsAg. Основой этого антигена является детерминанта «а», обладающая протективными свойствами; дополнительные детерминанты «d» и «у», «r» и «w». Последние в сочетаниях, adr, adw, ayr, ayw образуют серологические подтипы, распространенные в разных регионах Земли. В дальнейшем были установлены дополнительные антигенные варианты этого гликопротеида.
В соответствии с рекомендациями ВОЗ (1973) введена номенклатура, по которой гепатит с фекально-оральным путем передачи, вызываемый пикорнавирусом, обозначается как гепатит А, и соответственно вирус как HAV, описываемая нами форма — как гепатит В и соответственно вирус HBV. Надо прямо сказать, что эти обозначения далеко не удачны, так как латинскими буквами обычно обозначают серологические варианты одного и того же вируса, здесь же речь идет об эволюционно далеких друг от друга энтеро- и гепаднавирусах. Кроме того, вскоре стало ясно, что гепатиты А и В не исчерпывают всех форм вирусных гепатитов, и пришлось ввести совсем уж уродливый термин «гепатит ни А, ни В», а затем еще подразделить и эту неоднородную группу на гепатит с фекально-оральным и парентеральным механизмами передачи.
Прежде чем излагать соображения об эволюции гепадна-вирусов, целесообразно хотя бы вкратце напомнить, что гепатит В является проблемой мирового здравоохранения. Это нашло отражение в постоянном внимании к этой проблеме как национальных служб, так и ВОЗ.
В настоящее время гепатит В, включая носительство HBsAg, широко распространен во всем мире. По оценке ВОЗ, носителями HBsAg являются более 200 млн человек [WHO,
1984], причем носительство имеет длительный характер. Гепатит В часто (65—68% случаев) принимает хроническое течение — хронический активный гепатит, завершающийся, циррозом печени. До 80% случаев первичного рака печени вызываются вирусом гепатита В. Практически вся летальность и почти все случаи развития хронических заболеваний печени у больных острыми гепатитами связаны с гепатитом В.
Гепатит В неравномерно распространен в разных странах. Для Западной Европы, Северной Америки, некоторых районов Южной Америки и Австралии частота носительства HBsAg колеблется в пределах 0,05—0,2%, а наличие анти-HBsAg-антител (свидетельствующее о степени поражаемости населения) — в пределах 4—6%. Для стран Восточной Европы, Японии, Среднего Востока и ряда стран Южной Америки частота носительства HBsAg колеблется в пределах 2—7%, а анти-HВs-антител — 20—55%. В Китае, Юго-Восточной Азии, тропической Африке и некоторых странах Южной Америки носительство HBsAg достигает 8—20%, а анти-HВs- антител — 70—25%. Здесь же следует подчеркнуть, что наряду с «кровяной» и «инструментальной» передачей инфекции существует естественный путь — тесный бытовой, а также половой контакт. Отражением частоты этого естественного пути передачи являются заболеваемость детей и неонатальная инфекция. В странах первой из названных групп дети болеют редко; во второй группе заболеваемость детей высока, но редка неонатальная инфекция; в третьей группе дети болеют очень часто, высока и частота неонатальной инфекции [WHO, 1985].
Напомним также вкратце патогенез гепатита В. После заражения болезнь развивается в среднем через 3 мес, протекает тяжело (по сравнению с гепатитом А). Вирус и HBsAg обнаруживаются в последние недели инкубации и в течение 3 нед болезни. При применении более чувствительных методов диагностики срок носительства HBsAg удлиняется до 7—8 нед. Вирусемия прекращается, сменяясь образованием антител против вирусных белков—сердцевинного HBcAg, его деривата HBeAg. В остром периоде болезни выявляется активность вирусной полимеразы (о всех этих вирусспецифических белках см. ниже). При остром течении болезни также прекращается носительство HBsAg и появляются антитела против него. Однако часто болезнь принимает хроническое активное течение с развитием цирроза печени, а иногда и первичного рака печени. В случае острого течения болезни с выздоровлением может развиться хроническое, нередко пожизненное носительство HBsAg [см. Ананьев В. А., 1983; Жданов В. М. и др., 1986].
Помимо возможного сочетания гепатита В с другими бактериальными и вирусными инфекциями, включая гепатиты А и ни А, ни В, весьма распространенным спутником гепатита В являются дельта-инфекция или дельта-гепатит. Дельтаагент или, как его теперь правомочно называют дельта-вирус, — один из наиболее мелких вирусов. Его геном представляет собой однонитевую РНК с молекулярной массой около 0,5х106. РНК кодирует один белок. Вирионы имеют размер 32 нм, содержат РНК, заключенную в икосаэдрический капсид, состоящий из белковых молекул дельта-вируса. Капсид окружен внешней оболочкой, состоит из липидов и HBsAg. Дельта-вирус дефектен и размножается в присутствии или при участии вируса гепатита В. Самостоятельно он не способен вызвать заболевание, но при одновременном заражении с вирусом гепатита В или при суперинфекции резко утяжеляет течение болезни и способствует более частому развитию тяжелых форм хронической инфекции. В Западной Европе и Северной Америке он является причиной 30—40% хронического гепатита среди носителей HBsAg, а в Южной Америке (Венесуэла, Колумбия) летальность от дельта-инфекции достигает 20%.
В США и некоторых других странах к группам повышенного риска заражения гепатитом относятся гомосексуалисты, лица, ведущие беспорядочную половую жизнь, а также наркоманы. Кроме того, в рекомендациях Центра контроля болезней США в такие группы выделяют медицинских работников, персонал и больных учреждений для умственно отсталых, больных, подвергавшихся гемодиализу, реципиентов определенных групп крови, некоторые этнические группы, заключенных в исправительных колониях, пребывающих в эндемических регионах.
В СССР гепатит В распространен неравномерно. На основании примерной оценки можно заключить, что во всей стране имеется до 2 млн носителей HBsAg. В Европейской части СССР, Сибири и на Дальнем Востоке носительство HBsAg не превышает 0,5%, в республиках Средней Азии, а также в Молдавии оно достигает 4—6% и даже 9%. Частота дельтаинфекции при хроническом активном гепатите В достигает 40—60%. Первичный рак печени встречается относительно редко. Хотя официальная статистика свидетельствует, что гепатит В не превышает 10% от общего числа регистрируемых заболеваний, проведенные исследования позволяют оценить удельный вес его до 30% общего числа заболеваний вирусными гепатитами. Отметим для сравнения, что аналогичные оценочные данные по США составляют около 60%. В республиках Средней Азии довольно высока заболеваемость детей и весьма часто имеют место «естественные» заражения без «инструментальной» передачи и заражения препаратами крови. Вообще удельный вес последних в заражении гепатитом В невысок по стране в целом.
В экономически развитых странах основными методами профилактики гепатита В являются: обследование доноров на носительство HBsAg или, соответственно, собранных образцов крови, предупреждение «инструментальной» передачи и в первую очередь использование шприцев и игл одноразового пользования и др. В регионах с высокой эпидемичностью, а также в группах повышенного риска целесообразна профилактическая иммунизация. Соответствующие вакцины, приготовленные либо из плазмы крови носителей HBsAg, либо с использованием техники рекомбинантной ДНК, выпускаются в ряде стран, включая СССР.
Как уже упоминалось, вирионы гепаднавирусов имеют сферическую форму и диаметр 42 нм. Вирусная ДНК ассоциирована с вирионной полимеразой и белком. ДНК и белки заключены в капсид, образуя сердцевину вирионов. Сердцевина окружена двуслойной липидной оболочкой, в которую «вкраплены» HBsAg и белки pre-S-области (см. далее). Оболочка вирионов рыхлая и при взаимодействии с клеточной мембраной легко разрушается. В отличие от вирионов («частицы Дейна») надмолекулярные структуры («австралийский антиген») являются плотными образованиями, устойчивыми к внешним воздействиям: их удается разрушить лишь при обработке сильными детергентами и последующей обработке проназой. Эти различия между HBsAg в вирионах и частицами размером 22 нм зависят от прочности внутри- и межмолекулярных дисульфидных связей [Зайдес В. М. и др., 1985] и от отсутствия в составе указанных частиц белка pre-S-области, необходимого для адсорбции вируса на чувствительных клетках. Именно поэтому «период полураспада» частиц размером 22 нм большой и накапливающийся в крови HBsAg практически не разрушается. Число частиц размером 22 нм может превышать в 105—106 раз число вирусных частиц, достигая огромных концентраций (109—1011 в 1 мл крови).
Геном гепаднавирусов представляет собой двунитевую циркулярную ДНК с молекулярной массой около 2x106(рис. 48). ДНК имеет размер: от 3021 (вирус гепатита уток) до 3320. (вирус гепатита лесных сурков), 3311 (вирус гепатита земляных белок), 3188 (вирус гепатита человека) [Kodama К. et al., 1985] пар нуклеотидов. Структура генома всех перечисленных вирусов примерно одинакова (рис. 49). Двунитевая ДНК генома неполная: легкая нить отсутствует на протяжении 15— 45% генома. В двунитевой части генома к 5'-концу полной нити ковалентно присоединен белок, как и у полиовирусов, SV 40 или аденовирусов (Gerlich W., Robinson W., 1980; Yamashida T. et al., 1984]. При фенольной экстракции ДНК гепаднавирусов неинфекционна, но, клонированная в плазмидах ДНК с двумя полными нитями, способна вызвать гепатит А у единственного экспериментального животного — шимпанзе [Will H. et al., 1982, 1985]. Как видно из рис. 49, гены с, pre-S-S и X отделены друг от друга, а ген полимеразы занимает большую часть генома, перекрывая частично или полностью все три указанных гена [Snisky J. et al., 1979]. Все гены, в частности ген X, функциональна активны, кодируют синтез белков, против которых вырабатываются антитела [Meyers М. et al., 1986]. Геном гепаднавирусов имеет 4 открытые рамки считывания соответственно для белков С, pre-S и S, X и полимеразы. Несмотря на различия в первичной структуре гепаднавирусов, вторичная их структура сходна [Schaeffer Е., Snisky J., 1984].
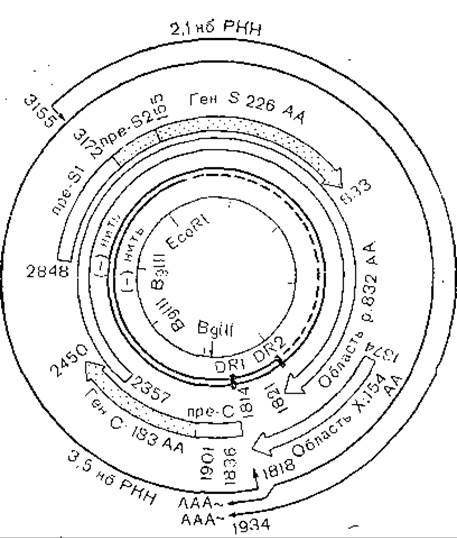
Рис. 48. Структура генома вируса гепатита В.

Рис. 49. Структура генома гепаднавирусов,
І — вирус гепатита В человека; II—IV — вирусы животных. Внутренний двойной круг — вирусная ДНК, пунктиром обозначена однонитевая структура; 1 — консервативные области гликозилирования; 2 — неконсервативные области гликозилироваиия; НBV — вирус гепатита В; WHV — вирус гепатита лесного сурка. GSHV — вирус гепатита земляной белки; DHBV — вирус гепатита пекинской утки.
Наиболее близки между собой HBsAg вирусов гепатита человека и сурков: их гомология достигает 74% [Galibert F. et al., 1981]. Оба белка иммунологически родственны [Mill- man I. et al., 1982]. Иммунологически родственны между собой HBcAg всех известных гепаднавирусов млекопитающих, чего нельзя сказать о HBsAg. Вирус уток не имеет иммунологического родства с вирусами млекопитающих.
Репродукция гепаднавирусов достаточно сложна. Она включает в себя адсорбцию вирионов, эндоцитоз и слияние мембран, достройку неполной нити, транскрипцию и трансляцию генов, репликацию генома через РНК-интермедиат, формирование и созревание дочерних вирионов. Прикрепительный белок (pre-S) взаимодействует с рецепторами гепатоцитов, которые являются также рецепторами для полимеризованного сывороточного альбумина. Впрочем, гепатотропность вирусов гепатита В неабсолютна. В опытах на шимпанзе, зараженных гепатитом В, вирус был обнаружен в лимфоцитах периферической крови при развитии хронической болезни, а у сурков, зараженных их вирусом, он регулярно обнаруживался в Т- и В-лимфоцитах и в костном мозге [Korba В. et al., 1986].
Проникновение в «летку вирионов путем эндоцитоза и слияния вирусной оболочки с клеточной мембраной, по-видимому, мало отличаются от аналогичных процессов у других оболочечных вирусов. Попадая сначала в цитозоль, сердцевины вирионов затем проникают в ядра клеток, и здесь происходят транскрипция вирусных генов, катализируемая, вероятно, клеточной полимеразой, транспорт их в цитоплазму, синтез вирусспецифических белков и обратный транспорт части из них в ядра. К сожалению, пока эти процессы изучены мало, и высказанные положения имеют скорее умозрительный характер, «ежели экспериментальные обоснования. Несомненны, однако, некоторые факты, свидетельствующие о процессировании вирусспецифических белков. HbgAg подвергается интенсивному гликозилированию, a HBcAg протеолитическому расщеплению, в результате которого образуется HBeAg [Petit М., Pillot J., 1985]. Область pre-S-S может считываться с нескольких инициирующих кодонов, в результате чего образуются белки р24, р27 и р35 [Rutter W. et al., 1984; Persing D. et al., 1985] и собственно pre-S [Schaeffer E. et al., 1986]. Отмечена значительная дивергенция гена pre-S у разных гепаднавирусов [Neurath A. et al., 1984], что, по-видимому, отражает различия в рецепторах гепатоцитов для этих вирусов и является причиной узкого спектра «хозяев» для каждого из гепаднавирусов. К этому следует добавить, что в указанной области участки pre-S1 и pre-S2 имеют свои инциирующие кодоны.
Транскрипции генов предшествует достройка неполной цепи, которая обеспечивается вирионной полимеразой сразу же после удаления внешней оболочки и доступностью сердцевины для проникновения в нее нуклеотидов. Дальнейшая судьба такой циркулярной двунитевой ДНК может быть двоякой: либо происходит дальнейшее развитие продуктивной инфекции, либо наступает интегративный процесс [Zhdanov V. М., 1974]. Предполагают, что в последнем случае область гена X является интеграционным сайтом и при трансляции в результате интеграции с клеточным геномом образуются белки слияния вирусных и клеточных генов наподобие генов gag-onc у ретровирусов [Meyers М. et al., 1986]. Геном гепаднавирусов или его фрагменты интегрируют в несколько сайтов клеточной ДНК. При этом гены, особенно гeн HBcAg, за исключением гена HBsAg, метилируются, что препятствует их транскрипции. По-видимому, с этим связана экспрессия преимущественно или только гена HBsAg в перевиваемых линиях гепатомы, а также в организме носителей HBsAg [Miller R., Robinson W., 1983]. Область интеграции генома соответствует однонитевому участку генома, поэтому достройка этой нити обязательно предшествует интеграции [Koshy R. et al., 1983]. При этом происходят фрагментирование и реаранжировка сегментов интегрированной вирусной ДНК. Из всех генов «нетронутой» остается полная транскрипционная единица гена HBsAg, что также, вероятно, является причиной экспрессии только такого гена интегрированного провируса [Shaw Y. et al., 1984]. На флангах интегрированных генов отсутствуют вирусспецифические повторные последовательности. В то же время обнаружены повторы клеточного происхождения, а также интеграция лишь части области pre-S при интеграции полного гена HBsAh [Yaginuma К. et al., 1985]. Интеграция генома гепаднавирусов лежит в основе развития первичного рака печени, хотя механизмы ее неясны. Нелишне отметить, что в этом отношении известные гепаднавирусы обладают разными онкогенными потенциями. Они наиболее выражены у гепаднавирусов сурков: у 50% зараженных животных развивается первичный рак печени.
Получено уже несколько перевиваемых мышиных клеток первичного рака печени, содержащих интегрированные геномы вируса гепатита В. Клетки одной из таких линий, PLC /PRF/5, были привиты бестимуоным мышам, у которых развились опухоли. При этом наряду с HBsAg опухоли стали продуцировать HBcAg. Таким образом, в раковых клетках сохранились гены для HBcAg, экспрессия которых возникла при пересадке клеток бестимусным мышам [Marquardt A. et al., 1984].
Репликация гепаднавирусов необычна. Предложена ее модель, включающая образование РНК-интермедиата [Summers J., Mason W., 1982; Summers J., 1984] (рис. 50). После проникновения вирионов в клетки и разрушения внешней оболочки вирионная полимераза достраивает легкую цепь ДНК (гены, кодирующие синтез вирусспецифических белков, находятся на тяжелой цепи ДНК), и ДНК становится доступной для транскрипции. При этом образуются полная плюс-нить, РНК-репликативный интермедиат, или прегеном. Одновременно происходят транскрипция генов с 4 рамок считывания и трансляция их с образованием вирусспецифических белков, включая вирусспецифическую полимеразу. Образующийся, по-видимому, путем самосборки пренуклеоид (незрелый нуклеоид) включает в свой состав прегеномную РНК и полимеразу. Последняя обеспечивает обратную транскрипцию и образование полной минус-нити, одновременно деградирует прегеномная РНК. Затем синтезируется плюс-нить и «подается» сигнал о созревании нуклеоида. На какой-то стадии до этого в незрелый нуклеоид проникает терминальный белок, ковалентно связанный с 5'-концом полной нити ДНК и формирующий кольцевую форму вирусного генома. Плюс-нить, как известно, синтезируется не полностью, и после окончания синтеза формируется внешняя липидная оболочка со встроенными в нее супермолекулярными структурами HBsAg.
Таковы в основных чертах этапы сложной репродукции гепаднавирусов. Основные положения изложенной гипотезы можно считать доказанными. В частности, в зараженных гепатоцитах обнаружен РНК-интермедиат, выделен репликативный комплекс, получены его продукты в опытах in vitro, показана устойчивость к актиномицину D синтеза минус-нити на матрице РНК-интермедиата и даже обнаружены (электронная микроскопия) предшественники нуклеоидов. Некоторые детали репродукции гепаднавирусов удобно изучать на вирусе гепатита пекинских уток, поскольку он передается вертикально (трансовариально), причем весь процесс синтеза завершается в течение созревания эмбриона в оплодотворенном яйце [O’Connel A. et al., 1983; Urban М. et al., 1985]. Репликация этого вируса воспроизведена и в первичных культурах гепатоцитов уток [Tuttleman J. et al., 1986]. Были также получены и другие модели для изучения гепаднавирусов. В опытах на Шимпанзе, зараженных вирусом гепатита В человека, и на сурках, зараженных вирусом гепатита сурков, было выявлено накопление вирусной ДНК и РНК в лимфоцитах периферической крови при хроническом течении болезни. ДНК была в виде эписом как в лимфоцитах (В- и Т-клетках), так и в костном мозге, но не в макрофагах. Эти данные открывают новые аспекты патогенеза гепатита В [Korba В. et al., 1986]. Нуждаются в проверке сообщения Е. Liang и соавт. (1986) о культивирований вируса гепатита В человека в куриных эмбрионах, обработанных нетоксигенными стрептококками.
Таким образом, в процессе репликации гепаднавирусов имеют место многочисленные этапы синтеза нуклеиновых кислот: достройка неполной нити ДНК (ДНК-зависимый синтез ДНК), транскрипция с 4 открытых рамок считывания, синтез полной нити РНК (прегеном, РНК-интермедиат), обратная транскрипция (РНК-зависимый синтез ДНК), синтез неполной легкой цепи (ДНК-зависимый синтез ДНК) и, наконец, деградация РНК-интермедиата. К этому надо добавить еще два процесса, проходящих в клетках, которые инфицированы вирусом гепатита В человека или сурков: синтез репликативного интермедиата (РНК?) дефектного дельта-вируса [Rizzetto М. et al., 1984], часто сопровождающего гепатит В, и синтез дочерних нитей ДНК этого вируса.
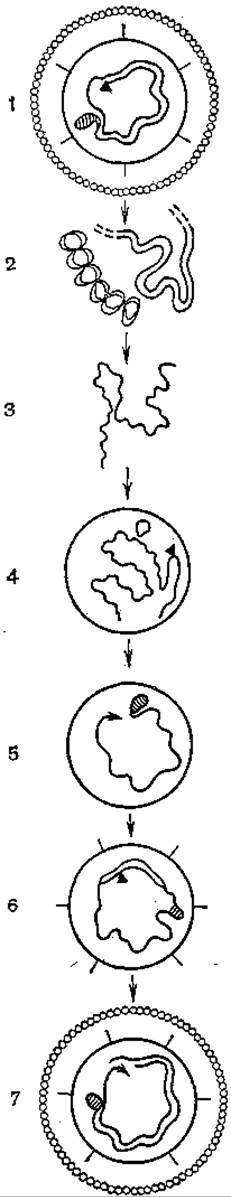
Рис. 50. Репликация генома вируса гепатита В (гипотетическая схема).
а — ДНК-полимераза; б — ковалентно связанный белок; 1 — вирион гепатита В; 2 — проникновение в клетку и созревание ДНК; 3 — транскрипция, образование полноразмерной плюс-нити РНК (прегенома); 4 — упаковка прегенома, формирование незрелой сердцевины; 5 — обратная транскрипция мииус-нити ДНК, разрушение прегенома, формирование промежуточных сердцевин; 6 — синтез плюс-нити и сигнала упаковки; 7 — созревание и выход из клетки вириона.
На относительно небольшом геноме гепаднавирусов закодирована предполагаемая полимераза. Эта область занимает большую часть генома, полностью перекрывает область pre-S-S и частично области С и X. Имеются основания считать, что открытая рамка считывания этого гена сдвинута в отношении рамки считывания области pre-S-S и рамок считывания двух других частично перекрываемых генов. Кодируемый указанным геном белок состоит из 832 аминокислотных остатков [Ohno S., 1984], он идентифицирован в клетках гепатокарциномы [Will Н. et al., 1986]. Полифункциональность этого белка несомненна хотя бы потому, что он обеспечивает по крайней мере 5 процессов: достройку легкой нити ДНК в вирионе или, точнее, в нуклеоиде (ДНК-зависимый синтез ДНК], синтез РНК-интермедиата, или прегенома (ДНК-зависимый синтез РНК), синтез полной тяжелой нити ДНК (обратная транскрипция), синтез неполной легкой нити (ДНК-зависимый синтез ДНК) и деградацию ДНК-интермедиата (функция РНКазы Н). Не удивительно, что эти функции сближают полимеразу гепаднавирусов с обратной транскриптазой ретровирусов, а может быть, свидетельствуют о филогенетической связи между этими полифункциональными белками.
Вероятно, транскрипция генов с 4 открытых рамок считывания обеспечивается клеточными полимеразами [Rutter W. et al., 1984]. Совершенно неясной остается роль гепаднавирусов в репликации РНК их дефектного сателлита — дельта-вируса.
Позже удалось культивировать дельта-вирус в присутствии вируса гепатита пекинских уток. Оплодотворенные утиные яйца заражали вирусом гепатита уток, а затем 2—6-месячным птицам вводили сыворотку, содержащую дельта-вирус. У большинства птиц были обнаружены дельта-антиген и дельта-РНК [Ponzetto A. et al., 1986]. Здесь же уместно отметить, что механизм повреждающего действия вируса гепатита В на гепатоциты, в которых происходит их репликация, неясен. Возможно, эти поражения вызываются не вирусом, а являются результатом клеточных иммунных реакций на вирусные антигены, экспрессируемые на клеточных мембранах. В свое время мы высказывали мысль, что острая дистрофия печени является проявлением отторжения целого органа в результате этих иммунопатологических процессов. Однако интеграция, сопровождающаяся продукцией HBsAg и секрецией его в кровоток, не приводит к поражению гепатоцитов. Создается впечатление, что, во-первых, такие клетки усиленно размножаются и поэтому повышают регенеративные способности печеночной паренхимы, а рак печени — это своеобразная расплата, вовсе необязательная и совсем нечастая. Во-вторых, наличие интегрированного вируса с разорванными генами, кроме «нетронутого» и даже амплифицированного гена HBsAg, является своего рода защитой от прогрессирующей инфекции, вызываемой репликацией вируса. Таким образом, мы приходим к парадоксальному выводу: длительное антигеноносительство служит гарантией незаразности крови. Эти соображения хорошо иллюстрируются на модели трансгенеза вируса гепатита В у мышей [Chisari F. et al., 1985].
Носительство HBsAg имеет уникальный характер, так как если считать, что частица HBsAg состоит из нескольких сотен молекул белка, титр частиц может достигать 1012—1013 в 1 мл крови, то эти концентрации сопоставимы с концентрациями наиболее обильных белков крови. Вероятно, помимо описанной выше блокировки, фрагментации и реаранжировки других генов вируса, это объясняется тем, что интеграция гена HBsAg происходит в участке хромосомы, где осуществляется интенсивная экспрессия генов. Но это объяснение отпало после того, как была установлена способность частиц HBsAg реагировать с полимеризированным альбумином и связываться с ним.
До сих пор речь шла о гепаднавирусах позвоночных. Показано, что вирус мозаики цветной капусты сходен с гепадна-вирусами [Marsh L. et al., 1985]. Несмотря на то что геном этого вируса в 3—4 раза больше генома гепаднавирусов, он построенно тому же типу: имеет двунитевую ДНК с неполной второй нитью. Примерная модель его репликации включает образование РНК-интермедиата и обратную транскрипцию [Pfeiffer Р., Hohn Т., 1983]. При дальнейшей экспериментальной проверке были выявлены репликативный интермедиат — РНК. с константой седиментации 355, инкапсидированная в вирионоподобные структуры ДНК, РНК-гибриды, а также гетерогенная ДНК (минус-нити) длиной 6000—8000 (полный геном) нуклеотидов, РНК—ДНК-синтезы, нечувствительные к актиномицину D, и ДНК—ДНК-синтезы, чувствительные к антибиотику, т. е. основные этапы вирусиндуцированных синтезов, характерных для гепаднавирусов.
Вирус мозаики цветной капусты, поражающий виды семейства Crucifera, имеет две рамки считывания, одна из которых обеспечивает синтез транскрипта размером 1,9 кб (регион VI), кодирующего синтез белка телец включений (по-видимому, аналогичный HBsAg гепаднавируса), а вторая — синтез транскрипта размером 8,2 кб, функции которого неясны. Эти данные получены в опытах по интеграции полного генома вируса мозаики цветной капусты в хромосомы растений с помощью плазмиды Ti [Shewmaker С. et al., 1985]. Кроме того, репликация данного вируса весьма сходна с репликацией ретровирусов, что в свою очередь объясняется сходством ДНК- и РНК-геномов этих вирусов [Dixon L. et al., 1986]. Сходство было продемонстрировано в экспериментах по рекомбинации между слабодивергировавшими (5%) штаммами вируса мозаики цветной капусты. Нелишне отметить, что ген pol вируса СПИД, онковирусов мышей и птиц имеет гомологию с геном предполагаемой полимеразы вируса гепатита В и мозаики цветной капусты [Seiki М. et al., 1983]. Вместе с тем вирус мозаики цветной капусты и другие вирусы, относящиеся к этой группе (известно 9 вирусов), имеют и существенные отличия от гепаднавирусов. Вирионы изометрические (как капсид гепаднавирусов), капсид состоит из одного белка с молекулярной массой 42 000. Диаметр вирионов около 50 нм. При транскрипции образуется либо полная нить РНК (репликативный интермедиат), либо 7 фрагментов, соответствующих, вероятно, 7 генам, в том числе белок с молекулярной массой около 60 000, который накапливается в цитоплазме в виде включений; функции его неясны. В дальнейшем было показано, что 5'-конец минус-нити является местом начала обратной транскрипции, праймером которой служит белок, ковалентно связанный с 5'-концом ДНК [Molnar-Kimber К. et al., 1984].
Синтез ДНК вируса гепатита В начинается в области первого прямого повтора (DR1), и праймером является, по-видимому, терминальный белок. В противоположность этому синтез второй нити начинается в области терминального повтора (DR2), но его 5'-конец присоединен к олигорибонуклеотиду, содержащему DR1. На рис. 51 показаны механизмы репликации и транскрипции генома гепаднавирусов, основанные на этих соображениях, а на рис. 52 продемонстрированы сходство и различие репликации гепадна- и ретровирусов.

Рис. 51. Транскрипционная и трансляционная карты генома гепаднавируса млекопитающих (GSHV). Нити ДНК показаны тонкими линиями; 1 — белок на 5'-конце минус-нити; два класса внутриклеточных РНК показаны волнистыми линиями.
В то время как 3 вируса гепатита В млекопитающих обнаруживают значительное сходство, вирус гепатита уток менее сходен с ними. Так, у него нет промежутка между генами 5 и 8, которые образуют единую рамку считывания [Mandaray Е. et al., 1984]. Кроме того, в экспериментах именно на этом вирусе было показано структурное сходство продуктов гена Р и обратной транскриптазы птиц (к этому вопросу мы еще вернемся). В дальнейших исследованиях [Miller R., Robinson W., 1986] было выявлено, что аминокислотная последовательность предполагаемой обратной транскриптазы вируса гепатита имеет гомологию с аминокислотными последовательностями ретровирусов. В частности, это обнаружили при сравнении геномов гепаднавирусов человека, сурка, земляной белки и утки с соответствующими участками геномов ретровирусов типа С, эндогенных участков ДНК-генома ретровирусов типа С, а также эндогенных участков ДНК-генома человека. Особенно выражена гомология 67 нуклеотидов региона 45 вируса гепатита В человека с длинными терминальными повторами ретро-вируса, а гомология коротких участков гептануклеотидов доходит до 90—97%. Найдена также высокая степень гомологии (41%) между 98 аминокислотными остатками сердцевинного белка вируса гепатита В и карбокситерминальным участком Р30 гена gag ретровирусов типа С мышей. Все эти данные позволяют заключить, что вирус гепатита В и ретровирусы имеют общее происхождение и вирус гепатита В является ветвью эволюционного ствола ретровирусов.
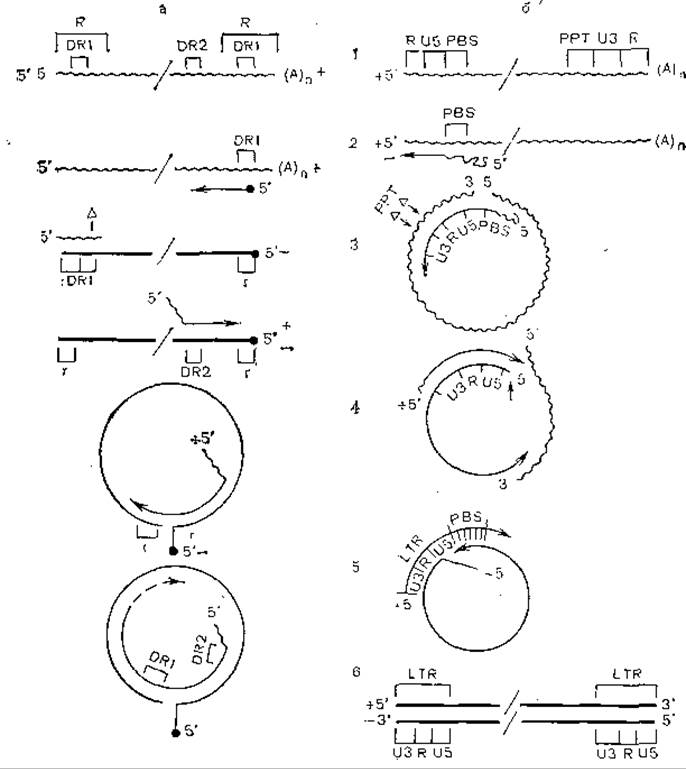
Рис. 52. Модель синтеза вирусной ДНК на матрице РНК у вирусов гепатита В (а) и ретровирусов (б).
Волнистая линия — РНК; прямая линия — ДНК, R — концевые последовательности, концевые повторы, PBS — место связывания затравки (+РНК), РРТ — полипуриновый тракт, r — комплементарная последовательность ДНК, образующая короткие дуплексы.
В заключение уместно рассказать о схеме [Varmus Н., 1983], показывающей высокую степень сходства цикла развития гепадна-, каулимо- и ретровирусов. Генеалогическое древо, исходя из монофилетического происхождения гепаднавирусов позвоночных, было построено К. Kodama и соавт. (1985). Дальнейшая эволюция вирусов гепатита В (разных серологических подтипов) была определена при сравнении плазмиды рНВ320, несущей полимеразный геном подтипа ayw вируса гепатита В [Пумпен П. и др., 1982], с ранее полученными нуклеотидными последовательностями для разных серологических подтипов. В качестве метода исследования был выбран анализ частоты синонимических нуклеотидных замен в неперекрывающихся частых генах С и Р (районы 840—1373, 1903—2307, 2462—2854). На основании полученных результатов В. Бычко (1986) построил филогенетическое древо (рис. 53), которое несколько отличается от схемы К. Kodama и соавт. Согласно схеме В. Бычко, все варианты вируса гепатита В разделяются на 3 филогенетические линии, причем подтипы ayw и adw столь же близки филогенетически, как вирусы WHV и GSHV, а подтип adr даже больше удален от первых двух филогенетически (рис. 54).
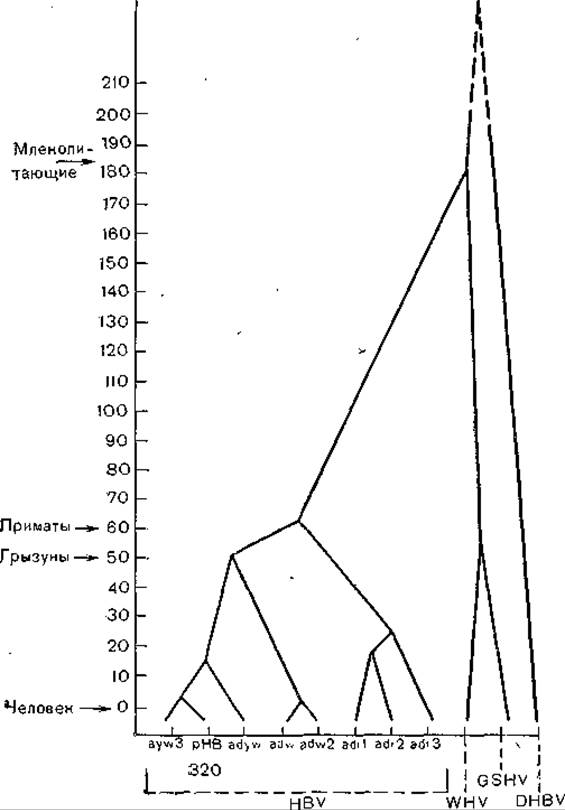
Рис. 53. Филогенетическое древо гепаднавирусов, построенное по результатам анализа частоты синонимических нуклеотидных замен в неперекрывающихся районах генов С и Р. По оси ординат — время (млн лет).
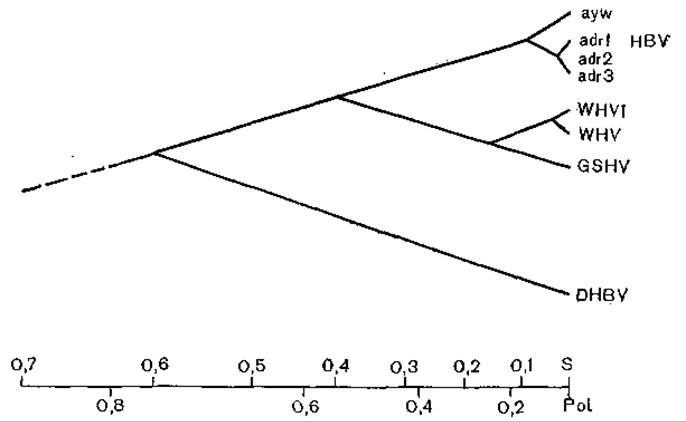
Рис. 54. Филогенетическое древо гепаднавирусов. Относительные расстояния между гепаднавирусами отражают скорость замены аминокислот Pot и S ORI. По оси абсцисс — единицы карты.
Теперь, конечно, ясно, что эта схема не охватывает всю группу вирусов, новые члены которой, несомненно, будут открыты в ближайшие годы. Какова генеалогическая связь вирусов, поражающих животных и растения, являются ли полифункциональный фермент этих вирусов и обратная транскриптаза ретровирусов продуктами дивергентной эволюции или результатом конвергенции, какие экологические связи (может быть, через членистоногих) обеспечили для этих вирусов столь далeкие экологические ниши, почему узкая специализация (узкий круг «хозяев») не помешала распространению этих вирусов среди эволюционно далеких друг от друга видов хозяев — все эти и другие вопросы требуют обширных и многосторонних исследований — от анализа структуры генов и кодируемых ими белков до изощренного и свободного от сложившихся традиций экологического анализа.