Эволюция вирусов - Жданов В. М. 1990
Специальная часть
Фаги с отростками
Большую группу высокоспециализированных вирусов прокариотов (бактерий) и низших эукариотов (грибов) представляют фаги с отростком (хвостатые фаги). В классификации вирусов [Matthews R., 1982] схематически представлены 3 группы этих вирусов, соответствующие 3 семействам: фаги с длинным отростком и сокращающимся чехлом (Myoviridae), фаги с длинным несокращающимся отростком (Sfyloviridae) и фаги с коротким отростком (Podoviridae). При более детальном описании число этих форм становится значительно больше и фаги разделены на более мелкие таксономические группы [Liss A. et al., 1981; Reanney D., Ackermann Н., 1981]. Все они являются вирусами с довольно крупным геномом в виде двунитевой линейной или циркулярной РНК. Молекулярная масса генома миовирусов около 120х106, при этом вместо тимина РНК содержит оксиметилцитозин. В пределах данного семейства выделяют группы фагов с изометрической (группа фагов Р2) и с удлиненной (Т-четные фаги) головкой. Соответственно геном этих фагов имеет 10 генов, а в составе вирионов обнаруживается 15—20 белков.
У изометрических фагов головка имеет форму икосаэдра. Диаметр головок колеблется в пределах 40—180 нм. У фагов с продолговатой головкой размер последней составляет 100х80 нм. Отросток (хвост) длинный (80—450 нм), состоит из шейки, трубки, сократительного чехла и фибрилл.
При взаимодействии с бактериями фаг прикрепляется к бактериальной клетке отростком с фибриллами, имеющийся на конце отростка лизозим разрушает клеточную стенку, чехол сокращается, и отросток проникает в цитоплазму, куда затем поступает и ДНК фага. Репликация является весьма сложным и строго регулируемым процессом, столь же сложна сборка вирионов, которые покидают бактериальную клетку после ее лизиса. Наряду с репликативным (литическим) взаимодействием (вирулентные фаги) может происходить интегративный процесс (образование профага умеренного вируса). Наконец, фаги могут существовать в виде плазмид. Эта группа насчитывает сотни вирусов, поражающих многие сотни разных видов бактерий.
У стиловирусов (группа фага λ) геном имеет размер около 33х106, ДНК с липкими концами, вирионы содержат около10 структурных белков. Выделяют также две группы фагов — с изометрической и удлиненной головкой. Отросток не снабжен сокращающимся чехлом. Это также многочисленная группа. Вирусы могут вызвать литическую либо интегративную инфекцию (соответственно вирулентные и умеренные фаги).

Рис. 45. Организация генома фага Т7.
1 — процент 77-геномов; 2 — транскрипция; 3 — 77 ДНК. и число генов; 4 — функциональные группы генов.
У подовирусов геном имеет молекулярную массу около 25х106. Вирионы содержат до 12 белков. Диаметр головки вирионов 65 нм, длина короткого отростка 17 нм, имеются фибриллы. В этой группе также есть группы с изометрической и продолговатой головкой. Для этих групп вирусов характерно наличие ковалентно прикрепленного фосфодиэфирной связью к 5'-концам ДНК терминального белка. У фага 029 Вас. subtilis таким белком является р28. Подобные терминальные белки обнаружены у фагов Ср-1, PRD1 и др.
Рассматриваемым группам фагов посвящена чрезвычайно обширная литература, поэтому нет необходимости кратко излагать основные данные о морфологии и архитектуре вирионов бактериофагов, их химическом составе, структурных и функциональных белках, цикле репродукции, особенностях взаимоотношений с «хозяйскими» клетками. Поэтому ограничимся некоторыми иллюстрациями, позволяющими составить общее представление об этих фагах.
Фаг Р22 имеет короткий отросток [Suskind М., Bottstein D., 1978], близкородственны фаги Т3 и Т7 [Krueger D., Schroeder С., 1981]. Молекулярная масса ДНК этих фагов 25х106— 30х106; на ДНК идентифицирован ряд генов (рис. 45). Порядок их «действия» сходен у фагов групп Podoviridae и у лямбд Styloviridae. Эти данные свидетельствуют о сложности строения генома рассматриваемой группы и строгой регуляции экспрессии генов, кодирующих синтез структурных и функциональных белков. Репликация фаговой ДНК показана условно на рис. 46. Весь цикл репликации обеспечивается вирусной системой синтеза ДНК (расплетающий белок, примаза, полимераза, лигаза) и в общих чертах повторяет синтез «хозяйской» ДНК.
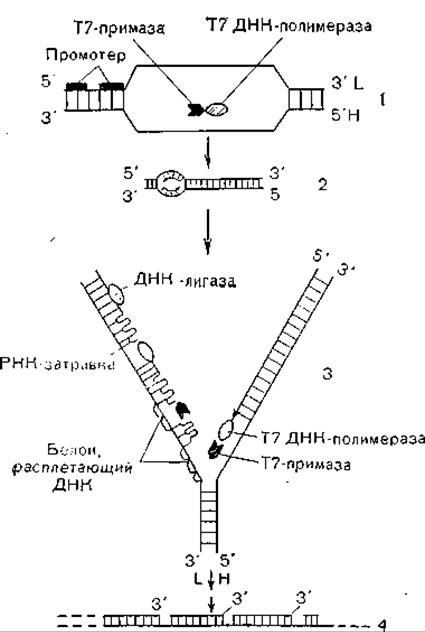
Рис. 46. Этапы репликации ДНК фага Т7.
L— легкая и Н— тяжелая нити; I — первичная инициация; 2 — «окообразная» промежуточная форма; 3 — репликационная вилка; 4 — конкатемеры.
Процесс формирования (морфогенеза) вирионов детально изучен на модели фага Т4 (Myovlridae). Как видно из рис. 47 [Wood W., 1978; 1980; Kellenberger Е., 1980; Tsugita A. et al., 1980], в этом процессе участвуют 14 белков. Описываемые фаги относятся к высокоспециализированным вирусам.
Теперь попытаемся суммировать данные о происхождении и эволюции фагов рассматриваемой группы. К сожалению, как и о вирусах большинства других групп, о происхождении фагов с отростком нельзя даже строить догадки, они появились как Deus ex machinae, без малейшего «намека» на возможные источники их происхождения. Конечно, фаги с отростком — это древние формы, эволюция которых длилась многие сотни миллионов лет, если не больше, так как, с одной стороны, они поражают практически все основные группы бактерий, включая цианобактерии, а с другой стороны, в одной и той же группе бактерий можно встретить самые разнообразные формы хвостатых фагов (пример фагов Pseudomonas и Bacillus). Так, у Pseudomonas при исследовании 62 фагов выделены 17 морфологических групп фагов с отростком, среди 99 фагов Bacillus выделено 10 групп.
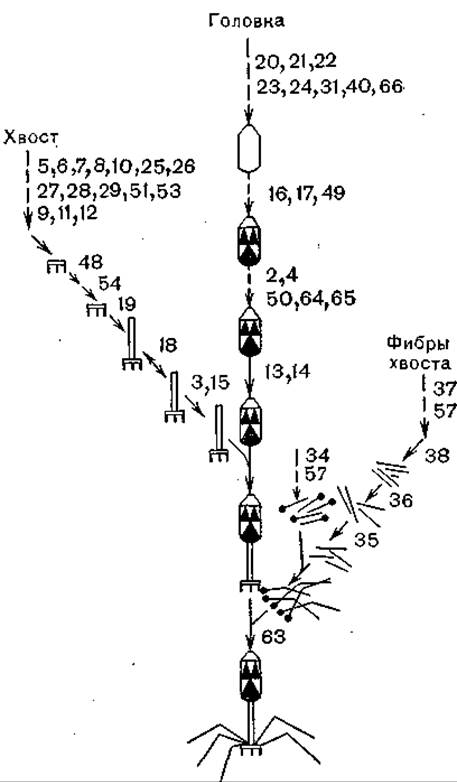
Рис. 47. Пути сборки бактериофага Т4. Пунктиром указаны этапы, которые не выявлены in vitro; цифры указывают номера генов.
В ходе длительной эволюции сложились очень специализированные структуры, не имеющие аналогов среди вирусов, появившихся позже и поражающих эукариотические организмы. Хочется надеяться, что в ближайшие годы будут найдены критерии, по которым станет возможным определить эволюционное родство и построить генеалогическое древо хотя бы части этих многочисленных вирусов.
Гораздо больше информации можно получить о возможных связях внутри рассматриваемых групп. Но прежде всего следует отметить, что эти группы явно не изолированы друг от друга и между ними имеются взаимосвязи. Так, ген 13 фага Р22 (подовирус) кодирует синтез белка с молекулярной массой 11 500, который имеет 89% гомологии с белком 5 фага λ (стиловирус). Ген 19 фага Р22 кодирует синтез белка с молекулярной массой 16 000, проявляющего некоторую гомологию с лизозимом фага Т4 (миовирус), хотя он не гомологичен белкам и Р и RZ фага λ, выполняющим аналогичные функции [Rennel D., Potcete А., 1985]. Эти данные можно трактовать по-разному. Во-первых, еще недостаточно морфологических критериев для выделения таксономических групп, тем более таких, как семейство. В данном случае длина отростка, гибкость или ригидность его, наличие или отсутствие сокращающегося чехла недостаточны, по-видимому, для выделения соответствующих групп вирусов в семействе. Во-вторых, поскольку одну и ту же клетку могут одновременно населять несколько фагов, возможны процессы рекомбинации — обмен генами у разных вирусов. Поэтому дивергентная дихотомия вряд ли была единственным путем видообразования у фагов.
Эволюцию фагов следует рассматривать не только как эволюцию паразитов, патогенных для бактерий, но и как сопряженную эволюцию двух партнеров, каждый из которых вносит свой вклад в процветание вида. Именно с этой точки зрения следует рассматривать феномен лизогении и лизогенные фаги [Herskowitz I., Hagen D., 1980]. Дополнительная генетическая информация, вносимая в геном «хозяйской» клетки, с одной стороны, обеспечивает иммунитет против родственного вирулентного фага, а с другой, может привнести и другие виды информации (устойчивость к антибиотикам, новые ферменты, токсины и др.), которые были «захвачены» фагом при «вырезывании» из лизогенной культуры бактерий. Фаги могут стать источниками происхождения плазмид, которые нередко несут эти полезные свойства в «чистом» виде, без дополнительного генетического груза.
Особый интерес представляют фаги, имеющие в своем геноме гены токсинов (дифтерийные фаги, фаги клостридий тетануса и ботулизма, фаги энтеробактерий и холерных вибрионов, стафилококковые фаги). Наиболее подробно изучены фаги дифтерийных коринебактерий, продуцирующие дифтерийный токсин. Сами по себе дифтерийные бактерии нетоксигенны и становятся таковыми при заражении их умеренными бактериофагами (В, cv и др.), несущими ген дифтерийного токсина. Будучи умеренными, эти бактериофаги интегрируют, с геномом коринебактерий, и экспрессия гена токсина обеспечивает продукцию токсина бактериальной клетки [Rappuoli R. et al., 1983]. Нуклеотидная последовательность гена определена как у В [Greenfeld L. et al., 1983], так и cv [Ratti G. et al., 1983] бактериофагов. В процессе биосинтеза происходят протеолитическое расщепление полипептидной цепи на субъединицы А (21 000) и В (40 000) и последующее соединение субъединиц дисульфидными связями. Причем обе части токсина — адресная и токсофорная — приобретают окончательную конформацию. Адресный компонент (фрагмент В) взаимодействует с клеточными мембранами, и молекула токсина проникает через везикулы с кислым значением pH в цитозоль [Donovan et al., 1981], а токсофорный компонент (фрагмент А) инактивирует фактор элонгации 2, тем самым в клетке прекращается синтез белка, и клетка погибает [Zalman L., Wisnieski В., 1984].
Сходные по структуре (две функционально разные субъединицы) экзотоксины широко распространены у бактерий, хотя «точкой приложения» токсофорного компонента могут быть разные клеточные системы. Наиболее сходны с дифтерийным токсином нейротоксины клостридий ботулизма и тетануса [Hoch D. et al., 1985]. Экзотоксины Pseudomonas aeruginosa и Shigella shigae также имеют «точкой приложения» систему биосинтеза белка, холерогенный токсин и термолабильный токсин кишечной палочки действуют на аденилатциклазную систему, стафилококковый токсин обладает NAD-гликогидролазной активностью [Еремчук Ю. В., 1985], хотя некоторые токсины имеют другую структуру, например, токсин коклюшной палочки [Brandt S. et al., 1985]. Хотя эти токсины в общем специфичны для разных фагов и их «хозяев»-бактерий, видовые барьеры преодолимы при использовании техники рекомбинантных ДНК (например, продукция дифтерийного токсина кишечной палочки) [Leong D. et al., 1985].
Происхождение экзотоксинов и токсигенных фагов далеко не ясно. Во-первых, не все даже названные токсины привносятся в бактериальные клетки фагами, скорее наоборот: лишь для некоторых токсинов доказано привнесение в бактериальные клетки бактериальными вирусами. Во-вторых, вполне вероятно, что экзотоксины первоначально возникли в бактериальных клетках, и лишь вторично их гены были захвачены фагами и включены в их геномы. Кроме того, токсины могут продуцироваться плазмидами (см. главу 6).
Значение токсигенных фагов можно проиллюстрировать на примере токсигенных дифтерийных фагов. Сама по себе дифтерийная коринебактерия нетоксигенна, не обладает инвирионными свойствами и персистирует на слизистых оболочках. При заражении умеренным токсигенным дифтерийным фагом продуцируемый токсин вызывает некроз слизистых оболочек и резко улучшает условия для размножения коринебактерий, компенсируя этим самым дополнительный генетический груз, обусловленный интеграцией вирусного генома в клеточный. Если эти соображения правильны, то при высоком антитоксическом иммунитете у населения на дифтерийную интоксикацию токсигенные коринебактерий будут постепенно вытесняться нетоксигенными, так как дополнительный генетический груз в виде профага не будет давать преимуществ токсигенным бактериям, поскольку ткани защищены от токсина антитоксическим иммунитетом.
В процессе эволюции интегрированные провирусы, содержащие гены для экзотоксинов, могли претерпеть мутации, сделавшие невозможным их вырезывание, и тогда мы относим токсичность к гену бактерии, если не сможем выявить дефектный, но токсигенный профаг. Здесь же следует рассмотреть ингибицию репликации бактериофагов. лизогенами и экстра-хромосомными элементами [Dinkworth D. et al., 1981]. Этот феномен сначала был обнаружен при изучении фага % кишечной палочки. В лизогенном состоянии фаг угнетает размножение Т-четных фагов (Т2, Т4, Тб), точнее, их rll мутантов, не затрагивая прераннюю и раннюю стадии их синтеза, но приостанавливая образование поздних продуктов и сборку вирионов. Это действие связывают с геном rех фага X. Этот ген также угнетает размножение фагов Т1 и Т5. Сходным действием обладают и другие лизогенные фаги — фаги Р1 и Р2 энтеробактерий, хотя механизмы такой ингибиции иные. Профаг Р22 сальмонелл также угнетает размножение как собственного, так и многих других суперинфицирующих фагов. В этом случае также идентифицирован соответствующий ген, ответственный за ингибицию.
В дальнейшем было показано, что угнетение репликации и абортивная инфекция вирулентных фагов могут быть вызваны экстрахромосомными факторами типа плазмид, в частности фактором F. В этом случае имеют место сложные взаимоотношения между фагами и «хозяйскими» клетками. Ингибированию подвергается размножение фагов Т7, ФІ, ФІI, W31 и λ, имеющих большие области гомологии ДНК. Некоторые из этих фагов адсорбируются преимущественно мужскими (W31), другие — женскими (ФII, Т7) клетками. В этих случаях угнетаются поздние синтезы: при синтезе мРНК всех классов (I—III) транслируются только мРНКІ (трансляционный контроль).
Описано также угнетающее действие факторов R на размножение некоторых фагов (λ, Р22, Т7). Ингибирующее действие колициногенов на фаги Т5, BF23, Т7, W31, по-видимому, связано с общим угнетением синтезов «хозяйской» клетки.
Подводя итоги изложенному, можно выделить 3 главных механизма угнетения репликации фагов лизогенными фагами и экстрахромосомными элементами — резистентность клеток, исключение суперинфекции и рестрикция.