Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Газохроматографический анализ производных аминокислот. Состояние проблемы. Возможности и ограничения метода
Газовая хроматография производных аминокислот
За исключением амидов (Асн и Глн), ГХ-анализом можно обнаружить все природные аминокислоты [35, 121]: Гли, Ала, Вал, Лей, Иле, Сер, Тре, Про, Опр, Фен, Цис, Мет, Асп, Глу, Тир, Лиз, (Орн), Три, Гис, Apr, и Цис-Цис. Как четко продемонстрировано Джонсоном и др. 142], большое число неприродных или редких аминокислот также может легко подвергаться ГХ, однако здесь мы не будем их рассматривать.
Разделение производных аминокислот с помощью ГХ, которое было описано в предыдущих разделах, наталкивается на ряд трудностей, объясняемых несколькими причинами. Как уже упоминалось, раствор природных аминокислот представляет собой сложную смесь соединений различной летучести и полярности. Для этой смеси характерен широкий интервал удерживаемых объемов и необходимы высокие температуры разделения. В некоторых случаях, например для метиловых эфиров ДНФ-аминокислот, ГХ- анализ удается провести только на коротких колонках с малым количеством жидкой фазы. С другой стороны, наиболее летучие простые аминокислоты представляют собой близкие по структуре (в некоторых случаях изомерные) соединения, и для их разделения необходимы колонки с высокой избирательностью. Положение может еще более осложниться из-за того, что некоторые О-замещенные оксиаминокислоты выходят в тех же интервалах удерживаемых объемов и их пики могут накладываться на пики вышеупомянутых аминокислот. Этим проблемам уделяется особое внимание в работе [191, где показано, что, несмотря на использование более 80 различных жидких фаз, так и не удалось количественно разделить н-амиловые эфиры следующих ТФА-аминокислот: Ала, Вал, Гли, Иле, Лей, Сер, Тре. В данном случае неудачное разделение происходит главным образом из-за О-ТФА-производных Сер и Тре. Как многократно наблюдали, производные со свободной ОН-группой имеют большие удерживаемые объемы и не мешают разделению.
Несмотря на упомянутые недостатки, все же образование летучих производных из сложных аминокислот с большим молекулярным весом является определенным доводом в пользу применения этой методики. С другой стороны, этим производным присущи нежелательные для ГХ особенности, например тенденция к образованию “хвостов” и несимметричных пиков. В этой связи следуeт отметить, что разделение различных ациламинокислот зависит также от эфирных групп. Влияние последних со всей очевидностью продемонстрировано сравнительным исследованием [42] н-бутиловых, изобутиловых, н-амиловых и изоамиловых эфиров ацетиламинокислот. Поэтому можно рассчитывать на то, что при использовании других эфирных групп и для ТФА-аминокислот можно добиться лучшего разделения. Это предположение подтверждено в работе Макисуми и Сарофа [60], которая будет рассмотрена позднее.
Все природные аминокислоты можно разделить в изотермических условиях только при использовании разных температур, а зачастую и разных колонок [19, 38, 42, 60]. В связи с этим повышаются требования к прибору и увеличивается время анализа, причем для многократного внесения образца необходимы большие количества вещества. Указанные трудности были преодолены искусным комбинированием трех газовых хроматографов [60], работающих при различных температурах с колонками разной длины, в результате чего для полного анализа достаточно однократного внесения образца. Разделение аминокислот проводится в трех параллельных группах. Время всего анализа сводится ко времени проведения анализа группы соединений, движущихся наиболее медленно. Схема прибора представлена на фиг. 72.
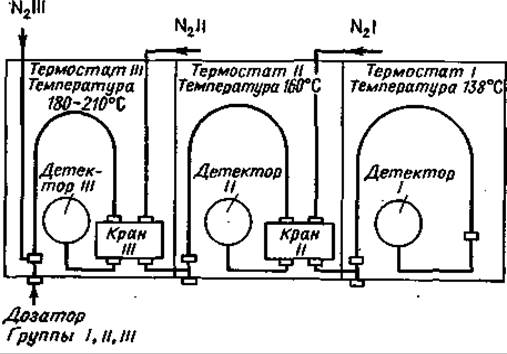
Фиг. 72. Схема прибора, на котором проводили исследования Макисуми и Сароф [60].
Образец метилового эфира ТФА-аминокислоты вводят в прибор III. Краны III и II установлены так, что все три прибора соединяются последовательно. Более летучие производные при высокой температуре (180—210 °С) очень быстро проходят через колонку III и поступают на колонку II. После регистрации Фен в детекторе III кран III устанавливают таким образом, что последующие аминокислоты Гис, Тир, Орн, Лиз, Apr и Цис-Цис не переходят на следующую колонку, а регистрируются детектором III.
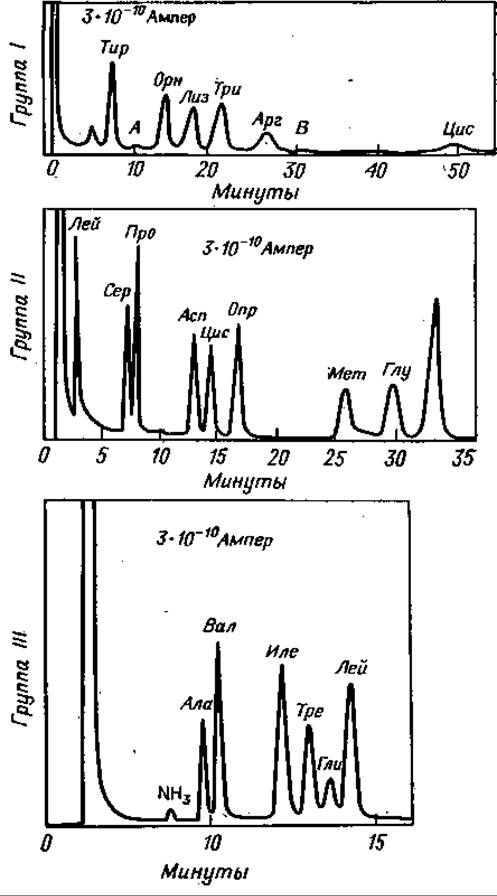
Фиг. 73. Разделение метиловых эфиров ТФА-аминокислот.
Группа Ш: 204°С; стальная колонка (длина 0,5 м, диаметр 2,7 мм) содержит 2% неопентилгликосукцината на хромосорбе W; скорость потока N2 13,3 мл/мин. Группа II: 161°С; стальная колонка (длина 4,5 м, диаметр 2,7 мм) содержит 2% неопентилгликосукцината на хромосорбе W; скорость потока N229,8 мл/мии. Группа III: 137°С; та же колонка, что и для группы I1; скорость потока N211,4 мл/мин [60].
Тот же процесс затем происходит на колонке II: и здесь более летучие вещества быстро выходят при температуре колонки 160° С. После регистрации Лей в детекторе II, кран II устанавливают так, чтобы следующие аминокислоты Сер, Про, Асп, Цис, Опр, Мет, Глу и Фен регистрировались бы на приборе II. Наконец, остающиеся аминокислоты Ала, Вал, Иле, Тре, Гли и Лей полностью разделяют и определяют в приборе І (138° С). Весь анализ перечисленных аминокислот занимает около 30 мин. Пики аминокислот последней группы будут самыми широкими, поскольку эти компоненты были подвергнуты трехкратной хроматографии, однако их тоже можно количественно проанализировать [60]. На фиг. 73 показаны хроматограммы подобного анализа, а его данные представлены в табл. 15.
На одной колонке ТФА-производные природных аминокислот можно разделить только с помощью программирования температуры [16, 38, 131]. Наряду с такими хорошо известными параметрами, как скорость нагрева, поток газа, тип и количество жидкой фазы, важную роль играет и длина колонки [16]. Ее чрезмерное увеличение приводит к худшему разрешению: очевидно, в основе подобных эффектов лежат структурные различия аминокислотных производных. В табл. 15 указаны условия для наилучшего разделения. Как видно из хроматограммы фиг. 74, даже в специально подобранных условиях полное разделение достигается не во всех случаях. Тем не менее такой анализ вполне удовлетворителен для качественного обнаружения аминокислот. Ярким примером эффективности данного метода послужила качественная идентификация всех аминокислот, входящих в состав рибонуклеази [16].
Насколько нам известно, за исключением эфиров ТФА-аминокислот [16, 27, 38, 131], метиловых эфиров ДНФ-аминокислот [66] и гексафтороксазолидинонов [102], другие производные не пытались разделять с программированием температуры. Тем не менее вполне можно предположить, что с помощью этого метода ГХ любого вещества значительно упрощается и, вероятно, улучшается. Характеристики ГХ-анализа наиболее важных и достаточно подробно описанных методик приведены в табл. 15.
Основное достоинство качественного ГХ-анализа аминокислот состоит в быстром разделений и достоверной идентификации компонентов неизвестной смеси. Однако окончательно идентифицировать органические соединения на одной колонке нельзя — ни по известным относительным удерживаемым объемам, ни по известным стандартным соединениям. Поэтому компоненты необходимо хроматографировать на нескольких колонках различной полярности. Правда, подобрать несколько таких колонок, имеющих удовлетворительную разрешающую способность, довольно трудно. Если задача сводится к обнаружению природных аминокислот, то их можно определить и на одной колонке, но все-таки гораздо лучше фракционировать производные аминокислот на нескольких колонках и характеризовать их величинами относительных удерживаемых объемов. Например, присутствие неизвестной или необычной аминокислоты можно установить однозначно только при сравнении результатов, полученных на разных колонках. Недостаток надежных данных об относительных удерживаемых объемах и соответствующих температурах удерживания для производных аминокислот препятствует более широкому применению ГХ в этой области. Было бы желательно выбрать для подобных измерений стандартное соединение; эту роль могло бы играть соответствующее производное неприродной аминокислоты, например норлейцина. Правда, из-за весьма заметных различий между аминокислотными производными сравнения с единственным стандартом вряд ли достаточно. По вышеупомянутым причинам в этом обзоре мы не приводим величин удерживаемых объемов различных производных аминокислот.
Таблица 15 Газовая хроматография аминокислот
Внесение образца |
Разделяющая колонка |
||||||||
Производное аминокислоты |
Растворитель |
количество1, мкмоль |
способ внесения |
Температура, °С |
длина, м |
диаметр, см |
материал |
Носитель, меш |
Жидкая фаза, % по весу |
ТФА-АК-метиловый эфир |
Ацетон |
0,02 |
Испарительная камера |
230 |
0,75 0,75 |
0,4 0,4 |
Сталь Сталь |
Газохром Р Газохром Р (80—100) |
1% НГС3 1,5% SE 303 |
ТФА-АК-метиловый эфир |
(CF3CO)2О |
0,02 |
То же |
295 |
0,61 |
0,3 |
Сталь |
Газохром Р (80—100) |
5% НГС |
ТФА-АК-метиловый эфир |
(CF3CО)2О +этилацетат |
0,1 |
Прямой ввод в колонку |
204 |
0,47 |
0,23 |
Сталь |
Хромосорб W |
2% НГС |
4,57 |
0,23 |
Сталь |
(60—80) |
2% НГС |
|||||
4,57 |
0,23 |
Сталь |
2% НГС |
||||||
ТФА-АК-бутиловый эфир |
Ацетон |
0,4 |
Испарительная камера |
265 |
2 |
0,63 |
Сталь |
Газохром А (60—80) |
1% НГС |
ТФА-АК-бутиловый эфир |
СНСl3 + + (CF3CО)2О |
0,2 |
Прямой ввод в колонку |
67 |
1 |
0,3 |
Стекло |
Газохром А (60—80) |
1% НГС |
Ацетил-АК-н-амиловый эфир |
Бензол |
2 |
Испарительная камера |
300 |
2,44 |
0,5 |
Сталь |
Хромосорб W (60—80) |
1% карбовакс 1540 |
0,61 |
0,5 |
Сталь |
0,5% карбовакс 1540 |
||||||
ДНФ-АК-метиловый эфир |
Диметоксиэтан |
_ 2 |
2 |
1,8 |
0,3—0,5 |
Стекло |
Газохром Р (100—140) |
1% SE 30 или 1% QF1 |
|
Производное аминокислоты |
Температура, °С |
Скорость потока, мл/мин |
Газноситель |
Детектор |
Прибор |
Детектированные природные аминокислоты |
Источник данных |
ТФА-АК-метиловый эфир |
Начало 95°С, линейное программирование 4 град/мин до 225°С |
60 |
N2 |
ПИД (230) |
Шимадзу Сейсакушо, мод. GC-1B |
Гли, Ала, Вал, Лей, Про, Асп, Глу, Сер, Тре, Мет, Фен, Опр, Лиз, Тир, Три |
[38]; |
ТФА-АК-метиловый эфир |
Начало 65°С, линейное программирование 1,5 град/мин, через 20 мин — 2 град/мин, после 42,5 мин — 4, Оград/ мин до 200°С, затем постоянная |
18 |
Ar |
ß-Ионизационный детектор |
Джеррел ЭШ, мод. 700 |
Гли, Ала, Вал, Лей, Иле, Про, Асп, Глу, Сер, Тре, Цис, Мет, Опр, Фен, Тир, Лиз, Орн, Три, Apr, Гис, Цис—S—S—Цис |
[16] |
ТФА-АК-метиловый эфир |
204 161 137 |
13,3 29,8 11,4 |
N2 N2 N2 |
ПИД ПИД ПИД |
Самодельный |
Тир, Орн, Лиз, Три, Apr, Гис, Цис—S—S—Цис, Про, Фен, Сер, Тре, Опр, Асп, Глу, Цис, Мет, Гли, Ала, Вал, Лей, Иле |
[60] |
ТФА-АК-бутиловый эфир |
Начало 75°С, через 5 мин — градиент 5,6 град/мин, после 21 мин — 7,9 град/мин до |
128 |
n2 |
ПИД (250) |
F and М, мод. 500/1609 |
Гли, Ала, Вал, Лей, Иле, Про, Асп, Глу, Сер, Тре, Мет, Фен, Тир, Орн, Лиз, Три, Apr, Гис, Цис—S—S—Цис |
[131] |
ТФА-АК-бутиловый эфир |
220°С, затем постоянная Начало 67°С, через 6 мин — градиент 3,3 град/мин до 218°С |
38 |
n2 |
ПИД |
F and М, мод. 400 |
Гли, Ала, Вал, Лей, Иле, Про, Асп, Глу, Сер, Тре, Цис, Мет, Опр, Фен, Тир, Лиз, Три, Гис, Цис—S—S—Цис |
[27] |
Ацетил-АК-н-амиловый эфир |
Постоянная 125°С, через 23 мин поднимают до 148°С 148 |
60 240 |
Ar Ar |
ß-Ионизационный детектор |
Барбер Колман, мод. 10 |
Гли, Ала, Вал, Лей, Иле, Про, Асп, Сер, Тре, Цис, Мет, Опр, Фен, Асп, Глу, Мет, Опр, |
[42] |
Тир, Лиз |
|||||||
ДНФ-АК-метиловый эфир |
175 202 |
— |
Ar Ar |
ß-Ионизационный детектор |
2 2 |
Гли, Ада, Вал, Лей, Иле, Про, Асп, Глу, Мет, Фен |
[66] |
1 Количество каждой внесенной аминокислоты.
2 Не указано.
3 Соединялись две колонки (НГС + SE 30).
Использованные сокращения: НГС — неопентилгликосукцинат, SE 30 — силиконовый каучук SE 30. QF 1 — фторсилнконовый каучук QF 1, ПИД — пламенно-ионизационный детектор.
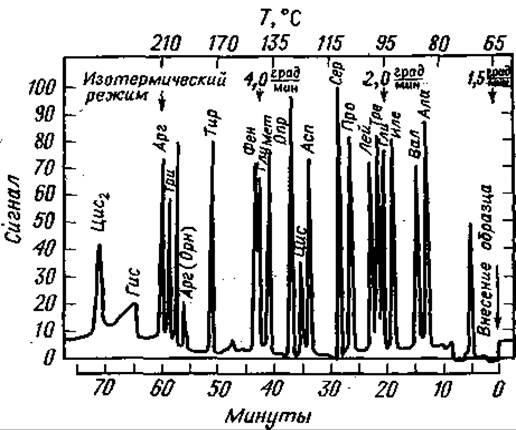
Фиг. 74. Разделение метиловых эфиров ТФА-аминокислот [16].
Стальная колонка (длина 0,6 м, внутренний диаметр 1,5 мм) содержит 5% неопентилгликосукцината на газохроме Р (80—100 меш); скорость потока Аr 18 мл/мин. Начало разделения при 65°С; линейное программирование температуры с градиентом 1,5 град/мин, через 20 мин — 2,0 град/мин, через 42,4 мни — 4 град/мин вплоть до 200°С, после чего режим делают изотермическим.
Исследуя различные производные одного и того же соединения, можно убедительно идентифицировать аминокислоты методом ГХ. Если учесть большое влияние N-защитных групп на хроматографическое поведение аминокислот, из сравнения, например, ТФА-, ацетил- и ДНФ-соединений с различными эфирами N-ацил-производных можно извлечь очень интересную информацию [64]. Следует отметить также, что после разделения компоненты можно собрать и подвергнуть анализу с помощью других методов. Складывается впечатление, что из-за необходимости получать производные и, следовательно, сравнительно больших затрат вещества, другие методы, используемые в этой области, обладают преимуществами перед ГХ. Однако указанные недостатки компенсируются тем, что сложные процедуры разделения и идентификации, которые были бы очень дорогостоящими в случае применения других методов, можно выполнить с помощью ГХ за короткое время и с высокой надежностью, причем все это относится и к аминокислотам-стереоизомерам. Как указывалось при рассмотрении гексафтороксазолидинонов, Иле и алло-Иле можно быстро и количественно разделить в 50-метровом стальном капилляре с полифениловым эфиром OS 138 (Perkin-Elmer) при 80° С. Джонсон и др. [42] описали аналогичное разделение Тре и алло-Тре в виде N-ацетил-н-бутиловых эфиров на колонке длиной 244 см, содержащей 5% карбовакса 1540 на хромосорбе W (60—80 меш) при 146° С. Этот метод с успехом применен для установления структуры циклодепсипептида [80]. Описано также разделение аминокислот в форме N-ТФА-н-бутиловых эфиров на капилляре с апиезоном L [93].