Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Химический состав белков
Общая характеристика аминокислот
Аминокислотами называют органические карбоновые кислоты, в радикале которых один или более атомов водорода замещены аминогруппой. В большинстве случаев общая формула аминокислоты характеризуется наличием аминогруппы в a-положении по отношению к карбоксильной группе:
![]()
Исключение составляют только те аминокислоты, которые содержат более одной карбоксильной или аминогруппы, а также аминокислоты, у которых аминогруппы не связаны с а-углеродным атомом. Поскольку большинство аминокислот обладает асимметрическим атомом углерода, то они могут существовать в двух оптически активных формах. В качестве эталона сравнения для определения конфигурации аминокислот была принята молекула левовращающего серина. Пространственная конфигурация последнего идентична таковой L-глицеринового альдегида, который служит эталоном для всех L-сахаров:
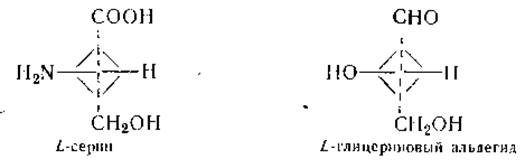
Все аминокислоты, обнаруживаемые в белках, имеют L-кoнфигурацию, хотя направление вращения этих аминокислот может быть различным. Напомним, что направление вращения обозначается знаком (+) для правовращающих соединений и знаком (—) —для левовращающих. Из природных аминокислот, за исключением серина, треонина, цистина, цистеина, метионина и лейцина, все правовращающие.
D-аминокислоты встречаются в живых объектах сравнительно редко. Они обнаружены, например, в клетках некоторых микроорганизмов в свободном виде и в виде пептидов. Интересно, что D-аминокислоты содержатся либо в соединениях, ядовитых для некоторых организмов (такие антибиотики, как полимиксин, тироцидин, грамицидин), либо в образованиях, выполняющих защитные функции и призванных противостоять гидролитическому действию некоторых энзимов (стенки ряда бактерий).
В настоящее время известно свыше 80 аминокислот, обнаруживаемых в составе различных соединений и встречающихся также в свободном виде. Из них в гидролизатах белков регулярно обнаруживают только 20 аминокислот и 2 амида. Эти аминокислоты различаются природой бокового радикала; на основании этого признака их можно классифицировать следующим образом:
I. Алифатические аминокислоты
Моноамнномонокарбоновые:
Глицин (Гли)
Аланин (Ала)
Лейцин (Лей)
Изолейцин (Иле)
Валин (Вал)
Оксимоноаминомонокарбоновые:
Серин (Сер)
Треонин (Тре)
Моноаминодикарбоновые:
Аспарагиновая кислота (Асп)
Глютаминовая кислота (Глю)
Амиды моноаминодикарбоновых кислот:
Аспарагин (Асн, Асп ∙ NH2 или Ac-NH2)
Глютамин (Глн, Глю∙NН2 или Глю-NН2)
Диаминомоyокарбоновые;
Аргинин (Apr)
Лизин (Лиз)
Серусодержащие:
Цистеин (Цис)
Цистин, половина (Цис или Цис)
Метионин (Мет)
ІІ. Ароматические аминокислоты
Фенилаланин (Фен)
Тирозин (Тир)
III. Гетероциклические аминокислоты
Триптофан (Трп или Три)
Гистидин (Гис)
Пронин (Про)
Оксипролип (Опро)
Поскольку в биохимии помимо химической номенклатуры чаще применяют тривиальные названия аминокислот, то последние и приводятся в настоящей классификации. В скобках даются общепринятые в настоящее время сокращения этих названий. Формулы перечисленных аминокислот приводятся в табл. 2.
Из перечисленных 22 аминокислот 11 необходимы для роста и развития животных и человека, не синтезируются в организме и должны вводиться с пищей (так называемые незаменимые аминокислоты). К ним относятся валин, лейцин; изолейцин, треонин, метионин, лизин, финилаланин, триптофан, аргинин, тирозин и гистидин. Правда, последние три аминокислоты не являются незаменимыми для некоторых животных на определенных этапах развития и роста. Однако первые восемь аминокислот абсолютно незаменимы.
Природные аминокислоты представляют собой белые кристаллические вещества, устойчивые в твердом состоянии при температуре 20—25°. Их растворимость в воде сильно варьирует. Лучше всего растворяются пролин, оксипролин и глицин (162, 36 и 25 г в 100 мл воды соответственно), хуже всего — тирозин и цистеин (0,045 и 0,011 г в 100 мл). При этом хлоргидраты и натриевые соли аминокислот более растворимы в воде, чем свободные аминокислоты. Эти производные сравнительно хорошо растворяются и в абсолютном спирте, тогда как растворимость свободных аминокислот в нем очень незначительна (предельная концентрация 0,0003—0,002 М). Единственным исключением из этого правила является пролин — при 20° в 100 мл спирта растворяется 1,6 г этой аминокислоты. На растворимость аминокислот в воде влияет и присутствие солей — многие из них лучше растворяются при добавлении небольших количеств соли и выпадают в осадок при значительном увеличении ионной силы раствора.
Большинство аминокислот устойчиво в водных растворах и выдерживает кратковременное автоклавирование (до 2 часов) при температуре 100—200° без заметного разложения. Исключение составляют глютаминовая кислота и глютамин, которые при этих условиях претерпевают циклизацию. Устойчивость различных аминокислот к концентрированным растворам кислот и щелочей весьма различна и подробно уже обсуждалась при рассмотрении гидролиза белка (см. § 1).
Наиболее характерные свойства природных аминокислот представлены в табл. 3. Так как электрохимия аминокислот рассматривается ниже, то значения констант диссоциации карбоксильных и аминогрупп в таблице не приводятся (см. гл. VII).
Кроме названных 22 аминокислот, являющихся характерными компонентами белка, известны и некоторые другие, которые входят в состав небелковых веществ, являются продуктами обмена веществ и встречаются в свободном виде в различных биологических системах.
Таблица 2 Формулы природных аминокислот

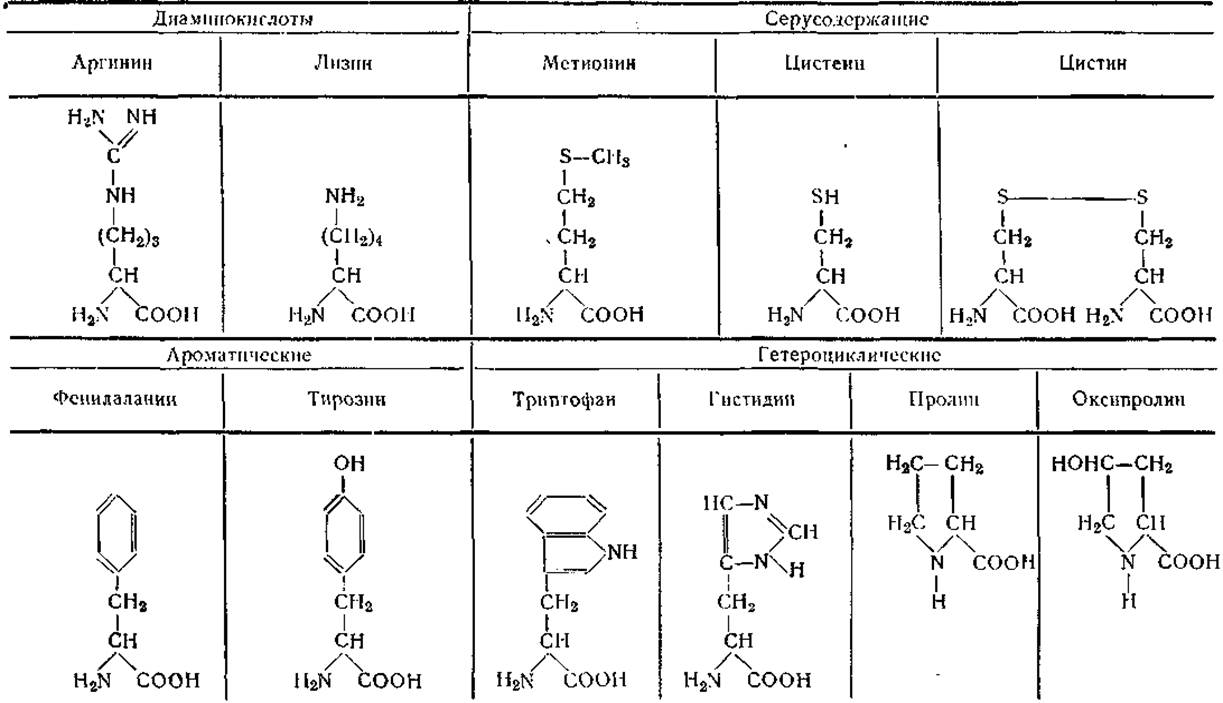
Таблица 3 Некоторые свойства аминокислот, входящих в состав белка
|
Аминокислота |
Молекулярный вес |
Точка разложения, °С |
Растворимость, % вес. |
[a]D в Н2О |
[a]D в НСl |
|
Аланин |
89,06 |
297 |
16,51 |
+ 1,8 |
+ 14,7 |
|
Аргинин |
174,14 |
238 |
оч. хор. |
+12,5 |
+27,6 |
|
Аспарагин |
— |
236 |
3,11 |
— |
+33,2 |
|
Аспарагиновая кислота |
133,06 |
270 |
0,50 |
+ 5,0 |
+25,4 |
|
Валин |
171,1 |
315 |
8,85 |
+ 5,6 |
+28,3 |
|
Гистидин |
155,09 |
277 |
4,29 |
—38,5 |
+ 11,8 |
|
Глицин |
75,05 |
290 |
24,99 |
— |
— |
|
Глютамин |
— |
185 |
3,6 |
+ 6,3 |
+31,8 |
|
Глютаминовая кислота |
147,08 |
249 |
0,843 |
+ 12,0 |
+31,8 |
|
Изолейцин |
131,11 |
284 |
4,117 |
+12,4 |
+39,5 |
|
Лейцин |
131,11 |
337 |
2,19 |
—11,0 |
+16,0 |
|
Лизин |
146,13 |
224 |
— |
+ 13,5 |
+26,0 |
|
Метионин |
149,15 |
283 |
3,35 |
— 10,0 |
+23,2 |
|
Оксипролин |
131,08 |
270 |
36,11 |
—76,0 |
—50,5 |
|
Пролин |
115,08 |
222 |
162,3 |
—86,2 |
—60,4 |
|
Серин |
105,06 |
228 |
5,023 |
—7,5 |
+15,1 |
|
Тирозин |
181,09 |
344 |
0,045 |
— |
— 10,0 |
|
Треонин |
119,08 |
253 |
20,5 |
—28,5 |
— 15,0 |
|
Триптофан |
204,11 |
282 |
1,14 |
—33,7 |
—2,8 |
|
Цистеин |
121,12 |
178 |
—16,5 |
—6,5 |
|
|
Цистин |
240,23 |
261 |
0,011 |
— |
— |
|
Фенилаланин |
165,09 |
284 |
2,965 |
—34,5 |
— 4,5 |
Известны также аминокислоты, встречающиеся лишь в отдельных белках. Так, в составе коллагена и желатины был обнаружен оксилизин, оксигруппа которого находится в δ-положении по отношению к карбоксильной группе (а, ε-диамино-δ-оксикапроновая кислота):
![]()
Эта аминокислота входит в состав фосфатидов некоторых бактерий и содержится в фосфорилированной форме в эмбриональных тканях теленка.
В белке щитовидной железы была обнаружена галоидсодержащая аминокислота 3,5-дийодтирозин и тироксин — гормон щитовидной железы:
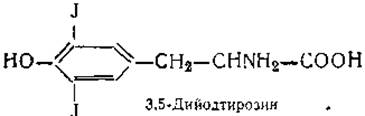

Сравнительно недавно в ткани этой же железы найдены еще две аминокислоты, близкие по строению к дийодтирозину и тироксину, — монойодтирозин и трийодтиронин. Являются ли они предшественниками или продуктами распада тироксина и дийодтирозика — пока неизвестно. Наконец, в фосфопротеинах обнаружены производные оксиаминокислот, получившие названия фосфосерина и фосфотреонина. Остаток фосфорной кислоты в них присоединяется эфирной связью к оксигруппе аминокислоты:
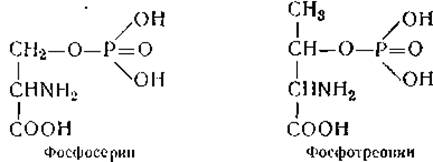
Из аминокислот, являющихся продуктами обмена, следует отметить у-аминомасляную кислоту, цитруллин и орнитин. у-аминомасляная кислота встречается в свободном виде в мозге животных, некоторых растениях и микроорганизмах и является продуктом декарбоксилирования глютаминовой кислоты:
![]()
По данным ряда исследователей, содержание у-аминомасляной кислоты и уровень активности ферментов ее обмена тесно связаны с функциональным состоянием центральной нервной системы. Две другие аминокислоты (диаминомонокарбоновые) — орнитин и цитруллин — обнаружены в тканях растений и животных. Обе они принимают участие в цикле образования мочевины и в своих превращениях тесно связаны с аргинином (орнитин + СО2 + NH3 → цитруллин + NН3 → аргинин → мочевивина + орнитин):
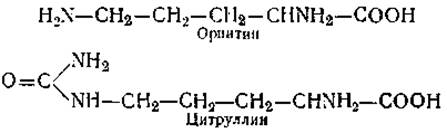
Примерами аминокислот, входящих в состав низкомолекулярных веществ небелковой природы, являются ß-аланин и ß-лейцин. Их отличие от аланина и лейцина состоит лишь в том, что аминогруппа находится не в а-, а в ß-положении. Первый входит в состав карнозина, ансерина, пантотеновой кислоты и коэнзима А. Второй является составной частью таких антибиотиков, как виомицин, стрептолин и стрептотрицин.
Естественно, что приведенные примеры дают лишь относительное представление о многообразии и функциях аминокислот, не входящих в состав белков. Однако детальное описание этих соединений не входит в задачи настоящей книги; весьма полно эти вопросы освещены в монографии А. Майстера «Биохимия аминокислот».