Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Химический состав белков
Химические реакции аминокислот
Реакции аминогруппы
Химические свойства аминокислот настолько многообразны, что они не могут быть достаточно полно изложены в настоящем руководстве. Это многообразие химических свойств обусловлено тем, что в составе аминокислот имеется несколько реакционноспособных групп (аминогруппы, карбоксильные и боковые группы). Благодаря этому аминокислоты не только обладают всеми общими свойствами первичных аминов и карбоновых кислот, но и дают целый ряд индивидуальных реакций. Вместе с тем одновременное сосуществование в молекуле аминокислоты карбоксильной и аминогруппы придает этим соединениям дополнительно ряд особых свойств. Поэтому в настоящем разделе будут рассмотрены только те химические реакции аминокислот, которые представляют интерес с биохимической точки зрения и которые окажутся полезными при изучении белка. Они могут быть подразделены на реакции аминогруппы, карбоксильной группы и реакции, протекающие с участием обеих групп. Свойства аминокислот, обусловленные радикалом R, рассматриваться не будут (некоторые из этих реакций приводятся в гл. III).
N-Алкилирование. Реакция алкилирования представляет собой замещение водорода в аминогруппе на соответствующий углеводородный радикал. Так, при взаимодействии аминокислот с метилгалоидами или диметилсульфатом происходит образование N-монометил- или N-диметилпроизводных этих кислот:
(CH3)2 SO4 + H2N—CHR—COOH →
→ (CH3)2N — CHR — COOH + H2SO4
Указанные реагенты обладают незначительной способностью к замещению водорода также в карбоксильной группе и радикале R. Эта реакция иногда используется для изучения влияния замещения водорода концевых аминогрупп белка на его биологическую активность.
Арилирование. В слабощелочной среде при температуре 35—37° свободные аминогруппы аминокислот реагируют с 2,4-динитро-1-фторбензолом с образованием соответствующих динитрофенильных производных (ДНФ-производных):
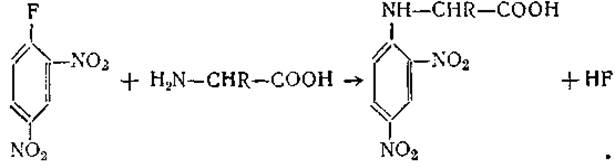
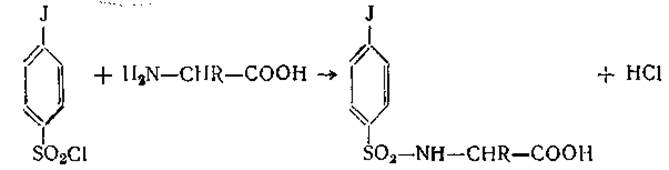
В общем случае к а-аминогруппе присоединяется только один радикал ДНФ; однако лизин, гистидин, цистеин и тирозин присоединяют второй радикал соответственно к ε-NН2-группе, имидазольной, гидроксильной и SH-группам. Все ДНФ-производные, кроме О-моно-ДНФ-тирозина и S-моно-ДНФ-цистеина, окрашены в желтый цвет; все они хорошо растворимы в эфире. В кислой среде связь между кольцом и аминокислотой оказывается более устойчивой, чем пептидная, и не расщепляется при гидролизе. Это свойство ДНФ-производных было положено в основу метода Сэнджера (определение концевых а-аминокислот в белках и полипептидах). Для этой же цели можно использовать и реакцию получения арилсульфопроизводных с помощью n-йодфенилсульфонилхлорида (пипсилхлорида):
Ацилирование. Под ацилированием аминокислот понимают широкий круг реакций, который включает введение в аминокислоты остатков органических кислот, арилсульфокислот, сложных эфиров различных кислот, а также реакции с изоцианатами, изотиоцианатами и другими соединениями. Простейшими примерами ацилирования аминокислот является их взаимодействие с муравьиной кислотой, уксусным ангидридом (реакция идет в ледяной уксусной кислоте) и газообразным кетеном при нагревании:
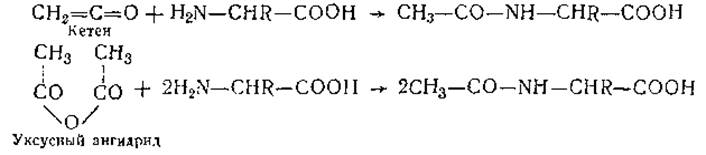
Введение остатка органической кислоты часто используется для оценки влияния ацетилирования концевых cc-аминогрупп и ε-аминогрупп лизина на функциональные свойства белка.
Взаимодействие аминогрупп кислот с арилсульфокислотами и сложными эфирами органических кислот широко применяется для аналитических и синтетических целей. В частности, как уже указывалось выше, для определения N-концевых аминокислот используют реакцию аминогруппы с производным йодфенилсульфокислоты — n-йодфенилсульфонилхлоридом. При синтезе пептидов для прикрытия свободной аминогруппы очень полезными оказались бензиловые эфиры хлоругольной кислоты (карбобензоксихлориды):
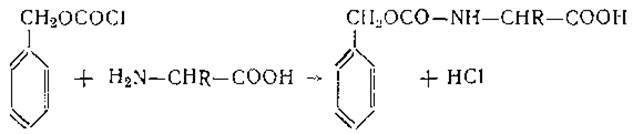
Однако наибольшее значение среди реакций ацилирования имеет взаимодействие с изоцианатами и изотиоцианатами. В общем виде реакция аминогрупп с арилизоцианатами может быть представлена следующим уравнением:
![]()
В результате образуются замещенные мочевины, именуемые арилкарбамиламинокислотами, которые при обработке безводной соляной кислотой циклизуются в соответствующие гидантоины:
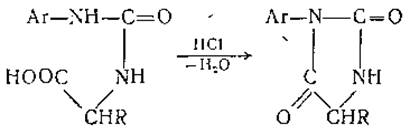
Аналогичным образом протекает и реакция аминогрупп аминокислот с арилизотиоцианатами. Эта реакция была использована Эдманом для определения концевых а-аминокислот в молекуле белка (см. гл. III); в качестве арилизотиоцианата использовался фенилизотиоцианат:

Реакция протекает в пиридин-водной среде при pH 8—9 и температуре 40°. Образующиеся фенилтиокарбамилпроизводные аминокислот подвергаются обработке безводной соляной кислотой, под действием которой они превращаются в фенилтиогидантоины. Фенилтиогидантоины различных аминокислот могут быть разделены хроматографически; при гидролизе щелочью они распадаются на фенилизотиоцианат и соответствующую аминокислоту, которая идентифицируется хроматографически.
Реакция Ван-Слайка. Аминокислоты, обладающие первичной аминогруппой, легко реагируют с азотистой кислотой с образованием соответствующей оксикислоты и газообразного азота:
![]()
Эта реакция является классическим приемом для оценки хода гидролиза белков посредством превращения высвобождающихся аминогрупп в газообразный азот, который может быть измерен с помощью одного из манометрических методов. Достоинством метода Ван-Слайка является то, что с азотистой кислотой быстро реагируют (реакция протекает в течение 5—10 мин) только a-аминогруппы аминокислот и N-концевые группы образующихся пептидов. Ни ε-амипогруппы лизина, ни аммиак, отщепляющийся от амидов аспарагиновой и глютаминовой кислот, в эту реакцию быстро не вступают.
Реакция с формальдегидом (формальное титрование). Эта реакция впервые была разработана Зёренсеном и часто используется для оценки степени гидролиза белка по количеству освобождающихся карбоксильных групп. Аминогруппы при этом блокируются формальдегидом, а карбоксильные оттитровываются щелочью. Реакция формальдегида с аминогруппой протекает в два этапа. Вначале гидратированный формальдегид дает N-монооксиметилпроизводное аминокислоты, которое затем реагирует со второй молекулой альдегида, превращаясь в диоксиметилпроизводное:

Формальдегид также способен образовывать метиленовые мостики между аминогруппой и какой-либо другой, содержащей лабильные атомы водорода (имидазольные, гуанидиновые, индольные, SH- и ОН-группы). Эта реакция широко применяется для получения токсоидов и других модифицированных белков (см. гл. III).