Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Пространственная организация белковой молекулы
Основные типы связей в белковой молекуле и уровни ее организации
Как уже отмечалось выше, белки представляют собой линейные сополимеры, которые построены из аминокислот, соединенных друг с другом пептидной связью. Построение пептидного скелета из повторяющихся основных структурных единиц придает белковой молекуле определенное сходство с синтетическими линейными полимерами. Однако сопоставление ряда физикохимических свойств белков и синтетических полимеров показывает, что это сходство является чисто внешним.
Прежде всего, повторяющимся структурным элементом в белках служит отдельная пептидная группа с одним углеродным атомом (а-углеродный атом) между соседними связями. Боковые группы аминокислот не принимают участия в образовании полипептидной цепи и лишь образуют ее радикалы. Напомним, что в нейлоне между соседними пептидными связями находятся шесть углеродных атомов. Вместе с тем молекулы белков имеют компактную структуру и содержат примерно в 3—4 раза меньшее количество связанной воды (20—30%), чем рыхлые клубки линейных полимеров. Благодаря этому макромолекула белков меньше по линейным размерам, и белки не дают таких вязких растворов, как обычные полимеры. Это указывает на то, что белки имеют несравненно более высокую степень организации, чем линейные полимеры. В настоящее время известны четыре уровня структуры, или организации, белковой молекулы; все они различны и определяются в основных чертах различными типами молекулярных взаимодействий, или типами связей, в последней.
К первому типу относятся ковалентные связи, возникающие при взаимодействии а-карбоксильных и а-аминогрупп аминокислот, которые носят название пептидных связей и располагаются вдоль полипептидной цепи. Таким образом, первым типом организации является полипептидная цепь. Этот уровень структуры и называют первичной структурой.
При исследовании кристаллической структуры различных, аминокислот и пептидов Полинг и Кори показали, что размеры пептидных групп примерно одинаковы и не зависят от того, какие именно аминокислоты образуют данную группу. Расстояние между атомами углерода и кислорода оказалось равным 1,24 Å, хотя сумма длин ковалентных двойных связей должна равняться только 1,21 Å. Аналогичным образом и длина связи между углеродом и азотом в амидной группе равна 1,32 Å, что также меньше суммы длин одиночных связей (1,47 Å). Это доказывает, что С—N-связь на 40%, а связь в карбонильной группе на 60% имеют характер двойных связей в результате резонанса между связями (миграция электронов от азота к кислороду через атом, углерода).

Поскольку связь С—N частично носит характер двойной связи, то можно допустить, что амидная группа имеет плоскую конфигурацию. Это допущение было подтверждено рядом экспериментальных данных. Во всех изученных пептидных структурах пептидная группа оказалась плоской (с точностью до нескольких градусов), и при отклонении от компланарности на 10—20° энергия смещения равнялась соответственно 1—3,5 ккал/моль. Эти отклонения могут сказываться на величине энергии пептидной связи, которая обычно равняется 2,5—3,5 ккал/моль, но может колебаться от 1,1 до 4,1 ккал/моль.
Третья особенность амидной группы заключается в том, что она имеет транс-конфигурацию. Это означает, что а-углеродные атомы присоединены к плоской амидной группе по обеим сторонам связи С—N.
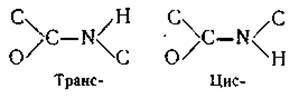
Этот результат анализа кристаллической структуры подтверждается данными, полученными при измерении дипольных, моментов простых пептидов. Оказалось, что транс-конфигурация амидной группы более стабильна, чем ее цис-конфигурация. Изучение инфракрасных спектров поглощения амидов и N-замещенных амидов также показало большую устойчивость транс-конфигурации пептидов (разница энергии этих конфигураций превышает 2 ккал/моль). Все эти особенности амидной группы представлены на рис. 16.
Наконец, последняя характерная особенность амидной группы обусловлена наличием атома водорода, соединенного с атомом азота, что обеспечивает возможность образования водородной связи. При этом каждая из пептидных групп может образовать две водородные связи с другими группами. Образование этого типа связи можно объяснить электростатическими и ковалентными взаимодействиями.
Известно, что атом водорода, присоединенный к электроотрицательному атому какой-либо молекулы, может обусловить взаимодействие с электроотрицательным атомом либо другой, либо той же молекулы. Это взаимодействие и называют водородной связью. Такими электроотрицательными атомами являются атомы F, О и N Присоединенный к ним водород лишается своей электронной оболочки, т. е является протоном. Таким образом, если рядом присутствует вторая молекула, содержащая электроотрицательный атом, гопротон будет притягиваться к нему. В результате произойдет связывание этих двух групп, в котором силы притяжения должны быть сбалансированы силами отталкивания, обусловленными взаимопроникновением их электронных облаков. Очевидно, что сила связи будет тем больше, чем больше положительный заряд водородного атома и отрицательный заряд акцептора. Именно поэтому наиболее сильные водородные связи образуются наиболее электроотрицательным атомом — фтором (F>О>N).

Pис. 16. Участок полипептидной цепи и основные ее параметры, вычисленные из данных рентгеноструктурного анализа аминокислот и простых пептидов (по Полингу, 1955).
Существенную роль в образовании водородной связи играет и ковалентний фактор. Атомы F, О и N имеют в ковалентных соединениях соответственно 3, 2 и 1 свободные электронные пары Поэтому при разделении протона между соседними электроотрицательными атомами происходит дополнение его электронной конфигурации одной из этих пар.
Следовательно, водородная связь возникает благодаря тому, что ядро атома водорода, находящееся в полярной группе, временно разделяется между двумя электроотрицательными атомами, причем его электронная конфигурация дополняется свободной парой электронов одного из них. Расчеты энергии образования водородной связи показали, что в белках Н-связи обусловлены главным образом действием электростатических сил, тогда как на долю ковалентного фактора приходится не более 10%.
Водородные связи в белках обладают рядом особенностей. Прежде всего, атом водорода расположен ближе к азоту, чем к кислороду. Энергия связи невелика и равна 1,4 ккал/моль, а ее длина — порядка 2,8 Å. Благодаря ее полярности все атомы этой связи должны лежать на одной прямой (т. е. быть коллинеарными), хотя и допустимо некоторое отклонение. Оценивая убыль энергии водородной связи, когда группы СО и NH находятся под углом друг к другу, Полинг заключил, что отклонение от коллинеарности не может превышать 20°.
Водородные связи могут возникать как между отдельными полипептидными цепями, так и между звеньями одной цепи. Поскольку энергия Н-связи равна 1,4 ккал/моль, то чем больше таких связей образуется внутри молекулы, тем ниже будет ее энергия и тем выше ее стабильность. Это приводит к тому, что полипептидные цепи стремятся образовывать упорядоченные жесткие спирали с максимально возможным числом водородных связей. Такая упорядоченная спиральная структура полипептидной цепи, обусловленная внутримолекулярными водородными связями, называется вторичной структурой белков. Часто ее еще называют внутримолекулярной кристаллизацией, ибо такая молекула действительно напоминает кристалл (наличие точки плавления для вторичной структуры, большая жесткость и упорядоченность). Однако упорядоченная спираль с внутримолекулярными водородными связями не является единственной конфигурацией полипептидных цепей белков. Наряду с ней известна структура, в которой вытянутые полипептидные цепи связаны друг с другом межмолекулярными (межцепочечными) водородными связями.*
Доказательства существования водородных связей в белках могут быть получены при изучении скорости изотопного обмена имидного водорода с водой, содержащей дейтерий или тритий. Этот прием был использован в лабораториях Линдерштрём-Ланга и Бреслера. Известно, что в низкомолекулярных пептидах этот атом водорода обменивается с водой крайне быстро. В высокомолекулярных полипептидах с большим числом водородных связей обмен имидного водорода сильно замедлен. Например, у полиаланина с 28 пептидными связями только 5—6 имидных водородов обмениваются быстро. Это говорит о том, что почти все пептидные группы соединены водородными связями, а сама цепь свернута в упорядоченную спираль. У инсулина из 49 имидных водородов 30 обмениваются медленно, т. е. степень спирализации составляет примерно 60%. Другим подтверждением существования водородных связей в белках является их деструкция и денатурация под влиянием агентов, обладающих значительной способностью к образованию водородных связей с амидной группой (концентрированные растворы мочевины, гуанидина, трифторуксусная и муравьиная кислоты и др.).
* См. подробнее в § 2
Наряду с водородными связями существенною роль в организации белковой молекулы играют и другие связи. К ним прежде всего относятся дисульфидные связи, которые образуются при окислении двух остатков цистеина:
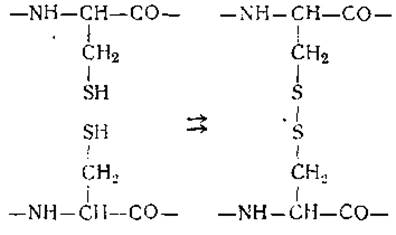
Дисульфидные связи —S—S— могут как соединять воедино несколько обособленных полипептидных цепей, так и скреплять отдельные точки одной цепи, что приводит к образованию в ней петель. И тот, и другой тип связи содержится в молекуле инсулина, где два дисульфидных мостика объединяют цепи А и В, а один обусловливает образование петли, содержащей 6 аминокислотных остатков, в цепи А (рис. 17).
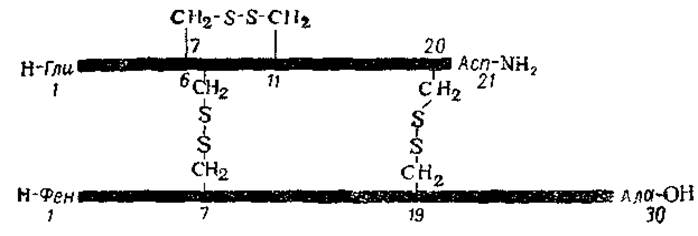
Рас. 17. Схематическое изображение структуры инсулина с межпептидными и внутрипептидными дисульфидными связями (по Онкли, 1961).
Цифры обозначают номера аминокислотных остатков.
В местах локализации дисульфидных мостиков создаются напряжения, ослабляющие водородные связи и нарушающие спиральную структуру. Это подтверждается опытами по определению скорости дейтерации белков. Так, у того же инсулина из 30 медленно обменивающихся при 0° атомов водорода 7 начинают обмениваться быстро при 20°. Очевидно, что к их числу относятся водородные атомы тех пептидных групп, которые близко расположены к дисульфидным мостикам и потому слабо связаны водородными связями. Таким образом, наличие дисульфидных связей приводит к тому, что наряду со спиральными участками в полипептидных цепях имеются аморфные участки, придающие им определенную гибкость. Вместе с тем эти же мостики связивают отдельные полипептидные цепи в единую макромолекулу белка.
К другому типу вторичных связей, образующих петли внутрь пептидных цепей или соединяющих отдельные цепи, относятся связи, возникающие благодаря взаимодействию больших неполярных групп. Последние представлены углеводородными радикалами таких аминокислот, как лейцин, изолейцин, фенилаланин и триптофан, максимальная длина и объем которых могут достигать 8,1 Å и 175,5 Å3 соответственно. Подобно тому, как в воде молекулы углеводородов стремятся собраться в шарик, чтобы уменьшить поверхностную энергию, так и эти неполярные радикалы белка стремятся слиться в симметричную каплю.
Причину такого поведения понять нетрудно. Вода имеет высокую степень внутреннего водородного связывания, что приводит к образованию частично упорядоченной решетки. Так как углеводороды не являются эффективными образователями водородных связей, то существование их цепей в прямом контакте с водой могло бы привести к уменьшению числа водородных связей, что было бы энергетически невыгодно. Наоборот, ионные группы могут легко взаимодействовать с водой, причем энергия их взаимодействия с полярными молекулами Н2О вполне достаточна, чтобы компенсировать любое блокирование образования Н-связей. Образование капель ведет к тому, что происходит частичное прикрытие углеводородных радикалов от контакта с растворителем и замена его на контакт углеводород—углеводород.
Взаимодействие нескольких неполярных групп, сопровождающееся освобождением воды и образованием в ней новых водородных мостиков, достаточно для создания устойчивой поперечной связи. Это обусловлено тем, что при ассоциации углеводородных цепей в водной среде освобождается энергия, приблизительно равная 1,2 ккал на 1 моль групп СН2. Следовательно, при определенных условиях взаимодействие неполярных радикалов может оказаться эквивалентным образованию водородной связи как внутри белковой молекулы, так и между определенными молекулами. При этом определенные положения больших неполярных остатков в пептидных цепях могут обеспечить устойчивость структур, несовместимых с конфигурацией спирали. Правда, притяжению подобных остатков препятствует ряд факторов: сближение групп, несущих одноименный заряд, отрыв диполей воды от заряженных групп, разрыв водородных связей и нарушение спиральной структуры, т. е. все те процессы, которые требуют затраты энергии.
Таким образом, взаимодействие углеводородных радикалов, так же как и образование дисульфидных мостиков, противодействует стремлению полипептидной цепи образовывать жесткие спирали с возможно большим числом водородных связей и приводит к существованию аморфных участков макромолекулы. В этих участках полипептидные цепи обладают достаточной гибкостью и способны ломаться или изгибаться. Благодаря этому взаимодействие боковых радикалов и возникновение S—S-связей приводит к свертыванию цепей и укладке их спиральных и аморфных участков в компактное тело — глобулу. Вот эта пространственная упаковка чередующихся спиральных и аморфных участков первичной цепи в симметричную глобулу и составляет третичную структуру белковой молекулы. Следовательно, вторичные связи принимают непосредственное участие в создании и стабилизации, третичной структуры белка.
Помимо ассоциаций боковых неполярных радикалов и дисульфидных мостиков в создании третичной структуры могут принимать участие и другие ковалентные связи — например, фосфоэфирная. Показано, что в пепсине и а-казеине встречаются ортофосфатные связи, соединяющие, вероятно, остатки серина и треонина; доказано также наличие фосфоамидной поперечной связи (О—РО2—NH—) в а-казеине, которая присоединена, по-видимому, к остаткам лизина и аргинина. Возможно, что подобного рода связи имеют место и в фосфопротсинах. Однако для других белков они не имеют существенного значения.
Притяжение или, отталкивание полипептидных цепей может быть обусловлено и электростатическими силами, действующими между положительно и отрицательно заряженными группами молекулы белка (кулоновское взаимодействие). Величина таких сил зависит от ионной силы раствора. Однако для растворов глобулярных белков не обнаружено существенной зависимости электростатических сил от ионной силы, если эффективный заряд белка не слишком велик. Это говорит о том, что электростатические силы, вероятно, не играют важной роли в формировании глобулярной структуры. Для некоторых удлиненных белковых молекул эти силы, возможно, и имеют влияние па форму молекулы, поскольку они способны обеспечить взаимодействие па относительно больших расстояниях.
Наконец, какую-то определенную роль в пространственной конфигурации макромолекулы могут играть связи диполь -диполь и так называемые дисперсионные силы. Однако их значение почти не изучено, и потому здесь они подробно рассматриваться не будут.
Сопоставление вторичных связей, принимающих участие в создании и сохранении третичной структуры белковой молекулы, показывает, что главную роль здесь играет не пептидный скелет, а боковые цепи аминокислот. Так как разные белки содержат в различных участках полипептидных цепей различные боковые цепи, то их взаимодействие приводит к своеобразной и строго определенной для каждого белка пространственной упаковке самих цепей. Какое-либо единообразие здесь невозможно, и потому белки сильно отличаются друг от друга именно по своей третичной структуре.
В настоящее время белки по особенностям третичной структуры принято подразделять на фибриллярные и глобулярные.
К первым относятся нерастворимые белки, выполняющие защитные функции и отличающиеся волокнистым ориентированным строением. Молекулы этих белков построены из длинных полипептидных цепей и обладают вытянутой палочкообразной третичной структурой (фиброин шелка, кератины волос, ногтей и перьев). Во вторую группу входят растворимые белки животных клеток, крови, лимфы и спинномозговой жидкости (альбумины и глобулины). Макромолекулы этих белков имеют компактную третичную структуру, приближающуюся к шару или эллипсоиду вращения. Однако такое различие весьма относительно, и между этими двумя классами существует много растворимых белков, третичная структура которых имеет смешанный характер. К их числу относятся, например, проколлаген, фибриноген и миозин. Хотя молекулы этих белков и отличаются вытянутой палочкообразной формой, их полипептидные цепи не растянуты, а свернуты в топологически сложную третичную структуру.
Итак, организация белковой молекулы происходит в результате различного рода молекулярных взаимодействий, которые и определяют уровни ее структуры. Первичная структура макромолекулы белка целиком определяется ковалентными связями вдоль полипептидной цепи, вторичная — водородными связями между пептидными группами, расположенными в соседних витках спирали или соседних участках разных цепей, и, наконец, третичная структура — химическими «сшивками» отдельных участков одной цепи или нескольких цепей (дисульфидные мостики, фосфоэфирная связь) и силами взаимодействия неполярных боковых радикалов некоторых аминокислот.
В заключение необходимо остановиться еще на четвертичной структуре белков. Этот уровень организации возникает благодаря ассоциации нескольких (двух или более) макромолекул (так называемых субъединиц) в единую комплексную глобулу. Примером подобной ассоциации служит молекула гемоглобина, состоящая из четырех пептидных цепей и легко разделяющаяся на две субъединицы, содержащие по две полипептидные цепи.
В создании четвертичной структуры принимают участие силы взаимодействия между отдельными группами, расположенными на поверхности белковых глобул. Такими силами могут быть водородные связи, электростатическое взаимодействие разноименно заряженных групп, ван-дер-ваальсово взаимодействие боковых радикалов аминокислот. Часто ассоциация субъединиц в сложные комплексы является основой биологической активности последних. Например, для проявления активности щелочной фосфатазы необходимо предварительное объединение двух ее субъединиц. Иногда мы имеем и обратную картину, когда ферментативная активность обнаруживается только после разъединения составляющих белковой молекулы (дегидрогеназа фосфоглицероальдегида). Однако необходимо сразу же подчеркнуть, что функциональная активность того или иного белка определяется не одной только четвертичной структурой, а всеми четырьмя уровнями его организации. Все эти уровни структуры взаимно влияют друг на друга, причем более низкий порядок организации определяет более высокий. Так, порядок чередования отдельных аминокислот в пептидной цепи определяет ее вторичную структуру и, соответственно, третичную структуру белковой молекулы. Исследование этих взаимодействий между выше- и нижестоящими порядками организации удобнее вести не на естественных полипептидах, состоящих из разнообразных аминокислотных остатков, а на их синтетических моделях. Именно в результате изучения полипептидов, синтезированных из одной определенной аминокислоты, была выяснена вторичная структура белка.