Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Пространственная организация белковой молекулы
Вторичная структура полипептидов
Одной из особенностей молекул синтетических полипептидов является наличие строгой пространственной конфигурации, главную роль в создании и сохранении которой играют водородные связи.
Именно благодаря образованию большого числа водородных связей происходит уменьшение потенциальной энергии макромолекулы и увеличение ее стабильности. Поэтому поиски истинной структуры полипептидов и были сосредоточены вокруг проблемы нахождения конфигурации с минимальной потенциальной энергией, т. е. такой модели, которая бы обеспечивала максимально возможное образование водородных связей при минимальном искажении валентных углов и связей.
а-Спираль. Из ряда гипотез строения полипептидных цепей только некоторые имеют более чем исторический интерес. Среди последних всеобщее признание получила теория а-спирали Полинга и Кори, для которой имеются прямые экспериментальные доказательства. Эта структура была разработана авторами на основании общих стереохимических соображений и рентгеноструктурных данных о длинах ковалентных и водородных связей и значеннях валентных углов. Ранее эти данные уже приводились, и здесь они будут повторены в более сжатом виде. Итак, модель пространственной конфигурации полипептидной цепи должна удовлетворять следующим основным принципам.
1. Вся четверка атомов амидной группы находится в одной плоскости (компланарна). Это является следствием частично двойного характера пептидной связи. Всякие существенные отклонения от компланарности энергетически неблагоприятны.
2. Каждый аминокислотный остаток расположен по отношению к соседям и к спирали в целом абсолютно идентично всем остальным (принцип эквивалентности всех аминокислотных остатков).
3. Образуется максимально возможное число водородных связей между пептидными группами (по две на каждую) при сохранении наибольшей возможной компактности спирали. Длина водородной связи (расстояние между атомами N и О) составляет 2.8 Å, группы С = О и N—Н коллинеарны, и допустимое отклонение от коллинеарности не превышает 20°.
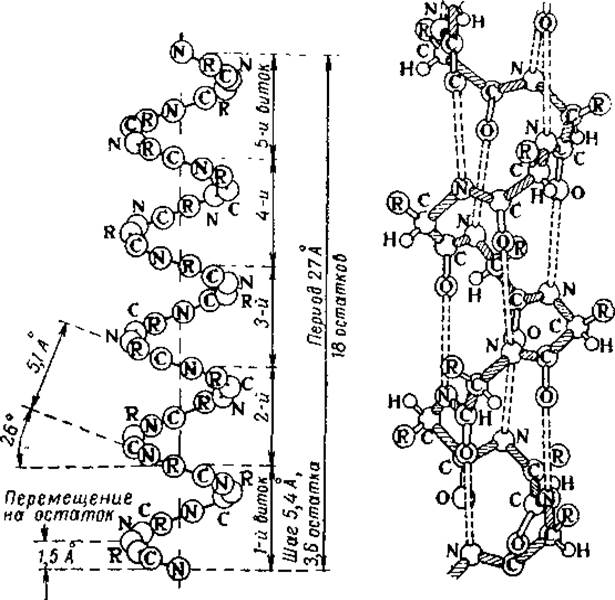
Рис. 18. Схема и модель а-спирали полипептидов (по Полингу, 1955).
Только одна структура удовлетворяет этим требованиям — а-спираль (рис. 18). Все другие модели не допускают максимального образования Н-связей или не отвечают принципу эквивалентности всех аминокислотных остатков. При рассмотрении рис. 18 легко заметить некоторые особенности а-спирали. Так, первой представляющей наибольшее отклонение от известных спиральных систем, является ее неинтегральный характер. На один виток спирали приходится 3,6 аминокислотных остатка, т. е. период идентичности вдоль оси а-спирали составит 5 витков, или 18 остатков. Поэтому другое название для нее — спираль-3,6 остатка. При высоте одного витка 5,4 Å трансляция, т. е. перемещение по оси на один аминокислотный остаток, составляет 1,5 Å. При этом, смещаясь по оси на 1,5 Å, каждый остаток поворачивается вокруг нес на 100°. Внутренний диаметр спирали, т. о. диаметр цилиндра, на поверхности которого расположились все а-углеродные атомы, равен 10,1 Å.
Вторая особенность а-спирали связана с образованием максимально возможного числа водородных связей — по две на каждую пептидную группу. Водородные связи приблизительно параллельны оси спирали, причем каждый пептидный азот связан водородом с карбонильным кислородом третьего ближайшего остатка. Следовательно, каждая водородная связь перекрывает три аминокислотных остатка и удерживает их в упорядоченной конфигурации независимо от двух других Н-связей. Для того, чтобы могло осуществиться нарушение жесткой структуры а-спирали на каком-то ограниченном участке, должны быть разорваны по меньшей мере три последовательные водородные связи. Это обстоятельство имеет решающее значение в придании а-спирали большой стабильности, равно как и резкости перехода спираль — клубок.
Наконец, третья особенность этой конформации состоит в том, что боковые радикалы аминокислот обращены наружу. Не принимая непосредственного участия в построении углеродного скелета а-спирали, эти радикалы могут способствовать созданию напряжений, несовместимых со спиральной конфигурацией, и разрыву водородных связей, т. е. образованию аморфных участков. Поэтому структура а-спирали позволяет получить максимальную изменяемость белковой структуры и, следовательно, обеспечить исключительное разнообразие химической специфичности белков. Расположение боковых радикалов аминокислот весьма существенно и с другой точки зрения. Если мы представим себе а-спираль, построенную из природных L-аминокислот (рис. 19), то при направлении вращения слева направо (правая спираль) все боковые цепи будут располагаться вдоль оси от С-конца к N-koнцу, т. е. в направлении, обратном направлению полипептидной) цепи. Если же спираль левая, то боковые радикалы будут направлены вдоль оси по направлению полипептидной цепи. Так как на каждый виток спирали приходится 3,6 таких радикалов, то их упаковка и взаимодействие для каждого типа спирали будут совершенно различны. При этом необходимо учесть, что именно это взаимодействие и определяет выбор направления вращения спирали. К сожалению, теория Полинга и Крика не может ничего сказать о том, каково должно быть это направление, поскольку для построения модели оно совершенно безразлично. Для большинства исследованных полипептидов оказалось, что природные аминокислоты образуют правые спирали; они же были обнаружены и в ряде белков.
Доказательства существования а-спирали были получены Бамфордом с сотр. при изучении дифракционных рентгенограмм, снятых с пленок синтетических полипептидов и некоторых белков. На этих рентгенограммах имелись рефлексы, отвечающие периодам 1,5, 5,1 и 9,8 Å, что равно расстоянию по оси спирали между последовательными остатками, шагу и диаметру спирали соответственно.
β-Структура. а-Спираль с внутримолекулярными водородными связями является наиболее стабильной конфигурацией полипептидной цепи, представленной в большинстве исследованных белков. Однако она не является их единственной конфигурацией.

Рис. 19. Расположение боковых групп в левой и правой спиралях (Steiner, 1965).
Другим вариантом вторичной структуры, отвечающим всем вышеизложенным принципам, является структура с межмолекулярными водородными связями, соединяющими соседние полипептидные цепочки (β-структура). Полипептидные цепи в этой структуре должны быть вытянуты, а их пептидные группы должны лежать примерно в одной плоскости (рис. 20). Карбоксильные (амино-) группы каждого второго остатка направлены в одну сторону, а переход к соседнему остатку осуществляется перемещением вдоль оси цепи на 3,6 Å и поворотом вокруг нее на 180°. Примерно такую конфигурацию имеет обычная вытянутая форма полиглицина. Период идентичности цепи равен 7,2 Å, цепи уложены параллельно друг другу и имеют зигзагообразную форму. Боковые радикалы соседних аминокислотных остатков выступают из полипептидного скелета в противоположных направлениях и располагаются перпендикулярно плоскости чертежа.
Наиболее интересной особенностью этой конфигурации следует считать ориентацию С = О- и N—Н-групп, которые лежат в одной плоскости и так ориентированы, что могут образовывать водородные связи с соответствующими группами соседних цепей. При этом чередующиеся амино- и карбоксильные группы данной цепи соединяются с двух сторон Н-связями с карбоксильными и аминогруппами двух других цепей, расположенных по обе стороны от данной. Такие цепи носят название антипараллельных, а структуры, построенные из них, — складчато-слоистых.
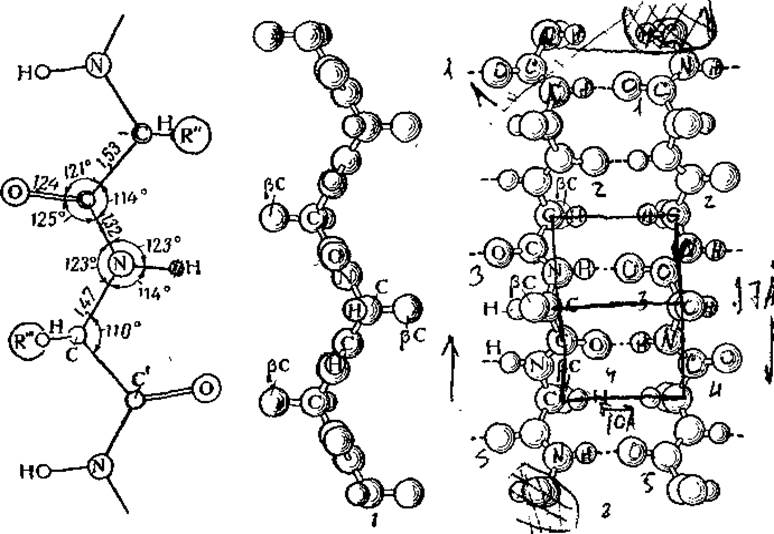
Рис. 20. Схема и модель ß-структуры полипептидов:
1 — модель цепи (вид на цепь в направлении водородных связей, карбоксильные и аминогруппы расположены перпендикулярно плоскости чертежа), 2 — модель складчато-слоистой структуры (ß-угдеродные радикалы расположены перпендикулярно плоскости чертежа).
Складчато-слоистая структура с антипараллельными цепями характерна для таких фибриллярных белков, как фиброин шелка. На рентгенограммах этого белка четко обнаруживаются рефлексы, отвечающие периодам 6,97 и 9,4 Å, что соответствует периоду идентичности вдоль полипептидной цепи и расстоянию между чередующимися эквивалентными цепями (9,5 Å, согласно молекулярной модели).
Отличительной чертой ß-структуры является расположение соседних ß-углеродных атомов по разным сторонам слоя, перпендикулярно его плоскости (попеременно выше и ниже слоя). Так как все ß-углеродные атомы с каждой стороны слоя находятся в «фазе» друг с другом, т. е. в эквивалентных точках относительно оси волокна, то между соседними рядами ß-углеродных атомов возникают большие впадины. Благодаря этому становится возможной плотная упаковка соседних слоев, когда ß-углеродные атомы (боковые радикалы) одного слоя помещаются в промежутках между ß-углеродньми атомами другого. Правда, эти боковые радикалы не могут быть слишком велики (у фиброина это радикалы СН3 аланина и СН2ОН серина), поскольку иначе нарушается упорядоченность упрощенной модели.
В заключение необходимо отметить, что конфигурация синтетических полипептидов во многом определяется природой растворителя, из которого отливается пленка полипептида. Если растворителем является муравьиная или дихлоруксусная кислота, то получается ß-структура с межмолекулярными водородными связями; если используется крезол или диметилформамид — то структура с внутримолекулярными связями, т. е. а-спираль. Из некоторых растворителей можно получить пленки полипептидов беспорядочной аморфной конфигурации.