Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Пространственная организация белковой молекулы
Третичная структура белков. Рентгеноструктурный анализ белков
Из имеющейся информации о природных белках очевидно, что структурными формами (а- и ß-структурами), описанными в предыдущих разделах, нельзя охарактеризовать все аспекты их молекулярной организации. Спиральные участки для большинства белков являются лишь частью их макромолекулы и з большинстве случаев могут объяснить только малую долю ее конформации. Вместе с тем макромолекулы белка имеют ясно выраженную пространственную конфигурацию, которая не менее строго определена, чем конфигурация высоко спиральных систем. Этот уровень организации белковой молекулы, включающий в себя вторичную структуру полипептидных цепей, как мы уже упоминали, в настоящее время принято называть третичной структурой. Для пояснения напомним, что молекулы глобулярных белков представляют собой «сверхклубки», состоящие из спиральных и аморфных сегментов. Последние наделяют полипептидные цепи достаточной гибкостью и позволяют им свернуться в компактную глобулу, которая стабилизируется различного рода связями. Вот эта пространственная упаковка чередующихся спиральных и аморфных участков первичной цепи в компактное и симметричное тело и составляет третичную структуру макромолекулы белка.
Связи, стабилизирующие третичную структуру белковой молекулы, носят самый различный характер. К ним относятся дисульфидные сшивки, ван-дер-ваальсовы взаимодействия неполярных радикалов аминокислот, электростатическое взаимодействие полярных группировок, водородные связи и некоторые другие. Уже само перечисление этих связей и взаимодействий показывает, что главную роль в стабилизации этого уровня организации макромолекулы играет не пептидный скелет, а боковые цепи аминокислот. Все эти типы вторичных связей были рассмотрены в предыдущих разделах, здесь же мы остановимся только на водородных связях. В отличие от водородных связей, возникающих за счет имидного водорода и карбонильного кислорода и стабилизирующих а-спираль, в сохранении третичной структуры принимают участие те Н-связи, которые образуются боковыми тирозиновыми ядрами и свободными карбоксильными группами глютаминовой и аспарагиновой кислот. Гидроксильная группа тирозина выступает как донор, а карбоксильный кислород как акцептор при образовании этой связи:
![]()
То, что водородная связь образуется именно с карбоксильным ионом, а не с незаряженным карбоксилом, было доказано спектроскопически. При переходе от pH 1,5, когда СООН-группа не заряжена, к pH 5 происходит заметное смещение (на 6 ммк) полосы поглощения белка при 280 ммк, которое объясняется образованием водородной связи. Две такие связи были обнаружены в молекуле инсулина и три — в молекуле рибонуклеази. Подобного рода связи играют важную роль в сохранении третичной структуры некоторых белков. Так, при обработке рибонуклеазы ß-меркаптоэтанолом в 8 М мочевине (агент, разрушающий водородные связи) происходили разрыв S—S-мостиков и полная инактивация фермента. Однако после удаления этих агентов и окисления сульфгидрильных групп кислородом воздуха наблюдалось полное восстановление активности и числа S—S-связей. Очевидно, что образование этих связей происходило в тех же местах, что и в нативном белке. Если же и окисление SH-группы проводилось в 8 М мочевине, то активность фермента не восстанавливалась, хотя и наблюдалось полное восстановление числа дисульфидных связей. Вероятно, восстановление этих связей проходило в полном беспорядке, хаотично, и белок остался денатурированным.
Эти опыты, проведенные Анфинсеном, показывают, что третичная структура белков может образоваться и закрепиться и без дисульфидных мостиков вследствие взаимодействия боковых радикалов, образования водородных связей описываемого типа и электростатического взаимодействия полярных группировок. Что же касается дисульфидных связей, то они в данном случае лишь закрепляют третичную структуру. Вместе с тем эти данные говорят о том, что первичная структура белка определяет не только вторичную, но и третичную структуры. - Определенное расположение неполярных радикалов и остатков тирозина и дикарбоновых кислот в полипептидной цепи обусловливает специфическую топологическую укладку цепи и образование водородных связей в определенных ее участках, благодаря чему становится возможным возникновение дисульфидных связей в том порядке, который характерен для данного белка.
Рядом авторов допускается возникновение водородных связей не только между гидроксильными группами тирозина и карбоксильными группами дикарбоновых аминокислот, но и между аминогруппой гистидина и карбоксильной группой тех же кислот. Наконец, какую-то роль в стабилизации третичной структуры играют, вероятно, и взаимодействия диполь — диполь, как, например, между ОН-группами двух сериновых остатков. Схематически все эти типы взаимодействия представлены на рис. 25.
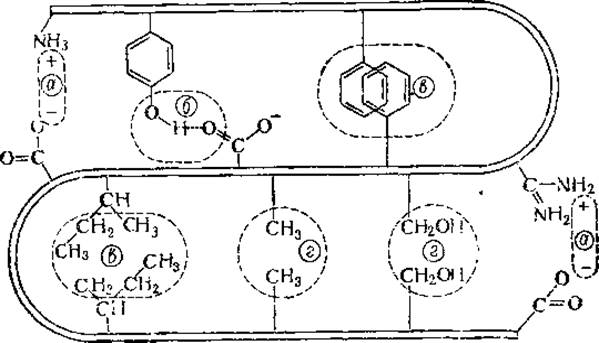
Рис. 25. Некоторые возможные типы взаимодействия боковых цепей в глобулярных белках (Steiner, 1%5):
а — электростатическое, б — водородная связь, в — взаимодействие неполярных радикалов, г — взаимодействие диполь — диполь.
Поскольку в образовании и стабилизации третичной структуры главная роль принадлежит боковым радикалам, ю какая-либо генерализация здесь становится невозможной, и каждый белок необходимо рассматривать как частный случай.
Для полуколичественной характеристики третичной структуры и ее изменений могут быть использованы гидродинамические константы белка — характеристическая вязкость [η], константа седиментации S и константа диффузии D, — двойное лучепреломление и некоторые другие показатели. Однако точное знание третичной структуры может быть достигнуто только с помощью рентгеноструктурного анализа. Этот метод широко использовался для изучения расположения атомов в кристаллах простых неорганических и органических соединений и может быть применен только к кристаллическому материалу или материалу, обладающему определенной регулярностью в структуре. Конечной целью анализа дифракции рентгеновых лучей является определение координат всех атомов. Знание этих координат позволяет построить трехмерную, пространственную модель молекулы, в которой в определенном порядке расположены все составляющие ее атомы. Детальное обсуждение принципов рентгеноструктурного анализа не входит в задачу настоящей книги, и потому здесь будут рассмотрены лишь элементарные теоретические предпосылки.
Х-лучи, открытые в 1895 г. Рентгеном, представляют собой коротковолновые электромагнитные излучения, возникающие при бомбардировке металлической мишени пучком электронов. Такая бомбардировка осуществляется в специальном приборе, получившем название «рентгеновская трубка». В то время как длины волн рентгеновых лучей занимают область от 0,01 до 20 Å, для кристаллографических работ используются лучи, длина волн которых соизмерима с межатомными расстояниями в кристалле и составляет примерно 1,5 Å. Как и обычные световые лучи, Х-лучи обладают свойствами отражения, преломления, рассеивания, дифракции, интерференции и др.
Как уже говорилось, метод пригоден для изучения систем, обладающих определенной регулярностью в своей пространственной геометрии. Системы, которые имеют полностью упорядоченную трехмерную организацию, называются кристаллами. Любой кристалл образуется многократным повторением небольшой трехмерной единицы, которая называется элементарной ячейкой и состоит из одной или небольшого целого числа молекул. Так, например, элементарная ячейка миоглобина состоит из двух молекул. Поскольку параллельное повторение элементарной ячейки воспроизводит всю кристаллическую структуру, то для характеристики последней достаточно описать эту повторяющуюся единицу. Задача рентгеноструктурного анализа и состоит в определении геометрии и размера элементарной ячейки и взаимоположения атомов, образующих ее. Вторая часть задачи — определение координат атомов, а значит, и структуры молекул, оказывается несравненно сложнее.
При изучении принципов рентгеноструктурного анализа допустимо рассматривать кристалл как построенный из серии параллельных плоскостей, в которых лежат те или иные атомы молекулы. Каждый атом является частью пространственной решетки, а вся совокупность атомов данного слоя образует плоскую сетку кристаллической решетки. Очевидно, что число таких плоских сеток (параллельных плоскостей) может быть очень большим и что для каждой системы плоскостей имеется характеристическое разделение, т. е. расстояние между параллельными плоскостями (рис. 26). Следовательно, кристалл можно рассматривать как трехмерную дифракционную решетку для рентгеновых лучен. При отражении от ряда плоскостей кристалла происходит не только изменение направления рентгеновых лучей (дифракция), но и наложение отдельных волновых колебаний друг на друга (интерференция). Эта способность Х-лучей к дифракции и интерференции при отражении от плоских сеток кристаллической решетки и лежит в основе рентгеноструктурного анализа кристаллических веществ.
Рассмотрим отражение рентгеновых лучей от одной из систем плоскостей кристалла с характеристическим расстоянием λ (рис. 27). Пусть на нес падает под определенным углом θ пучок параллельных лучей одинаковой длины волны В результате отражения от параллельных плоскостей эти лучи сольются в точке С и дадут общий отраженный луч L. При этом луч L2 должен пройти до точки С больший путь, ибо он отстает от луча L1 па расстояние АС — ВС. Если на участке «отставания» укладывается целое число длин волн (АС—ВС = n ∙ λ, где n — целое число), то оба луча оказываются в фазе.

Рис. 26. Следы различных систем параллельных плоскостей в решетки кристалла (из Нейрата и Бэйли, 1956).
Благодаря интерференции они усилят друг друга и дадут более «яркий» отраженный луч. Такой усиленный луч может быть зарегистрирован на фотопластинке в виде темного пятна (рефлекса).
Если же на участке АС—ВС не укладывается целое число волн, то в зависимости от величины разности фаз происходит частичное или полное затухание. При этом общий отраженный луч или ослабится, или полностью погасится.
Усиление общего отраженного луча возможно только в том случае, если углы падения рентгеновых лучей на плоскости кристалла таковы, что на участке «отставания» укладывается целое число волн, т. е. углы падения отвечают условию Брэгга:
![]()
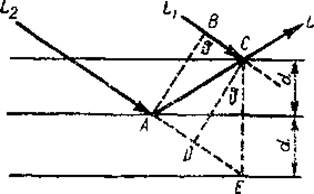
Рис. 27. Схема интерференции лучей (из Некрасова, 1954). Пояснения в тексте.
Следовательно, имеется некоторая критическая величина угла ϑ при которой должно происходить взаимное усиление дифрагированных Х-лучей. При всяком отклонении от критического угла падения происходит значительное ослабление их интенсивности вследствие интерференции. Говоря иными словами, всякий рефлекс на дифракционной фотографии представляет собой исполнение условия Брэгга для отдельной группы плоскостей кристалла. Зная λ и критическую величину угла падения, всегда можно определить межплоскостное расстояние d.

Рис. 28. Дифракция в монокристалле (из Пеирата и Бэйли, 1956):
1 — фильтр, пропускающий монохроматические Х-лучи 2 — коллимационные щели, 3 — цилиндр из фотобумаги, 4 — кристалл белка, 5 — пятно на фотобумаге (рефлекс).
Для решения этого вопроса поступают следующим образом. Узкий пучок монохроматических рентгеновых лучей направляют на кристалл, который расположен таким образом, что может вращаться или колебаться вокруг кристаллографического направления (оси), перпендикулярного направлению пучка Х-лучей. Когда угол падения проходит через некоторую критическую величину, то параллельные лучи отражаются от ряда равноотстоящих плоскостей и дают пятно на поверхности фотобумаги или фотопластинки (рис. 28). Очевидно, что число таких пятен будет велико, поскольку число различных систем параллельных плоскостей также очень велико. Кроме того в центре рентгенограммы появится пятно, вызванное неотклоненными лучами.
Образец такой рентгенограммы представлен на рис. 29. Даже беглый взгляд на этот рисунок позволяет обнаружить определенную регулярность. Так, верхняя и нижняя половины фотографии идентичны, равно как правая и левая половины. Рефлексы симметрично окружают центральное пятно и лежат на ряде горизонтальных линий. Интенсивность пятен на данной линии варьирует регулярным образом. Это позволяет заключить, что геометрическое расположение пятен на рентгенограмме связано определенным образом с геометрическим расположением атомов в кристаллической решетке и с расположением серии плоскостей, от которых происходит дифракция. Эта взаимосвязь определяется законом Брэгга: расстояние каждого рефлекса от центра рентгенограммы обратно пропорционально расстоянию между соответствующими плоскостями в кристалле. Следовательно, по геометрии рентгенограммы можно рассчитать характеристические расстояния для различных систем плоскостей и тем самым оценить размеры и геометрию элементарной ячейки (углы между ее осями).
Однако данные о размерах и геометрии элементарной ячейки еще не позволяют построить трехмерную модель молекулы, ибо ничего не говорят о пространственных координатах составляющих ее атомов. Решение этого вопроса может быть достигнуто путем исследования интенсивностей соответствующих рефлексов. Подобно тому как геометрия элементарной ячейки определяет геометрию рентгенограммы, так и распределение интенсивностей дифракционных максимумов зависит от расположения атомов в элементарной ячейке.
Отражение рентгеновых лучей от плоскостей кристалла обусловлено рассеиванием их электронами тех атомов, которые заполняют данную плоскость. Это рассеяние можно объяснить следующим образом: при падении рентгеновых лучей на вещество электроны начинают колебаться, и каждый электрон становится источником рассеянной сферической волны. Следовательно, чем больше электронов содержится в атомах, заполняющих данную плоскость, тем больше интенсивность излучения, рассеянного ею. Иначе говоря, интенсивность рефлекса пропорциональна электронной плотности определенной системы плоскостей.
Как уже говорилось, любой кристалл представляет собой трехмерную периодически повторяющуюся структуру, т. е. материя в кристалле распределена периодически вдоль его трех осей. Отсюда следует, во-первых, что распределение электронной плотности вдоль любой оси кристалла является периодической функцией, которая может быть представлена в виде ряда Фурье, состоящего из отдельных компонент. Во-вторых, полная картина дифракции рентгеновых лучей представляет собой трехмерную систему пятен, любое сечение которой можно исследовать на рентгенограмме. Каждое пятно такой рентгенограммы соответствует отдельной компоненте Фурье, а распределение электронной плотности вдоль оси кристалла определяется суммой всех этих компонент. При этом каждая компонента входит в сумму со своей амплитудой, периодом и фазой. Зная три последние величины, можно простым суммированием определить распределение электронной плотности вдоль одной из осей кристалла. Период компоненты можно найти по геометрии рентгенограммы, а амплитуду можно определить по интенсивности пятна, которая равна квадрату амплитуды. Труднее всего найти относительную фазу компоненты, так как нет прямых физических методов ее определения.

Рис. 29. Рентгенограмма кристалла миоглобина спермы кита (по Кендрью, 1961).
Для преодоления этой трудности был разработан метод изоморфного замещения, который состоит в том, что атом или небольшая группа атомов в молекуле замещаются атомом или группой атомов тяжелого металла. Такое замещение не вызывает изменений исходной кристаллической структуры, но существенно изменяет дифракционную картину. Сопоставлением рентгенограмм до и после замещения можно определить фазовые соотношения отдельных компонент, т. е. их смещение относительно друг друга. Впервые этот метод был применен Перутцем в 1953 г. для изучения гемоглобина и несколько позже Кендрью для изучения миоглобина.
Сущность определения фазовых соотношений отдельных компонент этим методом состояла в следующем. Введя в маточный раствор, из которого ведется кристаллизация гемоглобина, парахлормеркурибензоат, получали изоморфное соединение белка, в котором две сульфгидрильные группы на каждую молекулу белка прореагировали с ртутным соединением. В результате в элементарной ячейке кристалла в определенных точках находились четыре атома ртути, сильно рассеивающие рентгеновы лучи. Сняв картину дифракционных пятен для замещенного белка и сопоставив ее с рентгенограммой для незамещенного белка, получили рентгенограмму пространственной решетки, состоящей как бы из одних атомов ртути, расставленных в тех точках, где они прикреплены к белку.
«Ртутная» решетка содержит в элементарной ячейке всего 4 атома ртути, и потому ее полный рентгеноструктурный анализ (нахождение пространственного местоположения атомов ртути) осуществляется сравнительно просто. Зная же положение тяжелых групп и их вес, можно вычислить их векторный вклад (т. е. амплитуду и фазу) в компоненту, соответствующую каждому дифракционному максимуму. С другой стороны, каждой компоненте для чистого белка и для замещенного белка соответствуют векторы с найденными амплитудами, но неизвестными фазами. Следовательно, в распоряжении исследователя оказываются три вектора, для двух из которых известны амплитуды (т. е. величина), а для третьего — амплитуда и фаза (т. е. величина и направление). Построив векторный треугольник, образованный двумя векторами заданной длины и вектором разности, можно найти фазовые углы геометрически.

Рис. 30. Двумерная проекция Фурье элементарной ячейки миоглобина (по Кендрью, 1961).
Наиболее высокие пики, соответствующие наибольшем густоте концентрических линии, обусловлены атомами железа гема.
Зная же период, амплитуду и фазу каждой компоненты, можно определить распределение электронной плотности вдоль оси. кристалла и осуществить так называемый двумерный синтез Фурье. Такая двумерная проекция изображается в виде результирующей контурной карты электронной плотности и является как бы силуэтом молекулы на плоскости, силуэтом неточным и очень запутанным (рис. 30).
Так как толщина элементарной ячейки гемоглобина соответствует толщине примерно 40 атомов, то при проектировании на плоскость следы всех атомов накладываются друг на друга и не поддаются расшифровке. Чтобы определить кристаллическую структуру, необходимо установить распределение электронной плотности по всем трем осям кристалла (трехмерный синтез Фурье). Для этого сначала были получены карты электронной плотности для большого количества параллельных плоскостей элементарной ячейки. Затем эти карты были совмещены друг с другом таким образом, чтобы можно было получить представление о трехмерном расположении контуров электронной плотности. На основании подобных трехмерных карт (рис. 31) были построены трехмерные модели молекулы миоглобина при разрешении в 6 Å (Кендрью) и гемоглобина при разрешении в 5,5 Å (Перутц).

Рис. 31 Трехмерный синтез Фурье для элементарной ячейки миоглобина (по Кендрью, 1961).
Видны некоторые стержнеобразные полипептидные цепи.
Такое разрешение включает в пик электронной плотности несколько атомов и отражает кристаллическую структуру только па уровне молекулы. На рис 32 представлена трехмерная модель молекулы миоглобина; внутри молекулы виден изогнутый стержень высокой электронной плотности, представляющий собой полипептидную цепь спиралевидного типа. Стержень изогнут и свернут в компактное тело — глобулу; в местах изгибов регулярность спирали нарушена, и полипептидная цепь белка находится в аморфном состоянии. Хорошо видна также геминовая группа с атомом железа. Справа изображена схема этой модели; диск изображает геминовую группу.
Однако, пользуясь этой моделью, нельзя еще ничего сказать о расположении отдельных аминокислот в полипептидной цепи. Ясно лишь, что это расположение на линейных участках обладает осевой симметрией и представляет собой спирали диаметром около 10 Å, что соответствует ширине а-спирали Полинга и Кори. Расположение аминокислотных остатков было установлено тогда, когда Кендрыо с сотр. построили модель с разрешением 2 Å (рис. 33). На такой модели было показано, что стержень высокой электронной плотности представляет собой последовательность аминокислотных остатков, расположенных по спирали. Были идентифицированы некоторые остатки и их местоположение, равно как и местоположение боковых цепей. Таким образом, третичная структура миоглобина стала известна раньше, чем была расшифрована его первичная структура.
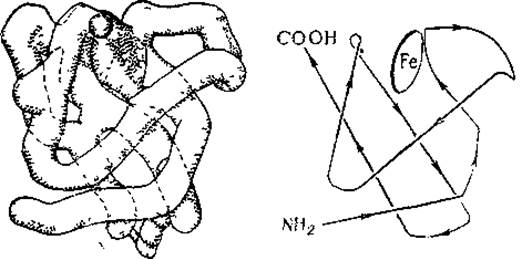
Рис. 32. Трехмерная модель, миоглоблна и ее схема, разрешение до 6 Å (Steiner, 1965).
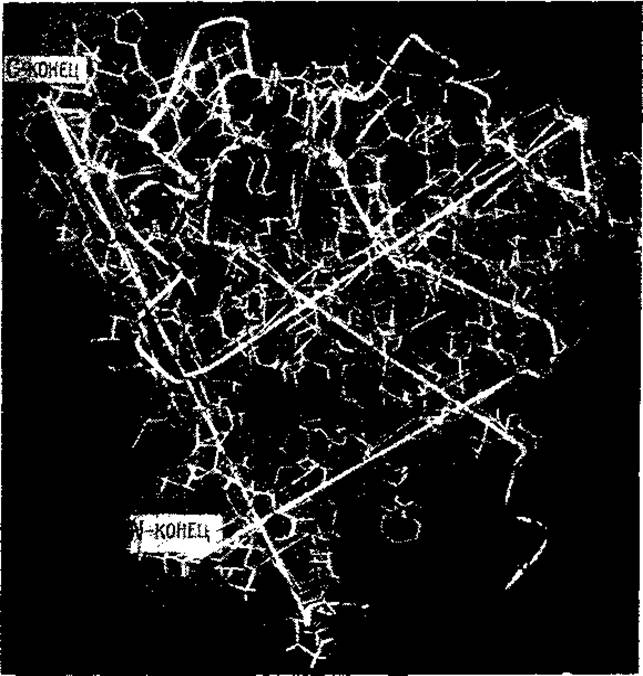
Рис. 33, Модель молекулы миоглобина, разрешение до 2 A (Ramsay, 1965)
Различимы аминокислотные остатки с крупными (например ароматическими) радикалами. На тиненных участках видно спиральное расположение отдельных звеньев полипептидной цепи
При рассмотрении рис. 33 ясно различимы все три уровня организации белковой молекулы. Во-первых, последовательность аминокислот, их правильное чередование вдоль полипептидной цепи, которое составляет первичную структуру белка. Далее видно, что на линейных участках полипептидная цепь свернута в спираль, соответствующую а-спирали Полинга и Кори. И, наконец, чередующиеся спиральные и аморфные участки уложены в пространстве в компактное и симметричное тело — глобулу, образуя третичную структуру белка.
Какое значение имеет подобная структура и как она связана с функцией глобулярных белков? К сожалению, ответить на этот вопрос еще невозможно. Правда, известно, что окисленная и восстановленная формы гемоглобина кристаллизуются различно. Это указывает на перестройку структуры белка при его функционировании, т. е. при соединении кислорода с гемом. Однако в чем заключается эта перестройка, неизвестно, ибо до сих пор изучена только окисленная форма гемоглобина (метгемоглобин). Вообще же для исчерпывающего ответа на этот вопрос необходимо провести параллель между структурой целого ряда белков и их функциями, что требует, в свою очередь, определить их третичную структуру. В настоящее время в ряде лабораторий проводится рентгеноструктурный анализ ряда белков: инсулина, цитохрома С, рибонуклеазы, лизоцима и др. Однако эта работа сталкивается с большими трудностями при дешифровке рентгенограмм. При разрешении в 6 Å требуется провести фотометрическое измерение 400 рефлексов дифракционной картины миоглобина, при разрешении в 2 Å — около 10000 рефлексов, а при разрешении в 1,4 Å — более 25 000 рефлексов. Число измерений возрастает до сотен тысяч, когда параллельно идет измерение изоморфно замещенных соединений. Все это потребовало заменить фотометрическое измерение дифракционных максимумов прямым отсчетом интенсивности с помощью счетчика квантов на автоматическом дифрактометре. Показания этого прибора передаются на записывающее устройство, и все последующие расчеты осуществляются с помощью быстродействующих электронных вычислительных машин. Автоматизация рентгеноструктурного анализа позволяет надеяться, что в ближайшие годы этот метод даст нам точное знание первичной, вторичной и третичной структур ряда белков.