Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Определение величины и формы белковых молекул
Двойное лучепреломление в потоке
Одним из характерных свойств белковых частиц является их оптическая анизотропия, т. е. различие оптических свойств по разным направлениям. В одних случаях оптическая анизотропия обусловлена внутренним строением частицы, в других — их формой или искусственно вызванной ориентацией. Исследование оптической анизотропии является важным методом изучения формы коллоидных частиц.
Для исследования оптической анизотропии применяются оптические системы, состоящие из поляризаторов, которые создают пучки плоскополяризованного света при помощи призм Николя, и анализаторов с компенсаторами, пользуясь которыми, можно обнаружить и измерить поляризацию светового пучка. Исследуемые растворы или пленки, в которых создается соответственно течение или растяжение, помещают между поляризатором и анализатором.
Плоскополяризованный луч в анизотропной среде разделяется на два луча, у одного из которых плоскость колебаний перпендикулярна оптической оси среды, а у другого — параллельна этой оси. Первый луч называют обыкновенным, а второй необыкновенным. Скорость распространения обоих лучей в среде и их показатели преломления различны, вследствие чего возникает двойное лучепреломление, измеряемое разностью показателей преломления ∆n для необыкновенного (nе) и обыкновенного (n0) лучей. В случае, если nе < n0 и ∆n < 0, двойное лучепреломление называется отрицательным; если же ne > n0 и ∆n > 0, то двойное лучепреломление называется положительным. Если белковые частицы сами по себе оптически анизотропны, то присущая им величина ∆n мало зависит от показателя преломления дисперсной среды; в этом случае говорят о собственном двойном лучепреломлении частиц. Однако оптическая анизотропия в коллоидной системе может быть также обусловлена просто ориентированным расположением асимметричных по своей форме частиц, которые сами по себе могут и не обладать оптической анизотропией; в этом случае говорят о двойном лучепреломлении формы. Некоторые из белков, например коллаген, обладают только лучепреломлением формы, другим же, например миозину, свойственно и заметное собственное лучепреломление.
Ориентацию белковых макромолекул можно вызывать различными способами и соответственно можно исследовать двойное лучепреломление в электрическом или магнитном поле и при течении раствора. Во всех случаях белковый раствор с ориентированными вытянутыми частицами приобретает описанные выше свойства одноосного, оптически анизотропного тела. Однако полнота ориентации частиц нарушается их вращательным броуновским движением; в результате в растворе устанавливается определенное распределение ориентации, при котором между оптической осью в жидкости и средним направлением ориентации образуется определенный угол χ. В зависимости от силы ориентирующих воздействий этот угол меняется от значения 45° при слабой ориентации до 0° при сильной ориентации частиц.
Наибольшее значение при изучении белковых растворов получило исследование двойного лучепреломления при течении, или двойного лучепреломления в потоке. Для этого раствор помещают между двумя соосными цилиндрами, один из которых вращается, а другой остается неподвижным, и рассматривают поле между цилиндрами в плоскополяризованном монохроматическом свете при скрещенных пиколях. В неподвижном коллоидном растворе поле зрения кажется темным, но при течении возникает ориентация вытянутых белковых частиц, и раствор приобретает двойное лучепреломление. При этом в поле зрения появляются четыре темных пятна, которые образуют характерную для одноосного кристалла крестообразную фигуру — крест-изоклин (рис. 36).
В этих областях оптическая ось раствора параллельна плоскости колебания света, проходящего через поляризатор и анализатор. Поворот креста-изоклина зависит от скорости потока и может быть измерен при помощи компенсатора. По положению креста можно непосредственно определить угол χ, характеризующий степень ориентации частиц. Зная значения угла при известной скорости течения жидкости, можно вычислить коэффициент вращательной диффузии 0, а затем определить соотношение большой (а) и малой (b) полуосей молекулы:
![]()
На основании измерений двойного лучепреломления в потоке была оценена степень асимметричности молекул многих белков, а в сочетании с другими методами определены и абсолютные размеры молекул. Так, длина молекулы фибриногена и соотношение ее полуосей оказались соответственно равными 700 Å и 16; для вируса табачной мозаики эти величины составляли 3000 Å и 20; для актомиозина — 8000 Å. Считается, что этот метод пригоден для изучения линейных размеров сильно вытянутых молекул и для определения их состояния при деструкции и денатурации. Для молекул с линейными размерами менее 200 Å этот метод считается непригодным.
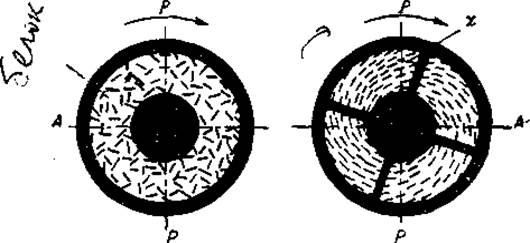
Рис. 36. Ориентация части и крест-изоклин в двупрeломляющей жидкости, находящейся между коаксиальными цилиндрами (из Пенрата и Бэйли, 1956)