БИОХИМИЯ - Основные питательные вещества человека - 2016 год
1. БЕЛКИ
1.3. Пространственная структура белков
У белков, строение которых характеризуется исключительной сложностью, кроме первичной структуры различают и более высокие уровни организации: вторичную, третичную, а иногда и четвертичную структуры.
Исключительное свойство белков - самоорганизация их структуры, т. е. способность каждого белка самопроизвольно создавать определенную, свойственную только ему пространственную структуру. В пространственном строении белков большое значение имеет характер радикалов (R) в молекулах аминокислот. Неполярные (гидрофобные) остатки аминокислот (например, - CH3, - Ph) обычно располагаются внутри макромолекулы белка и обуславливают гидрофобные взаимодействия. Полярные ионогенные группы (образующие ионы, например - СООН, -NH2) обычно находятся на поверхности и обуславливают электростатические (ионные) взаимодействия. Полярные неионогенные радикалы (- ОН, -СОNН2) могут располагаться как снаружи, так и внутри молекулы. Они участвуют в образовании водородных связей.
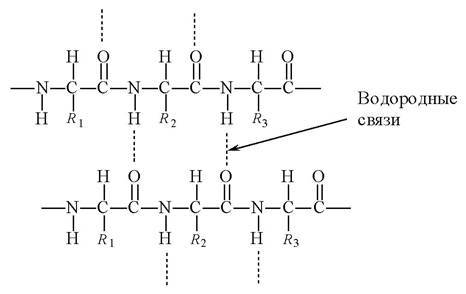
Вторичная структура белка - способ укладки полипептидной цепи в упорядоченную форму за счет системы водородных связей (спиральной, слоисто-складчатой).
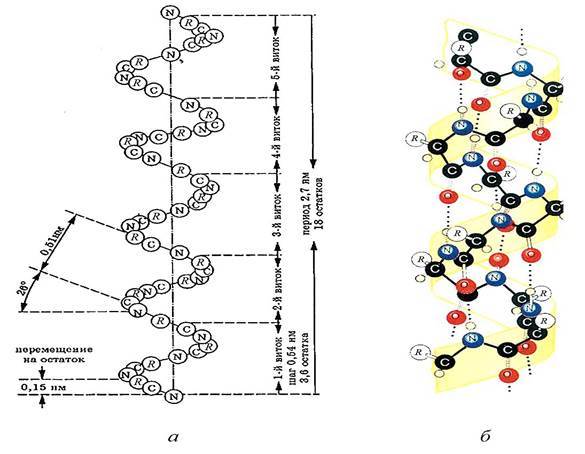
Спиральная структура (α - структура) образуется посредством водородных связей между пептидными группами α - аминокислотных остатков одной белковой молекулы. Одиночная полипептидная цепь скручивается, образуя спираль, и водородные связи проходят не поперек, а вертикально вверх и вниз по оси спирали (рис. 1). В действительности водородные связи не совсем вертикальны, а немного наклонены по отношению к оси спирали, поскольку на один виток приходится 3,6 аминокислоты, а не целое число. α - Спиральной структурой обладает большая часть белков, но не всегда на всем протяжении полипептидной цепи.
Рис. 1. Схема (а) и модель (б) α - спиральной структуры полипептидной цепи
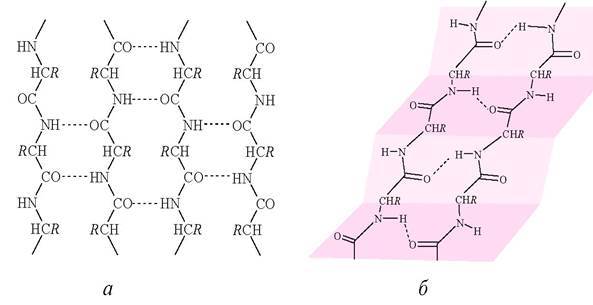
Складчатая структура (β - складчатый лист) имеет водородные связи между пептидными группами, но в этом случае полипептидная цепь складывается пополам, образуя приплюснутую структуру. В β - слое водородные связи направлены в одну и в другую сторону относительно полипептидной цепи (рис. 2).
Рис. 2. Изображение структуры β - складчатого листа: а - в плоскости; б-в пространстве; в - шаростержневая модель
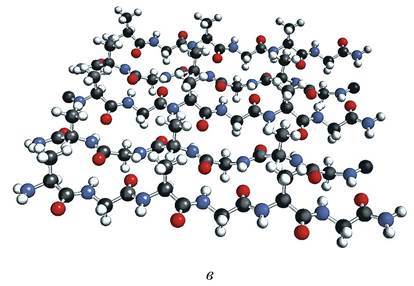
Полипептидные цепочки с определенной вторичной структурой могут быть по - разному расположены в пространстве. Пространственное расположение данных цепочек получило название третичной структуры белка. Таким образом, третичная структура белка - это специфическая укладка упорядоченных (регулярных, таких как α - спираль и β - слой) и неупорядоченных (аморфных) участков полипептидной цепи.
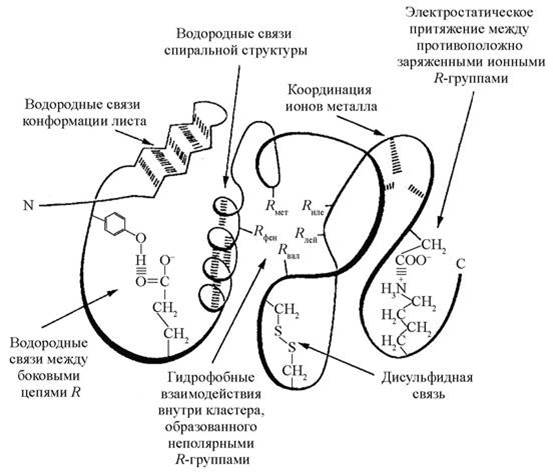
В формировании третичной структуры белка кроме водородных связей большую роль играют ионные и гидрофобные взаимодействия, ковалентные дисульфидные связи, координационные взаимодействия, а также Ван-дер-Ваальсовы силы (рис. 3).
Рис. 3. Типы связей и взаимодействий, участвующих в формировании третичной структуры белковой молекулы
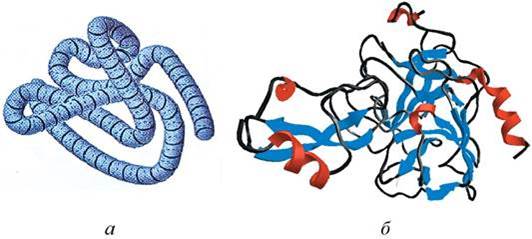
По характеру «упаковки» белковой молекулы различают глобулярные (шаровидные) и фибриллярные (нитевидные) белки (рис. 4).
Для глобулярных белков более характерна α - спиральная структура, спирали изогнуты, «свернуты». Макромолекулы имеют сферическую форму (см. рис. 4). Они растворяются в воде, солевых растворах с образованием коллоидных систем. Многие глобулярные белки являются ферментами.
Рис. 4. Третичная структура белка: а - схема укладки полипептидной цепи; б - пространственная модель. Красным цветом обозначены фрагменты α - спирали, синим - фрагменты β - складчатого листа
Для фибриллярных белков более характерна β - структура. Фибриллярные белки состоят из вытянутых или скрученных в спирали полипептидных цепей, расположенных параллельно и соединенных многочисленными связями нековалентной и ковалентной природы.
Как правило, это белки, образующие прочные жесткие структуры, они нерастворимы в воде и более однородны по составу аминокислотных остатков, преимущественно гидрофобных, в полипептидных цепях.
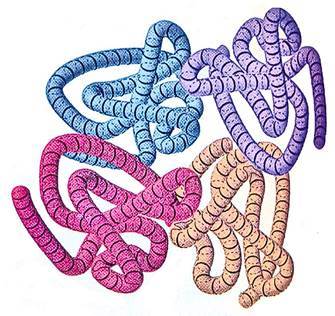
Четвертичная структура белка представляет собой ассоциацию нескольких полипептидных цепей с определенной конформацией в стабильный агрегат, не имеющий ковалентных связей (рис. 5).
Полипептидные цепи, составляющие агрегат, называются субъединицами.
Рис. 5. Четвертичная структура белка. Построение сложного белкового агрегата (комплекса) из отдельных полипептидных цепей со своей первичной, вторичной и третичной структурами