Підручник - БІОЛОГІЧНА ХІМІЯ - Губський Ю.І. - 2000
Розділ III. МЕТАБОЛІЗМ ОСНОВНИХ КЛАСІВ БІОМОЛЕКУЛ
ГЛАВА 15. МЕТАБОЛІЗМ ЛІПІДІВ. II. БІОСИНТЕЗ ТРИАЦИЛГЛІЦЕРОЛІВ І СКЛАДНИХ ЛІПІДІВ
Біосинтез ліпідів різних класів є важливою складовою їх метаболізму, що забезпечує організм резервами метаболічного палива у вигляді акумульованих у жировій тканині та клітинах інших органів триацилгліцеролів і є необхідним для поновлення структурних компонентів біомембран (фосфогліцеридів, сфінголіпідів, гліколіпідів).
15.1. БІОСИНТЕЗ ВИЩИХ ЖИРНИХ КИСЛОТ
Біосинтез вищих жирних кислот із подальшим їх включенням до складу триацилгліцеролів жирової та інших тканин — ліпогенез — є метаболічним шляхом, що дозволяє акумулювати в організмі людини та тварин значні енергетичні резерви метаболічного палива.
Фізіологічне значення цього процесу пояснюється тією обставиною, що здатність тваринних клітин до створення запасів полісахаридів у вигляді глікогену є досить обмеженою, і тому глюкоза, що надходить із їжею в кількостях, які перевищують безпосередні енергетичні потреби організму, перетворюється на жирні кислоти. Найбільш активно синтез жирних кислот відбувається в адипоцитах жирової тканини, гепатоцитах печінки, епітеліальних клітинах молочної залози під час лактації.
Метаболічні джерела синтезу жирних кислот
В організмі людини і тварин здійснюється синтез насичених жирних кислот із парною кількістю вуглецевих атомів (переважно пальмітату та стеарату); метаболічним джерелом для цього синтезу є ацетил-КоА, який утворюється за рахунок аеробного окислення глюкози. Активність процесу біосинтезу жирних кислот залежить від характеру дієти; їжа, що містить значну кількість жирів, пригнічує швидкість цього синтезу.
Ферментні реакції біосинтезу жирних кислот з ацетил-КоА, на відміну від їх окислення, відбуваються в цитоплазмі клітин; основним продуктом цього синтезу є пальмітинова кислота С15Н31СООН.
Безпосереднім донором двовуглецевих фрагментів, що використовуються клітиною для синтезу довголанцюгових жирних кислот, є ацетил-КоА, утворюваний у реакції окислювального декарбоксилювання пірувату (глава 11), яка перебігає в матриксі мітохондрій. Оскільки внутрішня мембрана мітохондрій є непроникною для ацетил-КоА, то для використання ацетил-КоА в процесі біосинтезу жирних кислот застосовується спеціальна човникова система, яка транспортує мітохондріальний ацетил-КоА в цитозоль. Процес відбувається за таким механізмом:
1. Усередині мітохондрій ацетил-КоА взаємодіє з оксалоацетатом, утворюючи лимонну кислоту (цитрат), яка є головним субстратом окислювального цитратного циклу (ЦТК), але може частково залишати мітохондрії і виходити в цитозоль за допомогою спеціальної транспортної системи трикарбоксилатів:
![]()
Стимуляція виходу цитрату з мітохондрій у цитоплазму можлива в умовах, що сприяють активації анаболічних процесів в організмі, зокрема при посиленому харчуванні глюкозою та іншими цукрами, гліколітичне окислення яких спричиняє накопичення цитрату й інших метаболітів ЦТК у матриксі мітохондрій.
2. У цитозольному просторі цитрат розщеплюється спеціальною ліазою з утворенням оксалоацетату та цитозольного ацетил-КоА, який надходить у систему синтезу вищих жирних кислот:
![]()
Оксалоацетат повертається до матриксу мітоходрій за допомогою човникової системи, що включає його відновлення до малагу, який може проникати через мітохондріальну мембрану. Альтернативним механізмом повернення вуглецевих атомів малату в цитозоль є його перетворення в піруват — шлях, який генерує відновлений НАДФ+, необхідний для синтезу жирних кислот (див. нижче) — рис. 15.1.
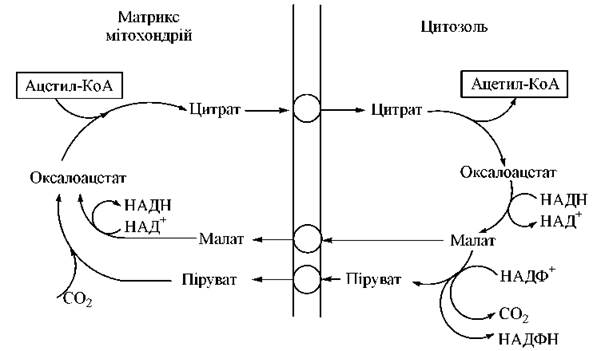
Рис. 15.1. Човникова система транспорту ацетильних радикалів із мітохондрій у цитозоль.
Синтез малоніл-КоА
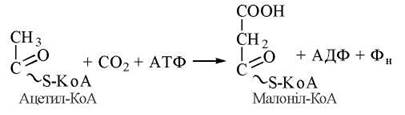
Ініціація росту вуглецевого ланцюга вищої жирної кислоти відбувається шляхом взаємодії ацетил-КоА з активною формою малонової кислоти — малоніл-КоА, який безпосередньо постачає двовуглецеві субстрати для цього синтезу. Таким чином, у разі біосинтезу пальмітату малоніл-КоА є метаболічним попередником, який стає джерелом 14 з 16 атомів вуглецю пальмітату.
Малоніл-КоА утворюється з цитоплазматичного CH 3 ацетил-КоА та діоксиду вуглецю під дією біотинвмісного ферменту ацетил-КоА-карбоксилази.
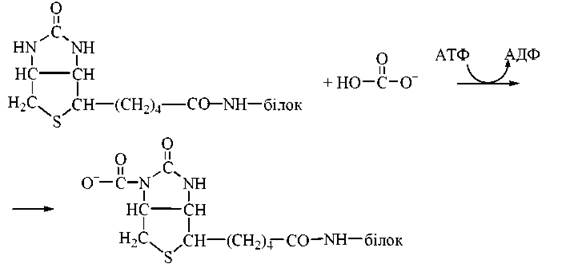
Ацетил-КоА-карбоксилаза містить кофермент біотин (вітамін Н), що є простетичною групою ферменту. Карбоксильна група біотину зв’язана амідним зв’язком із Е-аміногрупою лізинового залишку, який розташований в активному центрі ферменту.
Активною формою вугільної кислоти, яка бере участь у карбоксилюванні ацетил-КоА, є карбоксибіотин, що утворюється в такій реакції:
Біохімічні стадії синтезу насичених жирних кислот
Синтетаза жирних кислот є мультиензимним комплексом, до складу якого входять декілька ферментних білків із каталітичною активністю, що забезпечує послідовне подовження вуглецевого ланцюга (С2, С4, С6 ...) до утворення ацильного залишку з необхідною кількістю вуглецевих атомів (переважно С16). Сукупність ферментних реакцій біосинтезу пальмітинової кислоти називається циклом Лінена.
Ацилтранспортуючий протеїн
Центральне місце у ферментному комплексі синтетази жирних кислот посідає ацилтранспортуючий протеїн(Acyl Carrier Protein, ACP, англ.). Із молекулою ACP сполучені ферментні білки, що каталізують окремі реакції синтезу жирних кислот С16 та С18. ACP має два SH-вмісних центри зв’язування:
1-й центр —залишок цистеїну поліпептидного ланцюга ACP, який служить для акцептування ацетильного радикалу (СН3-СО-) від ацетил-КоА;
2-й центр — фосфорильоване похідне вітаміну пантотенової кислоти — 4'-фосфопантетеїн, що є структурою, SH-групи якої акцептують малонільний радикал (НООС-СН2-СО-) від малоніл-КоА. 4'-Фосфопантетеїн (Фп) ковалентно сполучений із залишком серину в 36-му положенні поліпептидного ланцюга ACP.
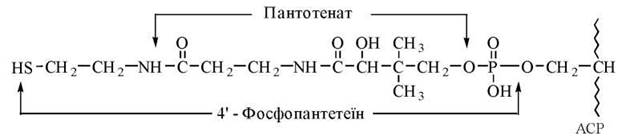
Взаємодія ацетил-КоА з ACP має вигляд:
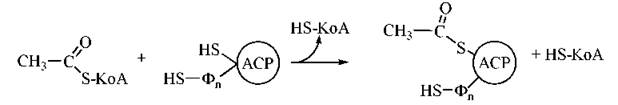
Подібним чином взаємодіє з АРС (HS-групою Фп) і малоніл-КоА.
Послідовність ферментативних реакцій
Після акцептування ацилтранспортуючим білком ацетильного й малонільного радикалів формування ланцюга вищої жирної кислоти може бути поданим у вигляді зазначеної нижче послідовності реакцій.
1. Перенесення ацетильного радикалу, зв’язаного з SH-групою цистеїну, на малонільний радикал, зв’язаний з SH-групою фосфопантетеїну, з утворенням ацетоацетильного радикала, що зв’язаний з SH-групою фосфопантетеїну. Ця реакція конденсації каталізується ферментом 3-кетоацил-АСР-синтазою:
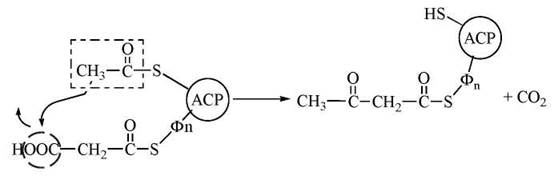
У результаті реакції утворюється ацетоацетил — АРС і виділяється (регенерує) молекула СО2, що була використана для синтезу малоніл-КоА.
2. Відновлення карбонільної групи в молекулі ацетоацетил-ACP з утворенням 3-гідроксибутирил-ACP. Реакція каталізується НАДФН-залежною 3-кетоацил-АСР-редуктазою:
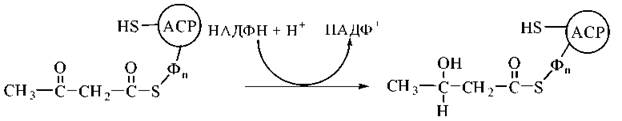
3. Дегідратація 3-гідроксибутирильного радикала за участю ферменту 3-гідроксиацил-АСР-дегідратази. Продукт реакції — ненасичене похідне масляної кислоти (бутирату), подвійний зв’язок в якому розміщений між 2-м і 3-м атомами вуглецю (Δ2) та має транс-конфігурацію — транс-бутеноїл-Δ2-AСР:
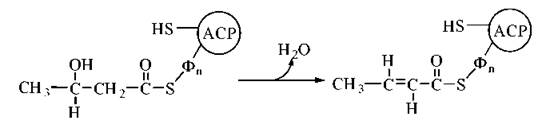
4. Відновлення подвійного зв’язку в молекулі mранс-бутеноїл-Δ2-ACP за участю ферменту еноїл-АСР-редуктази. Продукт реакції — бутирильний радикал, сполучений із ACP:
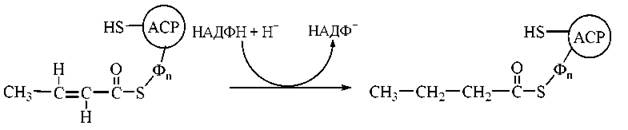
У результаті розглянутої послідовності чотирьох реакцій двовуглецевий ацетильний радикал (С2) перетворився на чотиривуглецевий бутирильний радикал (С4). Для продовження процесу елонгації вуглеводневих радикалів необхідне приведення ферментної системи синтетази жирних кислот у вихідний стан, що досягається перенесенням бутирилу від SH-групи фосфопантетеїну на SH-групу цистеїну та приєднанням до SH-групи фосфопантетеїну, що звільнилася, нового залишку малонілу:
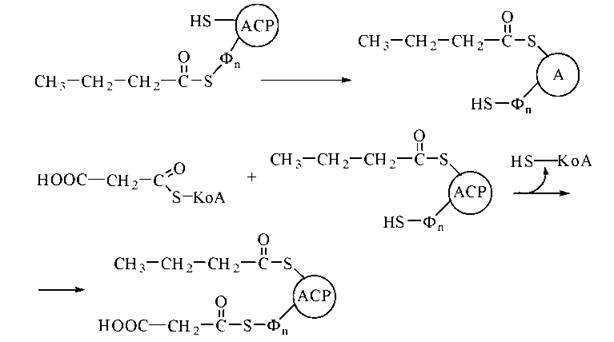
У подальшому починається новий цикл реакцій, що полягають у подовженні вуглеводневого радикала карбонової кислоти ще на один двовуглецевий фрагмент. Продуктом семи зазначених циклів є утворення радикалу пальмітинової кислоти (С16), який відщеплюється від ACP у результаті гідролітичної тіоестеразної реакції:
![]()
Сумарне рівняння біосинтезу пальмітату з ацетил-КоА в результаті дії синтетази вищих жирних кислот.
![]()
Джерела НАДФН, необхідного для біосинтезу жирних кислот
У кожному циклі біосинтезу пальмітату відбувається по дві відновлювальні реакції, донором водню (2Н+ + 2e-) в яких є НАДФН. Одним з основних постачальників молекул цитозольного НАДФН, відновлювальні еквіваленти яких використовуються при ліпогенезі, є реакція перетворення малату до пірувату, що спряжена з функціонуванням човникової системи транспорту ацетильних радикалів (див. рис. 15.1).
1. У першій реакції оксалоацетат відновлюється до малату за участю цитозольної малатдегідрогенази:
![]()
2. У другій реакції відбувається окислювальне декарбоксилювання малату до пірувату за допомогою НАДФ-залежного ферменту малікензиму:
![]()
НАДФН, що генерувався в реакції, використовується в ліпогенезі, а піруват перетворюється до оксалоацетату в піруваткарбоксилазній реакції.
Крім розглянутого механізму, постачальником НАДФН, що використовується в біосинтезі пальмітату, виступають також глюкозо-6-фосфат-дегідрогеназна реакція пентозофосфатного циклу окислення глюкози та НАДФ-залежна ізоцитратдегідрогеназна реакція, що перебігає в цитозолі.
Регуляція біосинтезу насичених жирних кислот
Існують два пункти регуляції синтезу вищих насичених жирних кислот в організмі людини:
1. Регуляція на рівні ацетил-КоА-карбоксилази.
Ацетил-КоА-карбоксилазна реакція, в якій утворюється малоніл-КоА, є лімітуючою стадією в контролі швидкості біосинтезу жирних кислот. Регуляція перебігу реакції здійснюється за двома механізмами:
1.1. Шляхом алостеричної регуляції активності ацетил-КоА-карбоксилази позитивними та негативними модуляторами:
а) позитивним модулятором (активатором) ферменту є цитрат. Збільшення концентрації лимонної кислоти в мітохондріях внаслідок «перевантаження» ЦТК метаболічним паливом (після споживання вуглеводів, секреції в кров інсуліну тощо) означає створення біохімічних умов для активації анаболічних процесів, тобто запасання надлишків ацетил-КоА у вигляді жирів. Підвищений у цих умовах вихід цитрату в цитозоль активує ацетил-КоА-карбоксилазу (малоактивну за відсутності позитивного модулятора) і спричиняє утворення малоніл-КоА — джерела двовуглецевих радикалів для біосинтезу жирних кислот;
б) негативними модуляторами (алостеричними інгібіторами) ацетил-КоА-карбоксилази є пальмітоїл-КоА та стеароїл-КоА — кінцеві метаболіти біосинтетичного шляху. Накопичення в цитозолі продуктів біосинтезу за принципом негативного зворотного зв’язку гальмує швидкість їх утворення.
1.2. Шляхом ковалентної модифікації ацетил-КоА-карбоксилази за рахунок її цАМФ-залежного фосфорилювання (утворення неактивної форми ферменту) та дефосфорилювання (утворення активної форми ферменту). Слід зауважити реципрокний характер зміни активності процесів ліпогенезу та ліполізу в умовах дії на клітини жирової тканини та печінки фізіологічних стимулів, що позитивно (адреналін, норадреналін, глюкагон) та негативно (інсулін) впливають на активність аденілатциклази і внутрішньоклітинний рівень цАМФ (див. главу 14; розділ 14.1).
1.3. Шляхом зміни активності синтезу ацетил-КоА-карбоксилази:
а) збільшення активності синтезу ферменту (ферментна індукція) спричиняється додатковим надходженням в організм та в клітини відповідних органів глюкози (споживання високовуглеводної дієти) та зменшенням вмісту в продуктах харчування жирів;
б) пригнічення активності синтезу ферменту спостерігається в умовах голодування або споживання дієти, збагаченої жирами.
2. Регуляція на рівні комплексу синтетази жирних кислот
Активність синтетазного комплексу (циклу Лінена) регулюється також як механізмами алостеричного контролю, так і механізмами ферментної індукції.
2.1. Алостерична активація окремих ферментів мультиензимного комплексу здійснюється за рахунок позитивного впливу фосфорильованих моносахаридів. Збільшення концентрації цукрофосфатів є метаболічним сигналом, що свідчить про високу активність гліколізу та створює біохімічні умови для спрямування обміну речовин у напрямку анаболічних процесів.
2.2. Зміни в активності процесів синтезу окремих ферментів синтетазного комплексу відбуваються в напрямках і метаболічних умовах, зазначених для ацетил-КоА-карбоксилази.
Елонгація насичених жирних кислот
Пальмітинова кислота (С16), що продукується в результаті дії синтетази вищих жирних кислот, є попередником в утворенні жирних кислот із більшою довжиною ланцюга — С18, С20, С22, С24. У клітинах функціонують дві системи елонгації жирних кислот, які забезпечують послідовне приєднання до вуглеводневих ацильних радикалів двовуглецевих фрагментів:
а) система елонгації ендоплазматичного ретикулума («мікросомальна елонгаційна система»). Ця система використовує як джерело двовуглецевих фрагментів малоніл-КоА і діє за механізмом, близьким до розглянутого для синтетазної системи цитозолю:
![]()
Субстратами розглянутої послідовності реакцій є насичені жирні кислоти (ацили С10 та більшої довжини). У печінці при використанні як субстрат пальмітату утворюється переважно стеарат (С18). Система елонгації жирних кислот у головному мозку синтезує С22- та С24-жирні кислоти, які входять до складу сфінголіпідів мієлінових нервових волокон;
б) мітохондріальна система елонгації жирних кислот—використовує як донори двовуглецевих фрагментів молекули ацетил-КоА. Система здатна подовжувати жирні кислоти, що мають 12-16 атомів вуглецю (С12-С16):
![]()
Утворення ненасичених жирних кислот
1. Мононенасичені жирні кислоти
Мононенасичені кислоти — пальмітоолеїнова С16:1 та олеїнова С18:1 містять подвійний зв’язок між 9-м та 10-м атомами вуглецю (Δ9).
Ці жирні кислоти можуть утворюватися в організмі людини за рахунок дегідрування відповідних насичених кислот (пальмітинової С16 та стеаринової С18):
![]()
Утворення зазначеного подвійного зв’язку здійснюється за участю системи десатураціїжирних кислот (ацил-КоА-оксигенази), що належить, за механізмом дії, до мікросомальних монооксигеназ (оксигеназ мішаної функції), які потребують для свого функціонування НАДФН (або НАДН) та включають цитохром bs електротранспортного ланцюга, локалізованого в мембранах ендоплазматичного ретикулума гепатоцитів:
![]()
2. Поліненасичені жирні кислоти
Поліненасичені кислоти — лінолева С18:2(Δ9,12) та α-ліноленова С18 3(А9,12,15) — попередники в утворенні інших, життєво необхідних ацилів, не можуть синтезуватися в клітинах людського організму у зв’язку з відсутністю ферментних систем, що необхідні для утворення додаткових подвійних зв’язків між Δ9-подвійним зв’язком і метильним кінцем жирної кислоти.
Зазначені ферменти присутні в багатьох рослинних організмах, і тому існує потреба в постійному надходженні лінолевої та α-ліноленової кислот в організм як компонентів рослинної їжі, що є незамінними факторами харчування («есенціальні жирні кислоти»).
У разі надходження цих жирних кислот у складі дієти, ферментні системи ендоплазматичного ретикулума гепатоцитів за розглянутими вище механізмами десатурації та елонгації можуть трансформувати лінолеву кислоту в такі поліненасичені кислоти, як γ-ліноленову С18:3(Δ6,9,12) та арахідонову С20:4 (Δ5,8,11,14), а α-ліноленову — в докозангексенову (С22:6) кислоту.
Арахідонова кислота — попередник біологічно активних ейкозаноїдів (простагландинів, простациклінів, тромбоксанів), утворюється з незамінної лінолевої кислоти С шляхом подовження її вуглецевого ланцюга та утворення додаткових подвійних зв’язків:
![]()
Загальну схему формування в організмі людини насичених і ненасиченихих вищих жирних кислот подано на рис. 15.2.
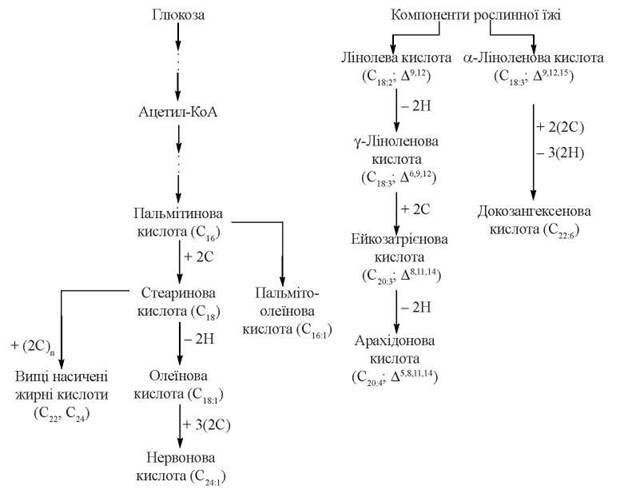
Рис. 15.2. Метаболічна карта біосинтезу насичених і ненасичених жирних кислот ферментними системами людського організму.