Практическая химия белка - А. Дарбре 1989
Определение состава белковых олигомеров. Получение мономеров и полипептидных цепей
Стехиометрическое соотношение мономеров в олигомере
Сшивание субъединиц бифункциональными реагентами
При определении числа мономеров в олигомере все большее распространение получает метод, основанный на сшивании мономеров бифункциональными реагентами с последующим анализом продуктов реакции с помощью электрофореза в ПААГ — ДСН [44]. Электрофореграмма представляет собой набор зон, соответствующих компонентам смеси, молекулярные массы которых кратны молекулярной массе мономера вплоть до полного олигомера. В случае олигомеров, составленных из идентичных или почти идентичных мономеров, число основных зон должно соответствовать набору мономеров.
С помощью бифункциональных реагентов можно определять четвертичную структуру олигомеров [72, 82], однако этот вопрос требует специального обсуждения. Тем не менее, когда речь идет о простой системе — тетрамере, гексамере или октамере, — имеет смысл использовать такой подход для определения расположения мономеров в олигомере.
В подавляющем большинстве экспериментов в качестве сшивающего агента используются бисиминоэфиры карбоновых кислот с различной длиной цепи, и в первую очередь диметиловый эфир иминопробковой кислоты (n = 6). Эти высокоспецифические модифицирующие реагенты легко взаимодействуют с а- и ε-аминогруппами остатков лизина с образованием амидинов (рKа>11). Реагенты иного типа включают ацилазиды, реагенты на сульфгидрильные группы, глутаровый альдегид [132]. Применяют также относительно устойчивые бисиминоэфиры янтарной кислоты, образующие стабильные или гидролизуемые поперечные связи [77].
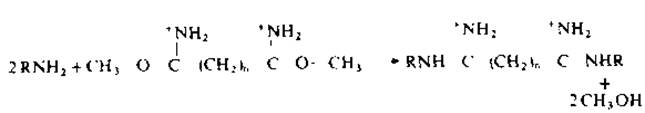
Бисиминоэфиры гидролизуются в растворе по двум или одной функциональной группе, тогда как другая может быть связана с аминогруппой белка. Некоторые молекулы реагента взаимодействуют с двумя молекулами белка, образуя как внутри-, так и межмолекулярные ковалентные связи [132].
На молекулярную массу конечного продукта существенное влияние оказывают только межмолекулярные связи, что легко обнаружить в денатурирующих условиях. Поперечные связи в пределах субъединиц (аналогично дисульфидным связям) удерживают полипептидную цепь в свернутом состоянии, уменьшая тем самым гидродинамический объем и кажущуюся молекулярную массу. Некоторые из продуктов, полученных при сшивании тетрамеров типа а4 и a2β2, представлены на рис. 1.6. Распределение полимеров по молекулярным массам определяется числом и положением поперечных связей.
Тем не менее по «спектру» молекулярных масс перекрывающихся полимеров можно определить число мономеров в простом олигомере. Олигомеры, составленные из мономеров с различными молекулярными массами (например, типа а2β2), образуют более сложный набор полимеров, и интерпретация полученных результатов бывает затруднительна.
1.4.2.1. Условия проведения реакции белков с бифункциональными реагентами. При взаимодействии белков с бифункциональными реагентами могут меняться pH среды, расстояние между функциональными группами реагента, концентрация реагента и белка.
Влияние pH среды. Бисиминоэфиры взаимодействуют с е-аминогруппами остатков лизина (рKа 9,5—10) и а-аминогруппой N-концевой аминокислоты при рН>8, т. е. с аминогруппами, находящимися в непротонированной форме. Продукты этих реакций — амидины с рKа>11, поэтому в области рН<8 модифицированный белок сохраняет положительный заряд. В области рН≤8 возможны побочные реакции [132, 165], в то время как выход амидинов достигает максимума при рН≥10. В этих условиях многие олигомеры диссоциируют, поэтому реакцию рекомендуется проводить в диапазоне pH 8—10. Если олигомер устойчив при высоких pH хотя бы в течение 1—2 мин, то, поскольку реакция идет с высокой скоростью, вполне возможно проводить модификацию в этой среде. Вообще говоря, имеет смысл изучать роль pH среды, исследуя состав продуктов реакции [162, 171].
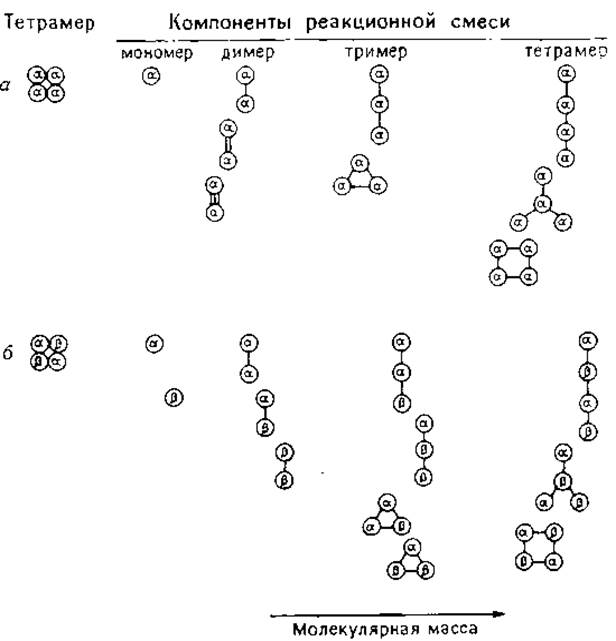
РИС. 1.6. Состав смеси полученной при частичном сшивании бифункциональными реагентами тетрамеров а4 и a2β2
Расстояние между функциональными группами реагента. Расстояние между функциональными группами выбранного реагента определяется расположением аминогрупп в нативном олигомере. Известные бифункциональные реагенты — диметиловые эфиры двухосновных иминокарбоновых кислот — имеют следующие параметры [45, 132]:
|
Кислота |
Расстояние между функциональными группами, нм |
|
Иминомалоновая |
0,5 |
|
Иминоянтарная |
0,6 |
|
Иминоадипиновая |
0,9 |
|
Иминопробковая |
1,1 |
|
Иминододецнловая |
1,5 |
При работе с одним реагентом можно прийти к неоднозначным или даже ошибочным выводам. Лучше всего проводить исследования с несколькими реагентами — членами одного гомологического ряда.
Концентрация бифункционального реагента. От концентрации бифункционального реагента непосредственным образом зависли степень сшивки олигомера, иными словами, чем выше концентрация, тем выше степень сшивки. Однако отмечено [132], что избыток сшивающего реагента по отношению к количеству олигомера не оказывает существенного влияния на скорость реакции, а чрезмерный избыток, по-видимому, вызывает протекание нежелательных побочных реакций. Если, увеличивая концентрацию реагента, не удается повысить степень сшивки олигомера до желаемого значения, это может свидетельствовать о преимущественном образовании внутримолекулярных поперечных связей.
Концентрация белка. Во избежание полимеризации олигомеров концентрация белка в реакционной смеси должна быть низкой. Если известна молекулярная масса олигомера, то признаком образования межмолекулярных (между молекулами олигомера) связен будет присутствие в смеси компонентов с молекулярной массой, превышающей М олигомера. Воспрепятствовать образованию поперечных связей (сшивок) олигомеров можно с помощью предварительной иммобилизации белка на нерастворимой матрице [135], например благодаря образованию дисульфидной связи с тиольными группами сефарозы 4В (разд. 3.2.5); далее можно провести обработку бисиминоэфирами [32].
1.4.2.2. Методики.
Получение бисиминоэфиров [108]. Диметиловые эфиры иминоадипиновой и иминопробковой кислот поставляются в качестве продажных реактивов. Остальные бисиминоэфиры могут быть синтезированы из доступных динитрилов по типовой методике [108].
Растворяют 0,5 г нитрила пробковой кислоты в смеси 2 мл метанола (высушенного с помощью молекулярного сита) и 15 мл этилового эфира при 0°С. Через раствор в течение 30 мин пропускают сухой НСl и выдерживают реакционную смесь при 4 °С в течение 24 ч. Прибавляют 10 мл сухого диэтилового эфира, выпавшие кристаллы тщательно промывают сухой смесью метанол — эфир (1:3) без доступа влаги. Полученный гидрохлорид бисиминоэфира (выход 0,81 г, 81%) используется без дополнительной перекристаллизации.
Получение амидинированных белков [44]. Образец белка растворяют (до концентрации 0,5 мг/мл) или тщательно диализуют против буферного раствора состава: 0,2 М триэтаноламин+НСl (pH 8,5). Непосредственно перед проведением реакции растворяют гидрохлорид бисиминоэфира в том же буфере (концентрация 10 мг/мл) и с помощью NaOH устанавливают pH 8,5. Рассчитанное количество раствора реагента прибавляют к раствору белка (так, чтобы концентрация реагента в реакционной смеси составила 1 мг/мл) и выдерживают реакционную смесь при 20°С в течение 3 ч. Если реагент необходимо прибавлять порциями, то вторую порцию вносят спустя 30 мин после начала реакции.
При поиске оптимальных условий проведения реакции концентрацию белка варьируют в интервале 0,1—5,0 мг/мл, а концентрацию бисиминоэфира в реакционной смеси — 0,2—5 мг/мл. Величину pH буферного раствора можно варьировать от 8 до 10,5. При pH 8—8,5 используют 0,2 М триэтаноламин — НСl, при рН>8,5 — 0,2 М боратный буфер. Для повышения буферной емкости (сохранения pH при добавлении реагентов) используют довольно концентрированные буферные растворы, которые не должны содержать первичных аминов.
Спустя три часа избыток реагента полностью гидролизуется. При определении кинетики реакции отбирают аликвотные пробы, а реакцию прерывают, добавляя двукратный избыток (по отношению к реагенту) гидроксиламина.
Электрофорез в ПААГ — ДСН. Продукты реакции исследуют с помощью электрофореза в ПААГ-ДСН (разд. 1.3.1.1) или с помощью гель-фильтрации и ультрацентрифугирования в присутствии денатурирующих агентов. Поскольку, по всей вероятности, поперечно-сшитые продукты будут иметь М>100 000, готовят 5%-ный гель, а образец наносят в количестве 50 мкг. В случае простых олигомеров, содержащих идентичные или почти идентичные мономеры, состав определяют по количеству основных зон. Если степень сшивки невелика, молекулярные массы гибридных молекул, кратные молекулярной массе мономера, можно найти по градуировочному графику. Высокое содержание поперечных связей может быть причиной аномального поведения полимеров при электрофорезе.
Если концентрация белка в образце достаточно высока, пробу наносят (в случае использования ступенчатой системы) без предварительного диализа. Возможно, что образец будет необходимо сконцентрировать, лучше всего это сделать путем осаждения трихлороуксусной кислотой. Осадок растворяют в буфере для образца (раздел 1.3.1.1).
1.4.2.3. Ограничение возможностей метода. С помощью сшивания бифункциональными реагентами был изучен ряд олигомерных белков известного состава. В принципе метод может применяться в отношении любого олигомерного белка, однако иногда таким путем не удается получить необходимой информации. Образование поперечных связей может не идти из-за недостатка аминогрупп, их неудачного расположения, наличия защитных группировок. Неудача может быть обусловлена качеством реагента, например недостаточной длиной углеводородной цепочки и присутствием в качестве примеси монофункционального производного.
Некоторые олигомерные белки не образуют гибридных молекул по неизвестной причине [82], правда, в отдельных случаях отсутствие связывания мономеров является отражением неблагоприятной локальной геометрии полипептидной цепи [135]. На основании подобного рода отрицательных результатов не следует делать категорических выводов [132].
На диссоциацию и сборку олигомерного белка может оказывать влияние pH среды, и этот фактор может быть причиной получения недостаточно четких данных. Замечено [171], что в некоторых случаях конформация мономера может в такой степени зависеть от pH среды, что реакция со сшивающими агентами вообще не идет.
Область применения метода ограничена олигомерами с молекулярной массой не более 500 000, поскольку эта величина является верхним пределом разрешения с помощью электрофореза в ПААГ-ДСН.