Практическая химия белка - А. Дарбре 1989
Аналитические методы
Колоночная хроматография аминокислот
Колонки и буферы
Сульфированный полистирол, сшитый с дивинилбензолом, впервые использован Муром и Стейном в ионообменной хроматографии аминокислот [263—267, 348] и до настоящего времени широко применяется в лабораторной практике [347].
Аминокислоты в катионной форме при низком pH связываются с отрицательно заряженными сульфогруппами носителя. С повышением pH элюирующего буфера (обычно цитрата натрия) уменьшаются положительные заряды аминокислот и тем самым силы взаимодействия со смолой, что приводит к их последовательному элюированию с колонки. Определяет очередность выхода аминокислот с колонки pH элюирующего буфера. Но катионы Na+ в буфере конкурируют за центры связывания с сульфогруппами и, хотя аминокислоты имеют более сильное сродство к смоле, они постепенно замещаются ионами натрия вследствие более высокой концентрации последних в среде. Природа боковой цепи также влияет на порядок элюирования, например тирозин (рKa = 9,1), содержащий ароматический радикал, элюируется после лейцина (рKa = 9,7). В двухколоночном методе первая колонка (0,9X120 см) с амберлитом IR-120 служит для разделения кислых и нейтральных аминокислот с помощью двух элюентов: 1) 0,2 М Na++0,1 М цитратный буфер (pH 3,25); 2) 0,2 М Na++0,1 М цитратный буфер (pH 2,25). Вторая колонка (0,9x15 см) используется для анализа основных аминокислот; состав элюента: 0,35 М Na++0,12 М цитрат (pH 5,28). В работе [357] эти результаты критически обсуждаются.
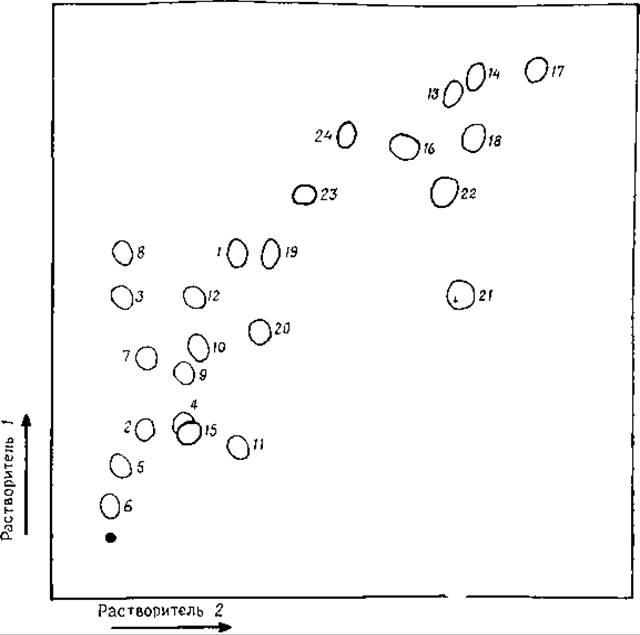
РИС. 8.3. Двумерная тонкослойная хроматография аминокислот на пластинках с целлюлозой. Состав растворителей указан в тексте.
1 — Ala, 2 — Arg, 3 — Asp, 4 — Asn, 5 — Cys, 6 — Cys-Cys, 7—Cya, 8 — Glu, 9 — Gin, 10 — Gly, 11 — His, 12 — Hyp, 13 — Ile, 14 — Leu, 15 — Lys, 16 — Met, 17— Nie, 18 — Phe, 19 — Pro, 20 — Ser, 21 — Thr, 22 — Trp, 23 — Tyr, 24 — Val [147] (c разрешения авторов).
Осуществить двухколоночную систему сложно чисто технически; кроме того, она не удовлетворяет и современным требованиям, поскольку в два раза увеличивается расход материала и соответственно возрастает вероятность ошибок.
Некоторые затруднения при количественной оценке результатов возникают при больших различиях в концентрациях компонентов смесей, когда часть пиков аминокислот находится в пределах шкалы измерений, а другая выходит за нее и не может быть корректно рассчитана. В таком случае повторяют анализ с меньшим количеством образца, а окончательные результаты выводятся из суммы двух определений. Проблему такого рода можно решить, записывая кривую элюирования одновременно при высокой и низкой чувствительности детектора или применяя линейно-логарифмическое преобразование электрического сигнала с выводом на диаграммную ленту самописца или интегратора, что позволяет определить площадь всех пиков.
Разработано много различных буферных смесей для разделения всех аминокислот в однократном процессе па одной колонке. В программы включались по три или даже четыре дискретных изменения буферных систем. Их не трудно установить и проконтролировать, но при смене буфера всегда наблюдается повышение базовой линии, вызванное хроматографическим смещением примесных пиков и небольшими изменениями коэффициентов преломления растворов [10].
Непрерывные буферные градиенты [297] менее популярны из-за трудности точного воспроизводства, однако с введением современной техники ВЭЖХ проблемы, связанные с созданием непрерывных буферных градиентов и точной подачей на колонку малых объемов растворов, в значительной степени преодолены. В 1972 г. описана система [18] с тремя буферными растворами, имеющими pH 3,25, 3,50 и 3,65 с повышающейся концентрацией ионов натрия (0,02, 0,70 и 1,60 моль/л). В этих условиях могут возникнуть осложнения только из-за расширения или сжатия упаковки колонки при изменении молярности элюента. Одновременно появилось сообщение [141] о системе из четырех буферов с постоянным содержанием Na+(0,20 моль/л) pH — 3,25, 4,15, 5,25 и 10.10.
Возможность работы на самой высокой из возможных чувствительности определяется необходимостью отсутствия «фоновых шумов» на ленте самописца благодаря применению растворителей и реагентов высокой степени чистоты (разд. 8.3).
Тест на чистоту буферов. Для приготовления натрийцитратного буфера растворяют 20 мг Na3C6H5CО7∙2H2O в 1 мл воды (концентрация Na+ ∼0,2 М) и добавляют 40 мкл «чистой» 1 М НСl до pH 2,0. Вводят 100 мкл этого раствора в ионообменную колонку и сравнивают хроматограмму с полученными данными для воды и соляной кислоты [142].
Для нахождения оптимальных условий разделения можно менять pH, молярность, скорость потока буфера и температуру колонки. Буферы должны быть приготовлены на воде и из реагентов высокой степени чистоты. Значения pH устанавливают с точностью 0,001 ед. и растворы буферов хранят под азотом. Обычно вводят в первый буфер (pH 3,25) ∼2% (по массе) изопропилового или этилового спирта для улучшения разделения Thr и Ser. Коммерческие приборы снабжены полной технической документацией для их эксплуатации, но каждый работающий оператор, конечно, должен сделать свою корректировку программы анализа методом проб и ошибок.
На рис. 8.4 и 8.5 приведены кривые элюирования аминокислот, полученные с помощью анализатора фирмы Beckman.
Замечание к рис. 8.4: повышение базовой линии происходит при введении нового буфера на колонку после 42 и 56 мин. На рис. 8.5 приведены результаты разделения (при высокой чувствительности) гидролизата гликопротеина, содержащего глюкозамин и галактозамин (указаны). С обзорами по аминокислотному анализу можно познакомиться в статьях [19, 20, 28, 138, 139, 142, 300J.
Для лучшего разделения многокомпонентных смесей нингидринположительных соединений плазмы и других биологических жидкостей было предложено использовать при ионообменной хроматографии литийцитратные буферы [264]. Хроматография в одноколоночном варианте применена для разделения 65 соединений за 20 ч [296]. На двухколоночной системе удалось разделить 41 соединение за 7,5 ч [18] и 55 соединений за 9,5 ч [270].