Практическая химия белка - А. Дарбре 1989
Определение состава белковых олигомеров. Получение мономеров и полипептидных цепей
Сшивание олигомера и мономера
Другие типы поперечных связей в белках
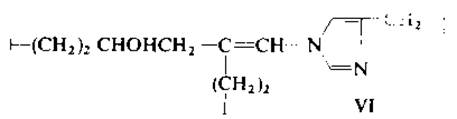
В белках встречаются иные типы межмолекулярных связен, с трудом поддающиеся анализу и специфическому расщеплению. Это альдиминная связь (I) в коллагене [172], десмозин (II) и изодесмозин в эластине (могут связывать 4 полипептидные цепи) [67], изопептидные связи между ε-аминогруппой лизина и амидной группой глутамина (ІІІ) в экстрацеллюлярных структурных белках [10, 117] и, по-видимому, ди- (IV) и тритирозины [109].

1.5.2.1. Альдимины. На первой стадии образования межмолекулярных связей в коллагенах происходит окислительное дезаминирование N- и С-концевых остатков лизина и гидроксилизина под действием фермента лизилоксидазы, представляющего собой медьсодержащий металлопротеин. Образующиеся альдегиды аллизин (СН2)3СНО и гидроксиаллизин ![]() вступают в реакцию конденсации в основном с ε-аминогруппами гидроксилизина с образованием дегидрогидроксилизилнорлейцина (І) или дегидродигидроксилизилиорлейцина. Альдимины восстанавливаются по двойным связям с помощью борогидрида калия, в результате чего поперечная связь приобретает устойчивость к кислотному гидролизу. Однако дигидроксипроизводное лабильно и перегруппировывается в кетоимин гидроксилизил-5-кетонорлейцин (V) [103]. После щелочного гидролиза коллагена, восстановленного борогидридом, выделены и охарактеризованы галактозид- и глюкогалактозилпроизводные этих фрагментов [145].
вступают в реакцию конденсации в основном с ε-аминогруппами гидроксилизина с образованием дегидрогидроксилизилнорлейцина (І) или дегидродигидроксилизилиорлейцина. Альдимины восстанавливаются по двойным связям с помощью борогидрида калия, в результате чего поперечная связь приобретает устойчивость к кислотному гидролизу. Однако дигидроксипроизводное лабильно и перегруппировывается в кетоимин гидроксилизил-5-кетонорлейцин (V) [103]. После щелочного гидролиза коллагена, восстановленного борогидридом, выделены и охарактеризованы галактозид- и глюкогалактозилпроизводные этих фрагментов [145].

Обычно с целью идентификации альдиминный фрагмент коллагена вначале стабилизируют путем восстановления (главным образом цианоборогидридом натрия) [147], затем проводят ферментативный гидролиз и выделяют сшитые между собой пептиды. Эти фрагменты несложно идентифицировать, если использовать восстанавливающий агент, содержащий тритиевую метку. После восстановления и кислотного гидролиза коллагенов (из разных тканей) были выделены и идентифицированы гидроксилизилнорлейцин, дигидроксилизилнорлейцин, гидроксимеродесмозин, гидроксиальдольгистидин и гистидилгидроксимеродесмозин [172]. Кроме того, был получен и идеитифицирован гидроксиальдольгистидин (IV) (образующийся из аллизина, гидроксиаллизина и гистидина), который не восстанавливается борогидридом, но устойчив к кислотному гидролизу [81].
Однако еще не решен вопрос, соответствуют ли эти соединения (и ряд других) фрагментам с поперечными связями в нативных белках (и если да, то насколько) или это артефакты и каким образом альдимины превращаются в устойчивые к восстановлению фрагменты в процессе старения организма [103].
Расщепление альдимина [58]. В желатине поперечные святи расщепляются под действием ß-аминопропионитрила. ß-Аминопропионитрил нейтрализуют ледяной уксусной кислотой, добавляют буферный раствор, желатину, с помощью уксусной кислоты устанавливают pH 7,6 (в реакционной смеси
![]()
содержится желатины 1—2 мг/мл, ß-аминопропионитрила 1,9 моль/л, уксусной кислоты 1,3 моль/л, трис 1,6 ммоль/л, МgСl2 0,8 ммоль/л), добавляют несколько капель толуола, пробирку закрывают и смесь инкубируют при 38 °С в течение 48 ч.
Восстановление цианоборогидридом натрия [74]. Образец диализуют против 0,1 М натрий фосфатного буфера (pH 4,4) в течение 4 ч, добавляют цианоборогидрид натрия (белок : NaBН3CN = 30 : 1, по массе) и реакционную смесь инкубируют при комнатной температуре в течение 24 ч. Затем диализуют и высушивают лиофильно.
Восстановление [15С]цианидом натрия в аммиаке [130]. Этот метод специально разработан для идентификации поперечных связей в фибриллярных белках, поскольку в случае фибрина реакция восстановления борогидридом натрия (при pH 8) идет с низким выходом и плохо воспроизводима. Продукт реакции — аминонитрил или производное аминокислоты, отражающее строение альдимина. Продукты реакции устойчивы к кислотному гидролизу, легко отделяются от аминокислот и хорошо идентифицируются на аминокислотном анализаторе.
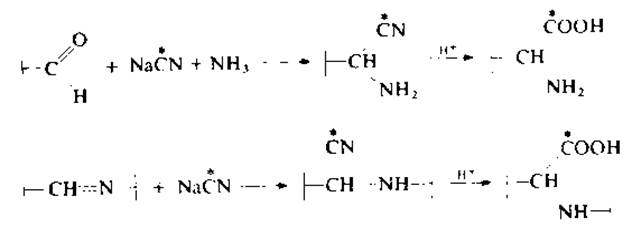
Тонко измельченный эластин (10 мг) суспендируют в воде (2 мл), добавляют 2 мг [14С]цианида натрия (удельная активность 1,1 мКи/мкмоль) и 2 мл 30%-ного аммиака. Затем реакционную смесь (pH 11,5) инкубируют при комнатной температуре в течение 1 ч, подкисляют до pH 1 и диализуют против 0,1 М HCl при 4 °С. При модификации альдиминов присутствие аммиака не обязательно. Если вместо аммиака использовать меченный тритием метиламин, полученный альдегид будет содержать двойную метку. Поскольку удельная активность Na14CN известна, выход можно оценить количественно. Этот метод введения радиоактивной метки неприменим в случае пиридиниевой формы десмозинов.
Расщепление поперечных связей периодатным методом [146]. После восстановления поперечные связи коллагена можно расщепить путем окисления периодатом при комнатной температуре в течение 5 мин. Затем с помощью борогидрида калия разрушают избыток перйодата, а продукты окисления восстанавливают до пролина и лизина, которые идентифицируют на аминокислотном анализаторе. Если восстанавливающий агент КВН4 содержит тритиевую метку 3Н, радиоактивная метка распределяется в соответствии с уравнением реакции;
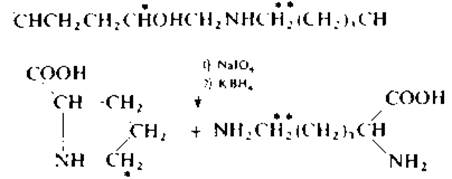
К восстановленному белку в 1 мл нитратного буфера (pH 5,3) добавляют 0,01 М NaІО4и выдерживают в темноте при комнатной температуре. Спустя 5 мин в реакционной смеси устанавливают с помощью 2 М NaOH pH 7,5 и добавляют КВН4 (2—5 мг). Инкубируют в течение 30 мин, а затем добавляют 6 М НСl до pH 2.
Выделение пептидов, соединенных поперечными связями [169]. Для выделения пептидов, соединенных поперечными связями, с успехом используют хроматографию на гидроксиапатите. По-видимому, пептиды, сшитые поперечными связями, сохраняют конформацию нативного белка и благодаря этому проявляют большее сродство к гидроксиапатиту. Нативный или восстановленный нерастворимый коллаген (из кожи или костей быка) расщепляют бромоцианом, смесь пептидов растворяют и дополнительно диализуют против стартового буфера (0,001 М Na2HPО4, pH 6,8+1 М мочевина+ 0,15 М NaCl) и затем наносят па колонку (1,5X23 см) с гидроксиапатитом (Hypatite С). Проводят элюирование в линейном градиенте фосфатного буфера (в смеситель помещают 450 мл стартового 0,001 М фосфатного буфера; в резервуар 450 мл 0,2 М Na2HPO4, pH 6,8, содержащего 1 М мочевины 0,15 М NaCl). После сбора 800 мл элюата элюирование продолжают в экспоненциальном градиенте. Для этого смеситель герметически соединяют с делительной воронкой, содержащей 450 мл более концентрированного буфера (0,8 М Na2HPO4, pH 6,8+1 М мочевина+0,15 М NaCl). Элюат собирают по фракциям (объем 5,5 мл), скорость элюирования 60 мл/ч. Фракции, содержащие сшитые пептиды, объединяют, обессоливают диализом против воды и высушивают лиофильно. При восстановлении с помощью NaB3H4 гидролизата коллагена из костей быка были получены две главные и одна минорная фракции. Материал второй главной фракции имел максимальную молекулярную массу, характеризовался высокой степенью cпирализации и действительно содержал сшитые пептиды.
1.5.2.2. Десмозины. Для идентификации десмозина эластин восстанавливают NaBD4 в воде или D2О, аминокислоты разделяют хроматографически или переводят в N-трифтороацетилметиловые эфиры и анализируют масс-спектрометрически [129].
1.5.2.3. Изопептиды. Наиболее известным изопептидным фрагментом, связывающим полипептидные цепи в белках, является Nε-(у-глутамил) лизин [107, 117]. После полного ферментативного гидролиза белка или смеси пептидов этот фрагмент можно идентифицировать с помощью аминокислотного анализа. На кривой элюирования ему соответствует пик в области изолейцина. Однако полное разрешение достигается лишь в особых условиях, например в буфере с pH 4,8. Относительно возможной роли Nε-(β-аспартил)лизина как сшивающего фрагмента см. работу [92].