Практическая химия белка - А. Дарбре 1989
Определение аминокислотной последовательности пептидов по методу Эдмана с идентификацией дансиламинокислот
Дансилирование
Введение дансильной метки в непротонированную а-аминогруппу пептида (рис. 11.1) проводят в щелочной среде в смешанном водно-органическом растворителе (органический компонент для растворения дансилхлорида). В этих условиях конкурируют два процесса — дансилирование и гидролиз дансилхлорида — и степень модификации пептида определяется соотношением скоростей протекания этих процессов. Гидролиз дансилхлорида катализируется пиридином [4], в то время как триэтиламин ускоряет и реакцию конденсации, и гидролиз, поэтому из среды рекомендуется полностью удалять соли пиридина (образующиеся после реакции Эдмана или элюирования пептидов с бумаги) тщательным высушиванием образца в присутствии триэтиламина. Таким же образом освобождаются от следовых количеств солей аммония (привносимых с соответствующими буферами), которые реагируют с дансилхлоридом с образованием дансиламида. Использование триэтиламина сопровождается образованием еще одного дансильного производного (возможно, из-за присутствия в триэтиламине первичных и вторичных аминов), но на полиамидных пластинках пятна этих соединении мигрируют в растворителе 2 выше дансилпролина (рис. 11.2).
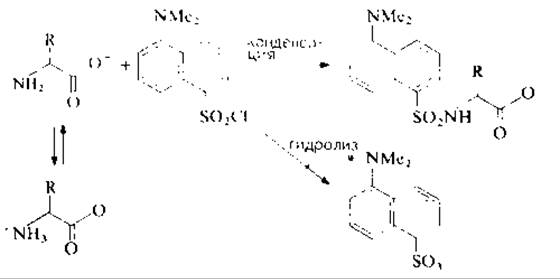
РИС. 11.1. Дансилирование аминокислоты и конкурирующий гидролиз дансилхлорида до дансиловой кислоты.
Модифицированные пептиды гидролизуют 6 М HCl при 100°С (5—15 ч) или смесью равных объемов конц. НСl и пропионовой кислоты при 165°С (12 мин) (G. Winter, неопубликованные данные). При гидролизе под действием 6 М НСl в течение 5 ч минимальны потери дансилпролина и дансилсерина, по не полностью расщепляются пептидные связи остатков дансилвалина и дансилизолейцина с другими аминокислотами (особенно с валином и изолейцином). Образующиеся при этом дансилдипептиды на хроматограмме могут быть ошибочно приняты за дансиламинокислоты. Положения пятен некоторых из таких производных показаны на рис. 11.2.
На хроматограмме дапсилдипептиды располагаются приблизительно на линии, соединяющей положения дансильных производных, входящих в состав дипептида аминокислот. Правильность идентификации аномального пятна как дансильного производного дипептида может быть проверена с помощью более продолжительного гидролиза (>24 ч). При гидролизе смесью HCl — пропионовая кислота возрастают степень расщепления дансилпролина и дансилсерина и вероятность обнаружения на хроматограмме дансилдипептидов, однако при этом практически не происходит окисления дансилметионина, как при гидролизе в 6 М HCl (G. Winter, неопубликованные данные).
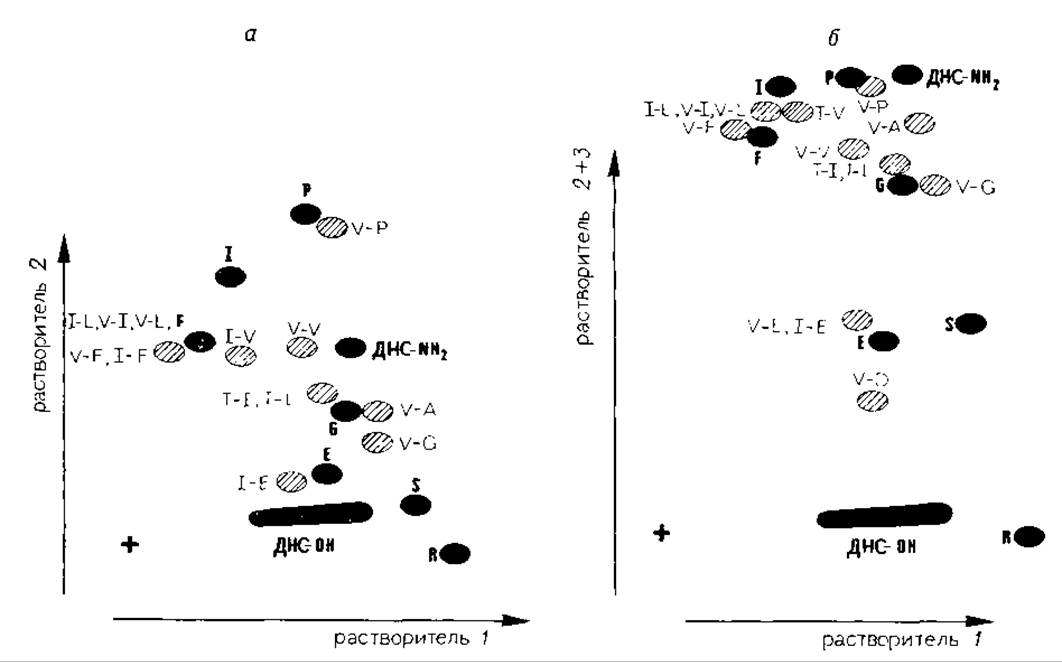
РИС. 11.2. Ориентировочное расположение пятен некоторых дансилдипептидов (заштрихованные пятна) относительно пятен ДНС-аминокисломаркеров (темные пятна). Обозначения аминокислот даны в однобуквенном коде, а — после растворителей 1 и 2; б — после растворителей 1, 2 и 3. ДНС∙ОН — дансиловая кислота, ДНС∙NHO—амид дансиловой кислоты.
Деструкция дансилтриптофана в условиях кислотного гидролиза может быть сведена к минимуму добавлением к 6 М НСl 1 % триптамина; дансилтриптофан может быть отщеплен также с помощью химотрипсина, однако это применимо лишь в частных случаях и требует для идентификации до 5 нмоля вещества. Различия между амидными и карбоксильными группами боковых цепей могут быть установлены электрофоретическим анализом пептида при pH 6,5 до и после отщепления по Эдману остатков Asx и Glx.