Практическая химия белка - А. Дарбре 1989
Фрагментация полипептидов химическими методами
Расщепление дисульфидных связей
Восстановление и S-карбоксиметилирование
Остатки цистина могут образовывать как внутри-, так и межцепочечные связи. Поэтому при секвенировании обязательным этапом является расщепление дисульфидных связей в первую очередь с целью разделения полипептидных цепей. В то же время дисульфидные связи имеют высокую реакционную способность, и это обстоятельство может вызвать осложнение при структурном анализе. Поэтому при расщеплении S—S-групп остатки цистеина необходимо перевести в стабильные производные. Наконец, после восстановления остатков цистеина белки становятся более доступными действию протеолитических ферментов. Способы расщепления дисульфидных связей рассматриваются в гл. 4. По этому вопросу имеется также ряд обзоров [26, 59, 98, 116]. В настоящую главу включены только те методики, которые нашли практическое применение.
К наиболее избирательным и практичным методам расщепления S—S-связей относится восстановление. Типовая методика заключается в обработке белка избытком низкомолекулярного тиола [уравнение (2.1)]. В качестве тиолов используют цистеин, восстановленный глутатион, 2-меркаптоэтиламин, тиогликолевую кислоту, 2-меркаптоэтанол [78—80, 203] и дитиотреит (ДТТ) [29]. Восстановление проводят в атмосфере инертного газа в слабощелочной среде в присутствии 8 М мочевины или 6 М гуанидин-HCl. Следует напомнить, что при длительном хранении в растворах мочевины идет образование цианат-ионов, которые вызывают модификацию белков [182]. Рекомендуется использовать предварительно перекристаллизованные препараты мочевины, свежеприготовленный раствор следует деионизировать на смешанном ионите.
![]()
После удаления восстановителя тиольные группы легко окисляются кислородом воздуха с замыканием S—S-связей. Поэтому для защиты SH-групп используют разнообразные группировки, получая устойчивые производные цистеина непосредственно в реакционной смеси, в которой проводилось восстановление. В качестве SH-реагента наиболее часто используется иодоуксусная кислота. Остатки цистеина переводятся при этом в S-карбоксиметилцистеин, который вполне устойчив при последующих операциях, включая секвенирование. Степень модификации определяют по данным аминокислотного анализа, используя устойчивость S-карбоксиметилцистеина в условиях кислотного гидролиза. При этом одновременно определяют возможные потери других аминокислот (метионина, тирозина, гистидина) в результате побочных реакций [71].
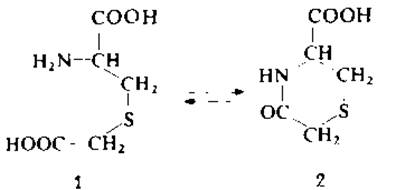
Показано, что в кислой среде S-карбоксиметилцистеин (1) может подвергаться внутримолекулярной циклизации с образованием замещенного тиазина (2), который невозможно обнаружить с помощью аминокислотного анализа из-за потери аминогруппы [15]. Скорость этой реакции зависит от температуры и pH. Оптимальные условия циклизации соответствуют pH 3,0 (цитратный буфер) и температуре 110°С, в то время как в обычных условиях кислотного гидролиза (6М НСl, 110 °С, 22 ч) S-карбоксиметилцистеин вполне устойчив. С целью исключить возможность потери S-карбоксиметилцистеина в результате циклизации рекомендуется алкилировать SH-группы 3-бромопропионовой кислотой [15].
Типовая методика восстановления дисульфидных связей рибонуклеазы 2-меркаптоэтанолом и последующего карбоксиметилирования приведена в работах [3, 35, 102]. В настоящее время наиболее широкое применение в качестве восстановителя находит дитиотреит (3) [106]. (Этот реагент — реактив Клеланда — был впервые применен для восстановления дисульфидов Клеландом [29].)

Реакция идет, согласно уравнениям (2.2) и (2.3), почти количественно благодаря образованию более энергетически выгодного по сравнению с дисульфидами смешанного типа шестичленного цикла (5). При pH 7 и 25 °С окислительно-восстановительный потенциал дитиотреита составляет —0,33 В (для цистеина —0,22 В); отсюда константа суммарной реакции восстановления цистеина с помощью дитиотреита равна 104. Благодаря более низкому окислительно-восстановительному потенциалу и устойчивости к действию кислорода воздуха дитиотреит можно вводить в реакции в гораздо меньших концентрациях по сравнению с другими тиолами. Дополнительное преимущество использования дитиотреита связано с почти полным отсутствием у него неприятного запаха.
2.2.1.1. Восстановление и S-карбоксиметилирование. Методика [200]. Раствор белка (10—20 мг/мл) в 0,2—0,5 М трис-НСl-буфере (pH 8,0), содержащем 6 М гуанидин-HCl и 2 мМ ЭДТА, в пробирке из полипропилена продувают азотом, плотно закрывают и инкубируют при 37—50 °С в течение 30 мин. Затем добавляют 50-кратный молярный избыток (в расчете на S—S-группу) ДТТ, а если количество S—S-связей неизвестно — 300 моль/моль белка, продувают азотом и инкубируют при 37 °С в течение 4 ч.
Реакционную смесь охлаждают до 0 °С, добавляют небольшой избыток (в расчете на SH-группу) перекристаллизованной иодоуксусной кислоты или иодоацетамида и инкубируют без доступа света. В процессе реакции в среде поддерживают pH 8,0. Спустя 1 ч избыток реагента нейтрализуют с помощью 2-меркаптоэтанола и раствор диализуют при щелочном pH и пониженной температуре. Указанные условия диализа препятствуют модификации метионина, которая вполне возможна, если вести диализ против кислотного буфера. С целью обессоливания можно проводить гель-фильтрацию в подходящем буфере (на сефадексе G-10 или биогеле Р-10 в 0,01 м NH4HCO3).
2.2.1.2. Восстановление трибутилфосфином. Эффективным и избирательным восстановителем дисульфидных связей в кератине (шерсти) является трибутилфосфин [119]. При исследовании восстановления белков известного строения было показано [152], что реакция идет стехиометрически согласно уравнению:
R1SSR2 + Bu3P + H2O → R1SH +Bu3PO (2.4)
При этом избыток восстановителя в расчете на S—S-группы составил 5—20%. В щелочной среде реакция идет с высокой скоростью, избирательно, почти количественно. Алкилирование образующихся SH-гpyпп можно вести в присутствии восстановителя. В кислой среде реакция идет с низкой скоростью (время реакции 24—48 ч). Гомогенность среды создают добавлением 1-пропанола (до соотношения 1:1), что дополнительно способствует солюбилизации белка. Трибутилфосфин токсичен и имеет неприятный запах, работать с ним необходимо в вытяжном шкафу. Реагент и приготовленные растворы рекомендуется хранить под азотом, 2%-ный (об./об.) раствор в пропаноле имеет восстановительный эквивалент 55—70 мкмоль/мл.
Методика, предложенная в работе [152]. Бычью панкреатическую рибонуклеазу (64 мг, 5 мкмоль) растворяют в 7,5 мл 7 М мочевины в 0,1 М трис-НСl (pH 8,2), содержащем 1-пропанол (2:1). При перемешивании в атмосфере азота добавляют 50 мкл (130—180 мкмоль, 6—9-кратный избыток) трибутилфосфина. Спустя 2 ч добавляют 140 мкл 1 М иодоацетата (1 М иодоуксусной кислоты в 1 М NaOH, 3,5-кратный избыток в расчете на SH-группы) и инкубируют без доступа света. Спустя 5 мин доводят pH до 8,2 с помощью 1 М Nа2СO3; спустя 30 мин добавляют 0,5 мл ледяной уксусной кислоты и высушивают лиофильно.
Дисульфидные связи можно восстанавливать с помощью других реагентов; однако эти методы не находят применения в аналитической химии белка. Например, восстановление борогидридом натрия (при pH 7—10) сопровождается расщеплением пептидных связей [35]; при реакции с дибораном идет восстановление карбоксильных групп (в виде карбоксилат-иона) в гидроксильные [5, 6]. В принципе диборанами можно восстанавливать белки с непротонированными карбоксильными группами. Редко в химии белка применяется электролитическое восстановление на ртутном капельном электроде [27, 111].