Практическая химия белка - А. Дарбре 1989
Фрагментация полипептидов химическими методами
Расщепление дисульфидных связей
Другие защитные группы (по SH-гpyппe)
Защитные группы должны удовлетворять разнообразным требованиям. В частности, защитная группа должна обеспечивать высокую растворимость модифицированного белка, нести хромофорную или флуоресцирующую группу или превращать модифицированный цистеин в потенциальный субстрат трипсина, наконец реакция модификации должна быть по возможности обратимой. В принципе сульфгидрильные группы, как наиболее реакционноспособные группы в белках, легко вступают в реакции алкилирования, арилирования, образуют комплексы с солями тяжелых металлов [59, 98, 104, 193].
2.2.2.1. Алкилирование с помощью этиленимина. S-Аминоэтилцистеин — положительно заряженное производное цистеина — получают по реакции с этиленимином согласно уравнению (2.5) [114, 145, 146]. С помощью этой реакции в полипептидной цепи создают аналог лизина — хорошую мишень для атаки трипсином. Однако протеолиз в этом случае идет с более низкой скоростью по сравнению с гидролизом по остаткам лизина и аргинина [32]. Алкилирование с помощью этиленимина сопровождается рядом побочных реакций, в частности может идти алкилирование метионина [166] или а-аминогруппы N-концевой аминокислоты [174]. При проведении реакции в течение длительного времени или в присутствии большого избытка реагента вероятность побочных реакций существенно возрастает. При аминокислотном анализе S-аминоэтилцистеин элюируется в области основных аминокислот [166].
![]()
Восстановление трибутилфосфином и алкилирование этиленимином.
Методика L Растворяют белок (2—10 мг/мл) в смеси 0,5 М NaHCО3 — н-пропанол (1 : 1), устанавливают pH 8,0—8,3 и при перемешивании под азотом добавляют трибутилфосфин (1—5 мкмоль/мг белка) и этиленимин (4—40 мкмоль/мг белка); инкубируют в течение 2—4 ч.
Методика 2 [185]. Белок (25 мг у-глобулина) растворяют в 5 мл свежеприготовленного раствора 8 М мочевины или 6 М гуанидин-HCl в 1 М трис-НСl-буфере (pH 8,9), содержащем 75 мкл 2-меркаптоэтанола. Инкубируют в атмосфере азота при 20 °С в течение 2 ч. Затем добавляют 150 мкл этиленимина и инкубируют в течение 2 ч. Реакционную смесь диализуют против 100 объемов 1-%ного NH4HCO3, затем против дистиллированной воды и высушивают лиофильно.
Методика 1. Алкилирование с помощью 4-винилпиридина [92]. Навеску белка (300—500 мг) растворяют под азотом в 20—30 мл трис-НСl-буфера (pH 7,5), содержащего 8 М мочевину, добавляют 4-винилпиридин (20 молей на 1 «мол.» SH-группы) и инкубируют при перемешивании в течение 2—3 ч. Затем подкисляют ледяной уксусной кислотой до pH 3, диализуют против 0,01 М уксусной кислоты и высушивают лиофильно.
2.2.2.2. Алкилирование с помощью 4-винилпиридина [25, 60]. Реакция идет согласно уравнению (2.6). С помощью 4-винилпиридина в полипептидную цепь вводят полярную группировку, которая повышает растворимость белка и способствует его последующей очистке. Модифицированный остаток цистеина устойчив в условиях кислотного гидролиза, имеет характерное поглощение при 260 нм, его ФТГ-производное легко идентифицируется при секвенировании [75].
![]()
Методика 1. Алкилирование с помощью 4-винилпиридина [92]. Навеску белка (300—500 мг) растворяют под азотом в 20—30 мл трис-НСl-буфера (pH 7,5), содержащего 8 М мочевину, добавляют 4-винилпиридин (20 молей на 1 «моль» SH-группы) и инкубируют при перемешивании в течение 2—3 ч. Затем подкисляют ледяной уксусной кислотой до pH 3, диализуют против 0,01 М уксусной кислоты и высушивают лиофильно.
Методика 2. Восстановление дитиотреитом и алкирование 4-винилпиридином [75]. Свиной трипсин (20 мг) растворяют в 1 мл буфера следующего состава (pH 7,6): 0,13 М трис-НСl+6 М гуанидин-HСl+0,1 мг ЭДТА. Прибавляют ДТТ (20 молей на 1 «моль» S—S-группы), инкубируют при 20 °С, в течение 3 ч. Добавляют 4-винилипридин в количестве 3 моль/моль ДТТ, выкубируют в течение 90 мин. Реакционную смесь подкисляют 88%-ной муравьиной кислотой до pH 2,0 и фракционируют с помощью гель-фильтрации на сефадексе G-75 в 9%-ной муравьиной кислоте. Получают три фракции, соответствующие цепи ß-трипсина и двум фрагментам а-трипсина.
2.2.2.3. Другие SH-алкилирующие реагенты. С целью введения в полипептидную цепь заряженных группировок предложено алкилировать остатки цистеина 2-бромоэтансульфонатом (6) [129], 1,3-пропансультоном (7) [151, 153] и 2-бромоэтилтриметиламмонийбромидом (8) [94]. Поскольку эти группировки сохраняют заряд в широком диапазоне pH, полученные производные можно фракционировать с помощью электрофоретических методов.

Методика. Восстановление и модификация 1,3-пропансультоном [151]. Рибонуклеазу (64 мг, 5 мк/моль) растворяют в 7,5 мл буфера следующего состава: 0,1 М трис-НСl (pH 8,2)+н-пропанол (2: 1)+7 М мочевина; раствор деаэрируют и насыщают азотом. Затем прибавляют трибутилфосфин (22— 40 мк/моль, 1,1—2-кратный избыток) в виде 5%-ного раствора в пропаноле и 320 мкл (80 мкмоль) 250 мМ раствора 1,3-пропансультона в водном пропаноле (1:1), инкубируют при 20 °С в течение 16 ч. Реакционную смесь подкисляют уксусной кислотой, трижды диализуют при пониженной температуре против 0,1%-ной уксусной кислоты и высушивают лиофильно.
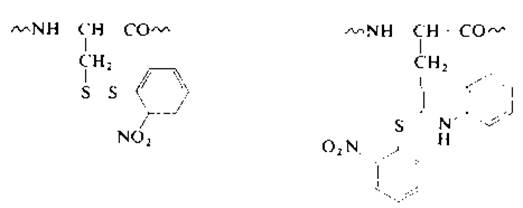
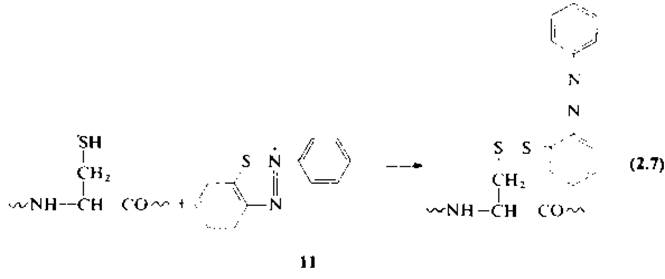
2.2.2.4. Обратимая защита тиольной группы. Иногда возникает необходимость обратимой защиты тиольной группы, т. е. введения защитной группы, которая впоследствии может быть удалена. Обратимую защиту остатков цистеина в белках осуществляют путем образования смешанных дисульфидов, которые легко расщепляются при восстановлении. К классу смешанных (несимметричных) дисульфидов относятся продукты реакции цистеина с арилсульфенил-галогенидами [46, 48]. 2-Нитрофенилсульфеиилхлорид реагирует в водной уксусной кислоте с остатком цистеина, образуя смешанный дисульфид (9), а также с остатком триптофана с образованием тиоэфира (10). Азобензол-2-сульфенилбромид взаимодействует с SH-группой, согласно уравнению (2.7), и не реагирует с триптофаном. Отсутствие реакции с индольным циклом триптофана объясняется особенностями строения иона 2-фенилбензо-1-тио-2,3-диазония (11).
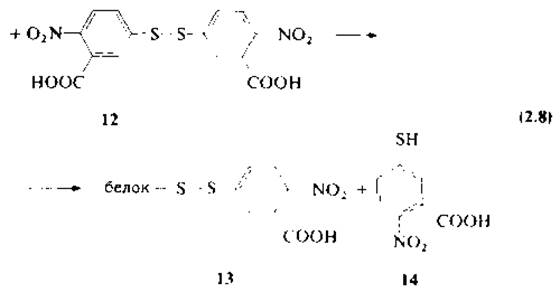
Смешанные алкиларилдисульфиды образуются при взаимодействии остатка цистеина с 5,5'-дитиобис(2-нитробензойной) кислотой (12) (ДТНБ), называемой реактивом Эллмана [43], согласно уравнению (2.8). ДТНБ имеет более высокий по сравнению с алифатическими дисульфидами окислительно-восстановительный потенциал, поэтому при взаимодействии с алифатическими тиолами идет реакция обмена с образованием смешанного дисульфида и окрашенного иона 2-нитро-5-тиобензоата (14). Реактив Эллмана находит широкое применение для количественного определения остатков цистеина в белках [72].
Показано, что алкилалкантиосульфонат как специфический реагент на SH-группы также образует смешанные дисульфиды согласно уравнению (2.9). Реакция идет с высокой скоростью в мягких условиях и не требует избытка реагента [104, 176]. К наиболее известным реагентам этого типа относится метилметантиолсульфонат, с помощью которого в тиолосодержащий белок вводят CH3S-гpyппy.
![]()