Практическая химия белка - А. Дарбре 1989
Определение С-концевой последовательности аминокислот
Определение С-концевых групп
Селективное введение трития
С-концевые аминокислоты пептидов или белков можно определить при помощи химических или ферментативных методов. Химические методы включают гидразинолиз, селективное введение трития, избирательное восстановление, образование альдегидов, алкоголиз оксазолов в кислой среде, тиоцианатное или цианамидное расщепление. При ферментативном определении используют карбоксипептидазы. Этот подход в последние годы получил более широкое применение благодаря увеличению числа коммерчески доступных ферментов микробного или растительного происхождения, которые к тому же имеют более широкую специфичность, чем ферменты поджелудочной железы. Расщепление под действием карбоксипептидазы, а также химическими методами обычно дает информацию о С-концевом остатке и С-концевой последовательности аминокислот. Новичкам настоятельно рекомендуется использовать ферментативные методы, если доступна высокочувствительная система детекции. Описана методика ВЭЖХ производных аминокислот с предколоночной модификацией аминокислот при помощи о-фталевого диальдегида (ОФА), что позволяет проводить высокочувствительный количественный С-концевой анализ [42].
Среди химических методов определения С-концевых аминокислот к простейшим относится селективное введение трития. Этот метод обладает высокой чувствительностью, проводится с использованием легко доступных реагентов, при очень мягких условиях. После введения тритиевой метки избыточные атомы 3Т удаляются путем повторения чередующихся операций добавления — упаривания воды. Затем проводят гидролиз 6 М соляной кислотой (метансульфоновой кислотой, если предполагается определение Тrр [78]); далее аминокислоты разделяют обычными методами пептидного картирования и определяют радиоактивность в жидкостном сцинтилляционном счетчике. Первоначально этот метод был качественным [57], однако в настоящее время возможно количественное определение трития.
Селективное введение трития включает три последовательные реакции (рис. 18.3). В основе методики лежит различие в химической активности карбоксилов С-концевой аминокислоты и боковых цепей. С-Концевой карбоксил уникален, так как его можно активировать путем образования оксазолинона (внутримолекулярное взаимодействие с соседней по цепи пептидной связью, происходящее с выделением воды) [69]. Эта реакция проходит при участии уксусного ангидрида. Образующийся при этом оксазолинон содержит активный атом водорода, который легко замещается на тритий при обработке 3Н2О в присутствии пиридина. Оксазолинон претерпевает катализируемую основанием рацемизацию, сопровождаемую гидролитическим раскрытием кольца и регенерацией С-концевой аминокислоты, содержащей атом трития при а-углероде.
Установлено, что водородно-тритиевый обмен происходит при асимметрическом атоме углерода аминокислоты в условиях рацемизации [58]. Поскольку из пептидного синтеза известно, что процесс рацемизации, происходящий в ходе синтеза, протекает через стадию образования промежуточного оксазолинона С-концевой аминокислоты, то предполагается, что получение таких оксазолинонов химическим путем может оказаться высокоспецифическим методом введения дейтерия (трития) в С-концевые аминокислоты полипептидов [58].
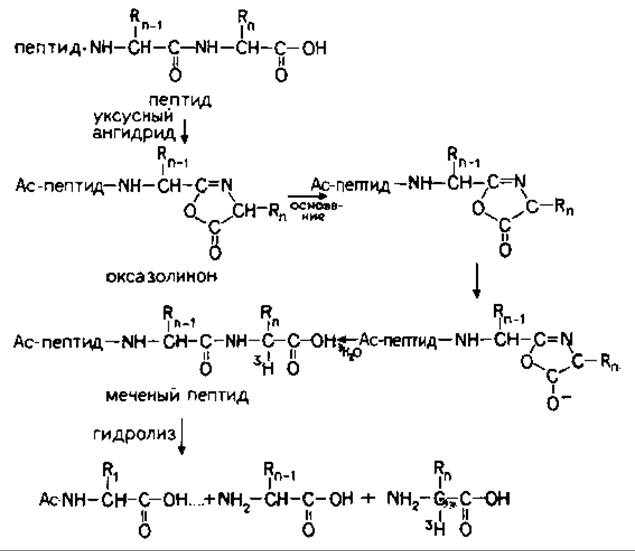
РИС. 18.3. Избирательное введение трития в С-концевую аминокислоту [57].
Исследовались три варианта избирательного мечения тритием. Исходная методика [59] включает две стадии: образование оксазолинона при нагревании пептида с карбодиимидом (дициклогексилкарбодиимидом, ДЦК) или уксусным ангидридом в безводном диоксане с последующим добавлением одной капли пиридина и 0,5 мл D2О для проведения катализируемой основанием рацемизации с гидролитическим раскрытием кольца. Было найдено, что в указанных условиях аминокислоты подвергались полному дейтерированию исключительно по а-углеродному атому.
Контроль дейтериевого обмена осуществляется с помощью ЯМР-спектроскопии; замена D2О на 3Н2О привела к разработке простого и чувствительного метода определения С-концевой аминокислоты.
Вторая методика была разработана для селективного введения трития в С-концевые остатки Pro и Asp [60]. В вышеуказанных условиях эти аминокислоты не образуют оксазолиноны, но дают либо смешанный ангидрид (Pro), либо циклический ангидрид (Asp). При обработке пиридином и 2Н2О эти ангидриды не включают метку, но их можно метить дейтерированной уксусной кислотой. Методика включения метки в Pro и Asp при помощи кислотного катализа была упрощена до одностадийной и заключалась в обработке пептида смесью уксусного ангидрида и 3Н2О.
Третий вариант был разработан для белков. Поскольку большинство белков нерастворимо в безводном диоксане, используемом при мечении пептидов, этот растворитель был заменен на смесь водного пиридина, 3Н2О и уксусного ангидрида. В такой системе три реакции проходят в одну стадию (рис. 18.3). Предполагается, что включение метки происходит с образованием промежуточного оксазолинона, находящегося в равновесии с исходным С-концевым пептидом.
При проверке всех трех методик выяснилось, что одностадийная методика с использованием основного катализа, разработанная для белков, дает наилучшие результаты и в случае пептидов [36]. Кроме того, было найдено, что в противоположность исходному двухстадийному варианту с использованием безводных растворителей одностадийный метод позволяет заменять водород на тритий в С-концевом остатке Asp (возможно, из-за того, что Asp не может образовывать циклический ангидрид в водной среде). Подробная методика приведена ниже.
18.3.1.1. Введение трития [60]. Образец (3—20 нмоль), помещенный в маленькую пробирку (13X100 мм), растворяют в 0,05 мл 3Н2О (50 мКи). Добавляют пиридин (0,1 мл) и уксусный ангидрид (0,025 мл), раствор оставляют при комнатной температуре на 3 ч. Растворители удаляют в вакууме при 40 °С. Легко обменивающийся тритий удаляют путем многократных операций добавления — упаривания воды (6X100 мкл). Меченый образец гидролизуют в той же пробирке 6 М соляной кислотой, содержащей 0,004 М тиогликолевую кислоту (в вакууме, при 108 °С, в течение 24 ч).
Для идентификации меченой С-концевой аминокислоты можно использовать любой вид хроматографии: бумажную, тонкослойную, газожидкостную, ионообменную, ВЭЖХ. Удобно использовать метод двумерного картирования на бумаге ватман 3 ММ, так как при этом можно одновременно анализировать несколько образцов. Сухой гидролизат растворяют в 50 мкл воды, добавляют 2 мкл смеси стандартных аминокислот (~5 нмоль каждой аминокислоты). Проводят высоковольтный электрофорез при pH 1,8 (3000 В, 45 мин). Часть хроматограммы (полоску шириной ~100 мм), содержащую частично разделенные аминокислоты, пришивают ко второму листу бумаги (200X200 мм) и проводят восходящую хроматографию (~3,5 ч) в системе н-бутанол — уксусная кислота — вода —пиридин (15:3: 12: 10). После проявления нингидрин-коллидиновым реагентом (разд. 8.14.2) вырезают пятна аминокислот и определяют на жидкостном сцинтиляционном счетчике их радиоактивность. На рис. 18.4 и в табл. 18.1 приведены результаты, полученные при использовании этой методики для определения С-концевых аминокислот нескольких химотриптических пептидов легкой цепи гем агглютинин а вируса гриппа. Ясно видны соответствующие аминокислоты пептидов С4А, С5, С6. Радиоактивность включенного в С-концевые аминокислоты трития существенно превышает уровень фона. На рис. 18.4 видно, что разделяются все аминокислоты, кроме Leu/Іle, которые частично перекрываются. Тем не менее и в этом случае возможна идентификация, так как радиоактивность отчетливо распределяется по двум пятнам, как это видно в случае пептида С3 (табл. 18.1). Благодаря применению различных систем растворителей, по-видимому, можно улучшить разделение [36]. Следует отметить, что во внутренние остатки Glu метка почти не включается, а во внутренние Asp включается в разной степени. Сообщалось, что остатки Asp, входящие в последовательность Asp-Gly (пептид С3, табл. 18.1), содержат значительно больше трития, чем другие внутренние остатки Asp (см. пептид С6, табл. 18.1) [41].
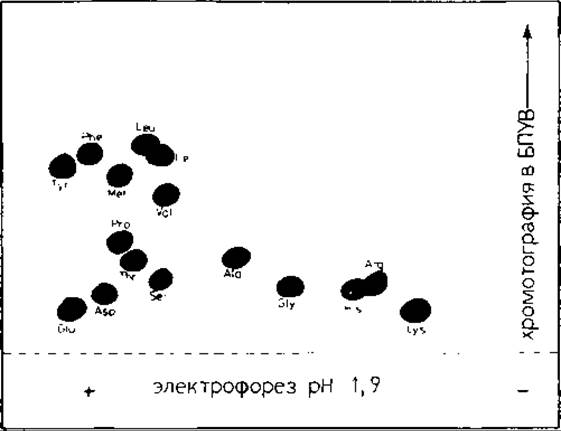
РИС. 18.4. Двумерное разделение хроматографией на бумаге смеси аминокислот после избирательного введения трития и гидролиза пептида. Гидролизат и смесь стандартных аминокислот разделяли электрофорезом при pH 1,9 в первом направлении и хроматографией — во втором направлении в системе н-бутанол — уксусная кислота — вода — пиридин (15:3:12:10).
При использовании системы пиридин — 3Н2О — уксусный ангидрид (4:2:1) в условиях, изложенных ранее, протекает быстрый катализируемый основанием гидролиз уксусного ангидрида, что приводит к разрушению ангидрида до завершения образования оксазолинона и к снижению выхода реакции. Использование большого избытка уксусного ангидрида не улучшает результаты, так как значительно возрастает температура реакции, что влияет на растворимость белка и происходят нежелательные побочные реакции [14, 38]. При использовании смеси пиридин — 3Н2О — уксусный ангидрид (3:1:3) на холоду включение трития в С-концевой остаток Leu лизоцима яичного белка увеличилось в ~20 раз [57].
18.3.1.2. Включение трития в белки [57]. Белок (50—100 нмоль) помещают в небольшую пробирку, добавляют 5 мкл (0,5 мКи) 3Н2О и 10 мкл пиридина. Раствор должен быть прозрачным, в противном случае включение метки будет неудовлетворительным. Если суммарный объем раствора окажется больше расчетного, то объемы всех реагентов также следует увеличить так, чтобы сохранить необходимые соотношения. Добавляют при 0 °С уксусный ангидрид (10 мкл), закрывают пробирку пленкой парафильм и выдерживают при 0 °С в течение 5 мин, затем при 20 °С еще 15 мин. Проводят при 0 °С второе добавление пиридина (20 мл) и уксусного ангидрида (20 мкл). Реакционную смесь оставляют при 0 °С в течение 5 мин, затем при 20 °С еще 1 ч. Избыток уксусного ангидрида разрушают добавлением меченой воды (5 мкл), реакционную массу оставляют при 20 °С на 1 ч. Раствор упаривают досуха, легко обменивающийся тритий удаляют путем повторения чередующихся операций добавления — упаривания (по 100 мкл) 10%-ной уксусной кислоты. Меченый белок гидролизуют 6 М соляной кислотой, идентифицируют аминокислоты и измеряют радиоактивность.
Таблица 18.1. Избирательное введение трития в некоторые пептиды химотриптического гидролизата легкой цепи гемагглютинина вируса гриппаа
|
Аминокислота |
Радиоактивность (имп./мин) |
|||
|
С3 |
С4 |
С5 |
С6 |
|
|
Lys |
218 |
83 |
35 |
72 |
|
His |
50 |
26 |
55 |
91 |
|
Arg |
50 |
24 |
44 |
146 |
|
Asp |
1860 |
170 |
58 |
248 |
|
Thr |
33 |
32 |
22 |
26 |
|
Ser |
37 |
31 |
30 |
48 |
|
Glu |
121 |
45 |
41 |
126 |
|
Pro |
38 |
12 |
5 |
23 |
|
Gly |
45 |
34 |
36 |
63 |
|
Ala |
39 |
20 |
22 |
29 |
|
Met |
68 |
117 |
47 |
23 |
|
Ile |
425 |
56 |
50 |
50 |
|
Leu |
1782 |
99 |
85 |
47 |
|
Tyr |
53 |
73 |
120 |
4523 |
|
Phe |
63 |
2451 |
3221 |
68 |
|
нмоль пептида |
7 |
4 |
6 |
11 |
a 4—11 нмоль пептидов метили и гидролизовали, как описано в разд. 18.3.1.1. Аминокислоты разделяли, как указано в подписи к рис. 18.4. Пептиды имели следующую структуру [92]:
С3 — Lys-Ser-Thr-Gln-Ala-Ala-Ile-Asp-Gln-Asp-Gly-Lys-Leu
С4 — Asn-Arg-Val-Ile-Glu-Lys-Thr-Asn-Glu-Lys-Phe
С5 — His-Gln-Ile-Glu-Lys-Glu-Phe
С6 — Ser-GIu-Val-Glu-Gly-Arg-Ile-Gln-Asp-Leu-Glu-Lys-Tyr.
Эта методика включения была использована для количественного определения С-концевых остатков [57]; обнаружено, что степень мечения сильно зависит от природы этой аминокислоты (табл. 18.2). Степень мечения меняется, но можно проводить количественное определение С-концевого остатка, введя поправку, учитывающую отношение включения трития в искомую и в стандартную С-концевые аминокислоты, определяемого и стандартного белков (табл. 18.2). Существуют и неразрешенные еще проблемы; так, не обнаруживается Pro, а определение Ser и Thr приводит к невоспроизводимым результатам; при наличии Gly в предпоследнем положении может снижаться содержание метки в С-концевой аминокислоте.
Таблица 18.2. Сравнительные коэффициенты включения трития в различные ацетиламинокислоты (относительно меченого ацетилаланина)а
|
Аминокислота |
Коэффициенты |
Аминокислота |
Коэффициенты |
|
Lys |
1,52 |
Gly |
0,68 |
|
His |
0,61 |
Ala |
1,00 |
|
Arg |
1,96 |
Val |
0,93 |
|
Asp |
0,32 |
Met |
2,32 |
|
Asn |
2,30 |
Ile |
1,18 |
|
Thr |
0,09 |
Leu |
2,27 |
|
Gin |
0,82 |
Туr |
1,95 |
|
Glu |
1,16 |
Phe |
2,01 |
а Навеску каждой N-ацетиламинокислоты метили тритием в присутствии известного количества N-ацетилаланина. После кислотного гидролиза и разделения аминокислот измеряли отношение удельной радиоактивности изучаемой С-концевой аминокислоты и внутреннего стандарта (Ala). Радиоактивность Ala принята за 1,00 [57].