Практическая химия белка - А. Дарбре 1989
Определение С-концевой последовательности аминокислот
Определение С-концевых групп
Гидразинолиз
Гидразинолиз впервые был использован в 1952 г. для определения С-концевых аминокислот; однако на практике этот простой метод часто приводит к неудовлетворительным результатам даже при введении большого числа поправок [1, 2, 11 —13, 45, 46, 62, 65, 66].
При нагревании белка (пептида) с гидразином пептидные связи разрываются, карбонильная группа пептидной связи образует гидразид. В виде свободной кислоты остается только С-концевая (рис. 18.5). Эту' аминокислоту отделяют от всех гидразидов и идентифицируют.
Исходную методику неоднократно модифицировали путем изменения условий проведения реакции, метода отделения гидразидов от свободной кислоты или метода определения и количественного анализа С-концевой аминокислоты.
Первоначально методика включала нагревание белка с гидразином при 100 °С в течение 10 ч [1]. При этих условиях цистин и цистеин (но не цистеиновая кислота, 5-карбоксиметил- цистеин или S-аминоэтилцистеин) полностью разрушаются [11]; Arg разрушается и частично превращается в Оrn и гуанидин [65]. Многие другие остатки частично разрушаются из-за высокой температуры реакции [11, 12]. Сообщалось, что добавление кислого катализатора (сульфат гидразина) к безводному гидразину позволяет проводить реакцию в гораздо более мягких условиях (60—80 °С) [46]; при этом повышается выход С-концевых аминокислот. Для улучшения выхода использовали Н+-форму ионообменной смолы амберлит CG-50 [12]. Показано, что скорости отщепления различных С-концевых аминокислот, а также устойчивость аминокислот в условиях гидразинолиза неодинаковы. Поэтому невозможно дать каких-либо рекомендаций, касающихся продолжительности проведения реакции, что обычно очень желательно. Поэтому следует провести серию опытов, изменяя время нагревания.
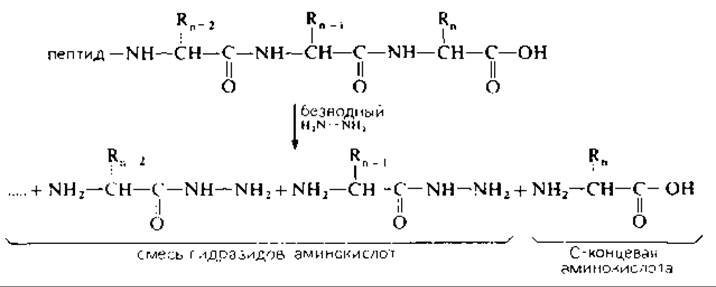
РИС. 18.5. Гидразинолиз пептида с освобождением С-концевой аминокислоты.
Отделение свободных С-концевых аминокислот от смеси гидразидов аминокислот следует проводить быстро, так как гидразиды малоустойчивы и в присутствии воды легко превращаются в свободные аминокислоты. Чувствительность определения зависит от метода разделения и чувствительности детектора. В первоначальном варианте к водному раствору гидразидов аминокислот добавляли свежеперегнанный бензальдегид, который превращал гидразиды аминокислот в маслянистые дибензали, легко отделяемые от свободных аминокислот путем центрифугирования [1]. Однако при однократной обработке бензальдегідом гидразиды аминокислот отделялись не полностью. Изменение методики и использование изоамилового альдегида [2], энантового (гептилового) альдегида [9], а также n-нитробензальдегида [66] не дали заметного улучшения. Гидразинолизат обрабатывали 2,4-динитрофторобензолом (ДНФ), что привело к образованию нейтральных ди- и три-ДНФ-производных, которые легко отделяются от кислой моно-ДНФ-С-концевой аминокислоты путем экстракции этилацетатом и диэтиловым эфиром [46]. Кислые ДНФ-производные идентифицировали методом двумерной бумажной хроматографии [53]. Можно обрабатывать гидразиды сначала бензальдегидом, потом ДНФ-бензолом, а затем уже проводить экстракцию [65]. С-Концевую ДНФ-аминокислоту определяли методом бумажной хроматографии.
Как указывалось в одной из работ [7], многие из этих сложных модификаций были предложены до появления современных методов аминокислотного анализа и в настоящее время устарели. Хотя гидразинолизат после удаления избытка гидразина можно нанести прямо на колонку аминокислотного анализатора, этого не рекомендуется делать, так как гидразиды очень трудно удалить с колонки и для регенерации смолы может потребоваться до пяти объемов обычных промывок едким натром. Предпочтительнее отделить гидразиды от свободной С-концевой аминокислоты, пропустив раствор через колонку с катионитом, например фосфоцеллюлозой или амберлитом IR-120, как описано ниже.
18.3.2.1. Методика гидразинолиза [12].
Получение безводного гидразина. Гидразин перегоняют над гидроксидом натрия под азотом в обычном стеклянном перегонном аппарате. В 250 мл круглодонную колбу помещают 100 мл «безводного» (продажного) гидразина (95%-ный) и 40 г гидроксида натрия, продувают прибор сухим азотом, пропущенным через концентрированную серную кислоту. Гидразин нагревают под азотом при атмосферном давлении до температуры кипения, затем охлаждают до комнатной температуры. Гидразин перегоняют в вакууме (масляный насос), в потоке азота, подаваемого через капилляр, собирая фракцию, кипящую при 16—18 °С в 100-миллиметровую круглодонную колбу-приемник, охлаждаемую сухим льдом. Перегнанный гидразин хранят в закрытой колбе над пентоксидом фосфора при 2 °С или лучше в запаянных ампулах (порциями по 5 мл). Гидразин быстро поглощает влагу воздуха и становится непригодным для проведения гидразинолиза.
Реакция гидразинолиза. Смолу (амберлит CG-50, <200 меш) промывают последовательно 1 М едким натром, водой, 2 М соляной кислотой, затем вновь водой до отрицательной реакции на хлорид-ионы. Смолу сушат в печи при 80 °С и хранят в вакуум-эксикаторе над пентоксидом фосфора.
Сухой амберлит CG-50 (50 мг) помещают в толстостенную пробирку из пирекса (15X125 мм). Добавляют лиофилизированный белок (~250 нмоль), на уровне верхней трети высоты пробирки делают перетяжку и вносят гидразин (2 мл), который втягивается внутрь пробирки через узкую перетяжку после охлаждения нижней части пробирки в спирте с сухим льдом. Важно исключить поглощение углекислого газа воздуха гидразином, так как это ведет к появлению большого количества нингидрин-положительного материала, который мешает при последующей хроматографии. Замороженный образец запаивают в вакууме, помещают в термостат при 80 °С на 10—100 ч. Во время гидразинолиза надо мягко встряхивать образец (3—4 раза в день). Если по каким-то причинам образец нельзя анализировать сразу после проведения гидразинолиза, раствор можно хранить, не вскрывая ампулы, при —20 °С.
После гидразинолиза реакционную смесь переносят в сухую круглодонную колбу на 25 мл, принимая меры для предотвращения попадания влаги воздуха. При возможности работу следует проводить в сухой камере. Пробирку ополаскивают гидразином (2 раза по 1 мл) и объединенный раствор лиофилизируют; через 3 ч гидразин полностью удаляется из замороженной смеси.
Хроматографическое отделение гидразидов от отщепленной С-концевой аминокислоты. В оригинальной методике [12] для хроматографического отделения свободной С-концевой аминокислоты от гидразидов аминокислот использовали три катионообменные смолы (амберлит IR-120, амберлит CG-50 и фосфоцеллюлозу). Для хроматографии на амберлите IR-120 необходимы два летучих буфера (pH 3,1 и 5,2) и колонка, термостатированная при 30 °С; время анализа составляет ~8 ч. Хроматография на фосфоцеллюлозе экспериментально проще, требует только 4 ч, происходит в одном буфере при комнатной температуре; при этом удается за один рабочий цикл отделить все аминокислоты, а также моногидразиды Asp и Glu. Однако фосфоцеллюлоза имеет меньшую емкость и на колонку размером 10x300 мм нельзя загружать >10 мг белка. Применение амберлита CG-50 не дает никаких преимуществ. Фракционирование с применением фосфоцеллюлозы описано ниже.

РИС. 18.6. Структура гидразидов внутренних остатков Asp и Glu и С-концевых Asn и Gln.
Непосредственно перед разделением лиофилизат, содержащий гидразиды, свободные аминокислоты и смолу-катализатор, суспендируют в 3,0 мл воды, центрифугируют, смолу дважды промывают 1 мл воды. Маточный раствор и промывки (pH 8,5—9,0) объединяют; добавляют несколько капель 2 М соляной кислоты до pH 2. Наносят раствор на колонку с фосфоцеллюлозой (10X300 мм, фирма Whatman, марка Р-70, нефракционированная), уравновешивают 0,4 М пиридин-формиатным буфером (pH 3,2; 32,2 мл пиридина + 47 мл 98%-ной муравьиной кислоты, доводят объем водой до 1 л), хроматографируют при комнатной температуре в буфере pH 3,2 при скорости потока 30 мл/ч. Собирают фракции по 2 мл, проверяют их нингидрином на наличие аминокислот. Кислые и нейтральные аминокислоты элюируются в объеме между 20 и 37 мл элюата, Lys, аммиак, моногидразиды Asp и Glu — между 42 и 75 мл, His — между 80 и 90 мл, Arg — между 93 и 112 мл. Гидразиды аминокислот прочно удерживаются на колонке, поэтому ее используют лишь один раз. Соответствующие фракции объединяют, сушат и анализируют. Перед определением Asp и Glu следует гидролизовать их моногидразиды.
Заключительный комментарий. Из-за различия как в скорости отщепления, так и в устойчивости С-концевых аминокислот невозможно дать конкретные рекомендации относительно продолжительности проведения реакции гидразинолиза. Лучше всего анализировать серию образцов, нагревая их при 100 °С в течение 10—100 ч. Методика позволяет проводить количественное определение всех С-концевых аминокислот, за исключением Arg, Asn, Gln и, возможно, Lys. При гидразинолизе С-концевые Asn и Gln выщепляются в виде моногидразидов (замещение по амидным группам боковых цепей). Эти моногидразиды по строению и хроматографическим свойствам очень похожи на моногидразиды, получающиеся из внутренних остатков Asp и Glu (рис. 18.6). Их определение затрудняется из-за того, что по некоторым сведениям оба моногидразида Asp могут взаимно превращаться друг в друга [62].