Практическая химия белка - А. Дарбре 1989
Фрагментация полипептидов химическими методами
Частичный кислотный гидролиз
Побочные реакции
Частичный кислотный гидролиз белка сопровождается рядом побочных реакций, таких, например, как дисульфидный обмен, образование дикетопиперазинов, циклизация N-концевого глутамина в пирролидонкарбоновую кислоту, а—ß-миграция остатков аспарагиновой кислоты, гидролиз аспарагина и глутамина с образованием карбоновых кислот, частичная деструкция остатков триптофана.
Реакция дисульфидного обмена [уравнение (2.12)] идет в сильнокислой среде в основном по механизму, включающему образование сульфиний-ионов RS+ [156, 212]. Фактически, при гидролизе инсулина в концентрированной НСl получают избыточное количество цистинсодержащих пептидов (но сравнению с числом S—S-связей) [156]. Следовательно, реакция дисульфидного обмена при частичном кислотном гидролизе существенно усложняет задачу локализации дисульфидных связей.
![]()
Если при частичном гидролизе белка образуются дипептиды, вполне возможно, что они не будут соответствовать природному фрагменту из-за инверсии порядка аминокислот. Причиной инверсии является циклизация дипептидов в дикетопиперазины, легко протекающая в разбавленных кислотах при комнатной температуре [уравнение (2.13)]. Гидролиз этих циклических соединений может привести как к исходному, так и к изомерному дипептиду с обращенной последовательностью аминокислот. Дикетопиперазины менее устойчивы в условиях кислотного гидролиза по сравнению с соответствующими дипептидами. Инверсия аминокислотной последовательности в 0,1 М НСl наглядно показана на примере глицилвалина [158].

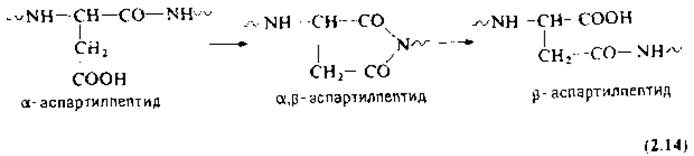
Реакция а,β-транспептидации остатка аспарагиновой кислоты идет в кислой среде через промежуточное образование сукцинимидного производного [уравнение (2.14)] [128, 185]. Образующееся ß-аспартилпроизводное придает пептидной связи устойчивость к гидролизу экзопептидазами, например лейцинаминопептидазой и карбоксипептидазами. Более того, ß-аспартилимид блокирует секвенирование по Эдману на стадии циклизации.
В достаточно мягких условиях идет циклизация N-концевого остатка глутамина (18) в пирролидонкарбоновую кислоту (19)
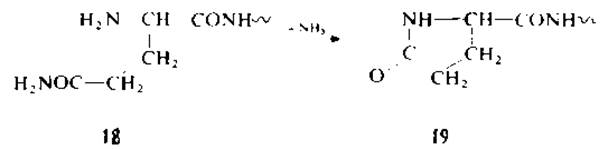
[77, 177]. Поэтому пептиды с N-концевым глутамином дают отрицательную реакцию с нингидрином и не могут быть секвенированы. Аналогичным образом может циклизоваться остаток глутаминовой кислоты, но в более жестких условиях. Относительно отщепления N-концевой пирролидонкарбоновой кислоты см. разд. 1.6.1.